SOCS2基因转染对人肾小球系膜细胞TGF-β、Ⅳ型胶原蛋白、纤维连接蛋白表达的影响
周月宏,田坚,沈静雪,赵晓伟(沈阳医学院附属中心医院,沈阳 110024)
SOCS2基因转染对人肾小球系膜细胞TGF-β、Ⅳ型胶原蛋白、纤维连接蛋白表达的影响
周月宏,田坚,沈静雪,赵晓伟(沈阳医学院附属中心医院,沈阳 110024)
摘要:目的观察过表达细胞因子信号转导抑制因子(SOCS2)对人肾小球系膜细胞(HMCs)中转化生长因子β(TGF-β)、Ⅳ型胶原蛋白(Collagen Ⅳ)、纤维连接蛋白(FN)表达的影响,并探讨其可能机制。方法 体外培养HMCs,分为A、B、C、D、E、F组,A、B组分别加入Ad-SOCS2病毒液(含SOCS2的腺病毒病毒液)、Ad-null病毒液(只含腺病毒的病毒液),24 h后将培养液更换成高糖培养液;C组加入30 mmol/L的D-葡萄糖;D、E组分别加入Ad-SOCS2病毒液、Ad-null病毒液,24 h后将培养液更换成常规培养液;F组加入5.5 mmol/L的D-葡萄糖+24.5 mmol的D-甘露醇。Western blotting法检测各组TGF-β、Collagen Ⅳ、FN及贾纳斯激酶2(JAK2)、信号传导及转录激活因子3(STAT3)、磷酸化贾纳斯激酶2(p-JAK2)、磷酸化信号传导及转录激活因子3(p-STAT3)。结果与F组比较,A、B、C组TGF-β、Collagen Ⅳ、FN、p-JAK2、p-STAT3的相对表达量升高;与C组比较,A组TGF-β、Collagen Ⅳ、FN、p-JAK2、p-STAT3的相对表达量降低;P均<0.01。结论 SOCS2通过抑制JAK/STAT信号通路来下调HMCs中TGF-β、Collagen Ⅳ、FN表达。
关键词:细胞因子信号转导抑制因子;肾小球系膜细胞;转化生长因子β;Ⅳ型胶原蛋白;纤维连接蛋白
糖尿病肾病(DN)是由糖尿病引起的一种危害性大的慢性并发症,肾小球系膜细胞作为DN的主要效应细胞,在DN的发生发展中发挥重要作用。近年来,有关细胞因子信号转导抑制因子(SOCS)抑制细胞因子信号转导的研究取得进展,特别是对JAK/STAT信号通路的负反馈作用被证实。JAK/STAT信号通路被证实与肾脏疾病的足细胞、系膜细胞、肾小管上皮细胞的病理改变相关[1]。研究[2,3]认为,SOCS1、SOCS3对DN肾组织有保护作用,而SOCS2是否对其有保护作用尚不清楚。2014年3~8月,我们观察了过表达SOCS2对人肾小球系膜细胞中纤维化相关蛋白表达的影响,并探讨其可能机制,为DN的防治提供理论依据。
1材料与方法
1.1材料人肾小球系膜细胞(HMCs)、SOCS2抗体,Ⅳ型胶原蛋白(Collagen Ⅳ)、贾纳斯激酶2(JAK2)、信号传导及转录激活因子3(STAT3)、磷酸化贾纳斯激酶2(p-JAK2)、磷酸化信号传导及转录激活因子3(p-STAT3)抗体;转化生长因子β(TGF-β)抗体;胎牛血清;纤维连接蛋白(FN)抗体;DMEM低糖培养基;Polybrene;SOCS2腺病毒套装;PMSF、BCA蛋白浓度测定试剂盒、一抗二抗去除液、羊抗兔IgG-HRP、NP-40裂解液;β-actin和辣根过氧化物酶标记的鼠单克隆抗体;ECL发光液。
1.2HMCs培养及高糖处理将HMCs接种于含10%胎牛血清、1%青链霉素的DMEM培养基中,培养至密度为90%左右,PBS清洗。弃上清,加入适当体积的0.25%胰酶消化细胞,待细胞变圆后,轻轻拍打瓶壁侧面,并加入常规培养基终止反应。用5 mL枪头吹打细胞瓶内各处细胞,15 mL试管收集混合液,800 r/min离心3 min。去上清,进行细胞计数,按实验内容接种细胞,将培养瓶置于37 ℃、5%CO2的培养箱内培养。HMCs的接种密度为1∶2,生长2~3 d传代。细胞培养至密度为70%左右,用PBS清洗2次。弃去上清,以PBS清洗1次,加入高糖培养基(将0.9 g葡萄糖溶解在200 mL含有10%胎牛血清、1%青链霉素的DMEM培养基中,过滤后使用,浓度为30 mmol/L D-葡萄糖)。
1.3HMCs分组及处理将HMCs接种于6孔板中,置于37 ℃、5%CO2的培养箱内培养过夜,24 h后进行感染,细胞密度一般在70%。实验分为6组。A、B组分别加入含有SOCS2的腺病毒病毒液、只含有腺病毒的病毒液(病毒数与细胞数比值为10∶1),24 h后将含有腺病毒的培养液更换成高糖培养液,37 ℃、5%CO2继续培养24 h。C组:将0.9 g葡萄糖溶解在200 mL含有10%胎牛血清、1%青链霉素的DMEM培养基中,过滤后使用,浓度即为30 mmol/L D-葡萄糖。D、E组分别加入含有SOCS2的腺病毒病毒液、只含有腺病毒的病毒液(病毒数与细胞数比值为10∶1),24 h后将含有腺病毒的培养液更换成正常培养液,37 ℃、5%CO2继续培养24 h。F组:将0.9 g甘露醇溶解在200 mL含有10%胎牛血清、1%青链霉素的DMEM培养基中,过滤后使用,浓度即为5.5 mmol/L D-葡萄糖+24.5 mmol D-甘露醇。
1.4HMCs中TGF-β、Collagen Ⅳ、FN、JAK、STAT、p-JAK2、p-STAT3检测采用Western blotting法。收集细胞,用NP-40裂解液(含1%PMSF)裂解细胞,离心后取上清,用BCA法测定蛋白浓度,同时加5×上样缓冲液,煮沸变性5 min,-80 ℃保存备用。本实验的上样体积20 μL,含40 μg蛋白。最后加入5 μL蛋白Marker电泳,半干转至PVDF膜,5%脱脂奶粉室温封闭1.5 h,将SOCS2、TGF-β、Collagen Ⅳ、FN、JAK、STAT、p-JAK2、p-STAT3特异性抗体分别与膜4 ℃孵育过夜。再以相应的二抗(1∶5 000)孵育2 h。免疫复合物使用ECL法检测。使用Gel Pro Analyzer软件分析条带灰度值,实验重复3次。
2结果
2.1各组TGF-β、Collagen Ⅳ、FN的相对表达量比较TGF-β、Collagen Ⅳ、FN的相对表达量比较见表1。
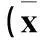
表1 各组TGF-β、Collagen Ⅳ、FN的相对表达量比较±s)
注:与F组比较,*P<0.01;与C组比较,△P<0.01。
2.2各组JAK、STAT、p-JAK2、p-STAT3的相对表达量比较JAK、STAT、p-JAK2、p-STAT3的相对表达量比较见表2。

表2 各组JAK、STAT、p-JAK2、p-STAT3的相对表达量比较±s)
注:与F组比较,*P<0.01;与C组比较,△P<0.01。
3讨论
DN的发病机制目前尚不明确,由糖尿病引起的微血管病变而导致肾小球硬化是本症的特点。多数学者认为,DN由多种因素导致,包括血流动力学、代谢、炎症、氧化应激、遗传等[4,5]。
SOCS家族是一类对细胞因子信号转导起负性调控,从而抑制其信号转导的蛋白分子。研究[6~9]证实,SOCS参与癌症、肝纤维化、肾脏纤维化和各种炎症反应。SOCS主要通过JAK/STAT信号转导通路的负性调节作用抑制相关细胞因子的信号转导,从而参与了多种生理与病理的发生发展过程。研究证实,JAK/STAT与多种肾脏疾病相关细胞及炎症相关细胞有关。目前,对于SOCS家族的研究多集中于SOCS1和SOCS3[10~12],而关于SOCS2的研究甚少。在肿瘤组织中,SOCS2能抑制JAK2的激活以及JAK2、STAT3的结合,SOCS2过表达可阻止STAT3激活及抑制c-Src蛋白所影响细胞的毒性[13]。有研究[10]表明,链佐脲菌素诱导的糖尿病大鼠肾脏组织中SOCS2表达降低,胰岛素可诱导肾小球系膜细胞SOCS2表达上调,且上调的SOCS2可以抑制IGF-1诱导的ERK1/2的激活,从而抑制Collagen Ⅳ的合成。我们的前期研究[14]已证实,在DN动物模型中,SOCS2可抑制JAK/STAT和ERK1/2信号通路,调控下游基因的表达,从而抑制肾脏组织的纤维化反应。
TGF-β是高血糖及一些导致肾脏损伤的生化因素的重要介质,与DN肾脏细胞的增殖、肾小球肥大等密切相关,同时也与肾间质的纤维化有关[15]。肾小球基底膜的胶原成分中最重要的是Collagen Ⅳ,它是典型的基质胶原,可由活化的肾小球系膜、上皮细胞、内皮细胞、肾小管上皮细胞等合成和分泌。所以,Collagen Ⅳ合成和降解平衡的失调是导致DN肾小球病理改变的主要因素之一[16]。FN是重要的细胞外基质组成成分,正常情况下其由系膜细胞产生,病理状态下系膜细胞大量表达FN等细胞外基质成分。
本研究显示,与F组比较,A、B、C组TGF-β、Collagen Ⅳ、FN、p-JAK2、p-STAT3的相对表达量升高;与C组比较,A组TGF-β、Collagen Ⅳ、FN、p-JAK2、p-STAT3的相对表达量降低。这说明SOCS2能通过抑制JAK/STAT信号通路及其调控的纤维化相关因子的活化与表达,从而减少纤维化,对DN的进展起到延缓作用,为DN药物的治疗找到了新的靶点,同时也为该病的防控提供理论依据。
参考文献:
[1] Kisseleva T, Bhattacharya S, Braunstein J, et al. Signaling through the JAK/STAT pathway, recent advances and future challenges[J]. Gene, 2002,285(1-2):21-24.
[2] Shi Y, Du C, Zhang Y, et al. Suppressor of cytokine signaling-1 ameliorates expression of MCP-1 in diabetic nephropathy[J]. Am J Nephrol, 2010,31(5):380-388.
[3] Ortiz-Munoz G, Lopez-Parra V, Lopez-Franco O, et al. Suppressors of cytokine signaling abrogate diabetic nephropathy[J]. J Am Soc Nephrol, 2010,21(5):763-772.
[4] Lai PB, Zhang L, Yang LY. Quercetin ameliorates d iabetic nephropathy by reducing the expressions of transforming growth factor-β1and connective tissue growth factor in streptozotocin-induced diabetic rats[J]. Renal Failur, 2012,34(1):83-87.
[5] Chuang PY, He JC. JAK/STAT signaling in renal diseases[J]. Kidney Int, 2010,78(3):231-234.
[6] Inagaki-Ohara K, Kondo T, Ito M, et al. SOCS, inflammation, and cancer[J]. JAKSTAT, 2013,2(3):e24053.
[7] Cheng C, Huang C, Ma TT, et al. New surprises of suppressor of cytokine signalling in liver fibrosis[J]. Expert Opin Ther Targets, 2014,18(4):415-426.
[8] Carow B, Rottenberg ME. SOCS3, a major regulator of infection and inflammation[J]. Front Immunol, 2014,5(19):58.
[9] Gao A, Van Dyke TE. Role of suppressors of cytokine signaling 3 in bone inflammatory responses[J]. Front Immunol, 2014,4(10):506.
[10] Isshiki K, He Z, Maeno Y, et al. Insulin regulates SOCS2 expression and the mitogenic effect of IGF-1 in mesangial cells[J]. Kidney Int, 2008,74(11):1434-1443.
[11] Ortiz-Munoz G, Lopez-Parra V, Lopez-Franco O, et al. Suppressors of cytokine signaling abrogate diabetic nephropathy[J]. J Am Soc Nephrol, 2010,21(5):763-772.
[12] Shi Y, Zhang Y, Wang C, et al. Suppressor of cytokine signaling-1 reduces high glucose-induced TGF-beta1 and fibronectin synthesis in human mesangial cells[J]. FEBS Lett, 2008,582(23-34):3484-3488.
[13] Banibrata Sen, Shaohua Peng, Denise M, et al. STAT5A-Mediated SOCS2 expression regulates Jak2 and STAT3 activity following c-Src inhibition in head and neck squamous carcinoma[J]. Clin Cancer Res, 2012,18(1):127-139.
[14] Zhou Y, Lv C, Wu C, et al. Suppressor of cytokine signaling (SOCS) 2 attenuates renal lesions inrats with diabetic nephropathy[J]. Acta Histochem, 2014,116(5):981-988.
[15] Mori J, Patel VB, Ramprasath T, et al. Angiotensin 1-7 mediates renoprotection against diabetic nephropathy by reducing oxidative stress, inflammation and lipotoxicity[J]. Am J Physiol Renal Physiol, 2014,306(8):812-821.
[16] Watanabe H, Sanada H, Shigetomi S, et al. Urinary excretion of type Ⅳ collagen as a specific indicator of the progression of diabetic nephropathy[J]. Nephron, 2000,86(1):27-35.
Effect of SOCS2 gene transfection on expression of TGF-β, Collagen Ⅳ and FN in human glomerular mesangial cells
ZHOUYuehong,TIANJian,SHENJingxue,ZHAOXiaowei
(TheCenterHospitalAffiliatedtoShenyangMedicalCollege,Shenyang110024,China)
Abstract:ObjectiveTo observe the effect of overexpressing suppressor of cytokine signaling 2 (SOCS2) on the expression of transforming growth factor β (TGF-β), Collagen Ⅳ and fibronectin (FN) in human glomerular mesangial cells (HMCs) and to investigate its possible mechanisms.MethodsHMCs cultured in vitro were divided into groups A, B, C, D, E and F. Groups A and B were respectively added with Ad-SOCS2 venom (containing SOCS2 adenovirus) and Ad-null venom (containing adenovirus), after 24 h, we changed the nutrient solution into high glucose solution; group C was added with 30 mmol/L D-glucose; groups D and E were respectively added with Ad-SOCS2 venom and Ad-null venom, after 24 h, we changed the venom into conventional solution; group F was added with 5.5 mmol/L D-glucose + 24.5 mmol D-mannitol.Western blotting was used to detect the TGF-β, Collagen Ⅳ, FN and Janus kinase 2 (JAK2), signal transducer and activator of transcription 3 (STAT3), phosphorylated Janus kinase 2 (p-JAK2) and phosphorylated signal transducer and activator of transcription 3 (p-STAT3).ResultsCompared with group F, the expression of TGF-β, Collagen Ⅳ, FN, p-JAK2, and p-STAT3 was significantly increased in the groups A, B and C; compared with group C, the expression of TGF-β, Collagen Ⅳ, FN, p-JAK2 and p-STAT3 in the group A was significantly decreased (all P<0.01). ConclusionSOCS2 can down-regulate the expression of TGF-β, Collagen Ⅳ and FN in HMCs by inhibiting JAK/STAT signaling pathway.
Key words:suppressor of cytokine signaling; mesangial cells; transforming growth factor β; Collagen IV; fibronectin
(收稿日期:2015-09-25)
中图分类号:R587.2
文献标志码:A
文章编号:1002-266X(2016)03-0017-03
doi:10.3969/j.issn.1002-266X.2016.03.006
作者简介:第一周月宏(1978-),女,博士,副主任医师,副教授,主要研究方向为糖尿病并发症。E-mail: zyhwylwys@163.com
基金项目:沈阳市科技计划项目(F13-220-9-10)。

