子宫内膜癌组织中miR-15a的表达变化及其对子宫内膜癌细胞侵袭转移的影响
吴松丽
(三峡大学仁和医院,湖北宜昌443000)
·基础研究·
子宫内膜癌组织中miR-15a的表达变化及其对子宫内膜癌细胞侵袭转移的影响
吴松丽
(三峡大学仁和医院,湖北宜昌443000)
摘要:目的探讨miR-15a在子宫内膜癌组织中的表达及其对子宫内膜癌细胞侵袭转移的影响。方法 选取原发性子宫内膜癌组织及癌旁组织标本79份,利用荧光定量PCR检测组织中miR-15a的表达。将miR-15a模拟物(miR-15a转染组)、无关序列模拟物(非转染组)转染入RL95-2人子宫内膜癌细胞,并设立阴性对照组。利用荧光定量PCR检测RL95-2细胞中miR-15a表达,利用Transwell肿瘤细胞迁移实验和Transwell肿瘤细胞侵袭实验对RL95-2细胞迁移能力和侵袭力进行检测,利用Western blotting法检测RL95-2细胞中基质金属蛋白酶2(MMP-2)的表达。结果miR-15a在子宫内膜癌组织中相对表达量(2.37±0.96)显著低于癌旁组织(4.83±1.27)(P<0.05);miR-15a在子宫内膜癌组织中的表达与FIGO分期、淋巴结转移和远处转移有关(P均<0.05);miR-15a转染组细胞中miR-15a相对表达量(8.71±2.65)显著高于阴性对照组(3.62±1.97)和未转染组(3.59±1.83)(P均 <0.05);miR-15a转染组穿膜细胞数显著低于阴性对照组和未转染组(P均<0.05);miR-15a转染组细胞中MMP-2蛋白相对表达量(1.62±0.59)显著低于阴性对照组(4.57±2.05)和未转染组(4.64±2.17)(P均<0.05)。结论 miR-15a在子宫内膜癌组织中呈低表达,过表达的miR-15a可通过抑制MMP-2蛋白抑制肿瘤细胞的侵袭及转移。
关键词:子宫肿瘤;miR-15a;侵袭;转移;基质金属蛋白酶2
子宫内膜癌是严重危害妇女健康的上皮性恶性肿瘤,占女性生殖道恶性肿瘤的25%~35%[1,2]。微小RNA(miRNAs)是一种内源性小分子RNA,可在转录水平上调控相关基因的表达而实现对生物学功能的调节[3]。研究[4]表明,miRNA不仅调控细胞增殖、生长、凋亡等过程,而且与肿瘤细胞的发生及进展关系密切。miR-15a是miR-15家族重要成员,是一类高度保守的miRNA[5]。有研究[6]指出,miR-15a与恶性肿瘤细胞浸润、转移过程关系密切。2012年10月~2014年10月,本研究观察了miR-15a在子宫内膜癌组织中的表达变化,并探讨其与临床病理特征及肿瘤细胞浸润、转移的关系,以期为临床实践提供基础资料。
1材料与方法
1.1标本、细胞及试剂来源经病理学检查的子宫内膜癌组织及癌旁组织79份,均来自三峡大学仁和医院。根据FIGO 2000分期:Ⅰ期11份、Ⅱ期24份、Ⅲ期29份、Ⅳ期15份;发生远处转移16份。 RL95-2人子宫内膜癌细胞购自上海研域生物工程有限公司,胎牛血清、DMEM培养基和0.25%胰酶均购自美国Gibco公司,总RNA提取试剂盒TRIzol和LipofectamineTM2000细胞转染试剂盒均购自美国Roche公司,miR-15a片段设计及合成均由生工生物工程(上海)股份有限公司完成,实时荧光定量PCR试剂盒购自南京生兴生物,Cell Counting Kit-8试剂盒购自武汉博士德生物工程有限公司,8.0 μm孔径Transwell小室购自北京乐博生物科技有限公司,基质金属蛋白酶2(MMP-2)抗体购自美国Abcam公司,辣根过氧化物酶标记山羊抗兔IgG和山羊抗兔(HRP标记)均购自中杉金桥生物公司,实时荧光定量PCR仪购自美国Bio-Rad公司。
1.2子宫内膜癌组织及癌旁组织miR-15a的检测采用荧光定量PCR法。 利用总RNA提取试剂盒提取肿瘤组织、癌旁组织的RNA。利用紫外分光光度仪对提取RNA浓度及纯度进行检测,取A260/A280值≥1.8样品进行PCR。将miR-15a设计成茎环引物进行逆转录合成cDNA:miR-15:5′-GTCGTATC-CAGTGCGTGTCGTGGAGTCGGCAATFGCACTGGAT-ACGACCACAAACC-3′。以cDNA为模板完成转录,以U6作为内参进行定量PCR测定。miR-15a逆转录引物:上游:5′-TAGCAGCACATAATGGTTTGTG-3′,以试剂盒中的通用引物作为下游引物。PCR反应条件:95 ℃预变性45 s,95 ℃ 10 s,74 ℃ 15 s,反复进行循环36次。每个样品设3个检测复孔进行重复实验。利用2-ΔΔCt法对miR-15a相对表达量进行分析。
1.3RL95-2细胞培养与miR-15a基因转染①将RL95-2细胞株置于DMEM培养基中,放于37 ℃、5% CO2培养箱中进行培养,细胞呈贴壁增殖,用0.25%胰酶消化、传代,取对数生长的细胞进行转染。②根据LipofectamineTM2000细胞转染试剂盒说明,分别将miR-15a模拟物(miR-15a转染组)、无关序列模拟物(未转染组)转染入RL95-2细胞,并设立阴性对照组,于转染后8 h将所有细胞置于新鲜完全培养基中进行培养。
1.4RL95-2细胞miR-15a表达的检测采用荧光定量PCR法。利用总RNA提取试剂盒提取转染48 h的细胞,其余步骤及结果的计算同1.2。
1.5RL95-2细胞迁移能力的检测采用Transwell肿瘤细胞迁移实验。将培养小室置入24孔板中,取2×105个转染24 h细胞重悬于无血清培养基中,将细胞混合液贴壁放置于小室上层,将含20% FBS的培养基加入到小室下层,于37 ℃、5% CO2条件下进行培养15 h,将小室取出并去除培养基,将上层细胞擦去,用PBS冲洗3次,于室温下用甲醇固定5 min,用0.5%结晶紫进行5 min染色后,用清水浸洗5~8次,倒置晾干后,用刀片将膜取下,封片后于高倍镜下随机选取5个视野对穿膜细胞进行计数。
1.6RL95-2细胞侵袭能力的检测 采用Transwell肿瘤细胞侵袭实验。取保存于-20 ℃的基质胶,于4 ℃条件下过夜融化,在冰上将4 ℃预冷的无血清培养基将基质胶稀释到1 mg/mL。取40 μL稀释后的基质胶包被小室多聚碳酸酯膜的上室面,于37 ℃条件下孵育3~5 h,凝固后备用;取4×105个转染24 h的细胞重悬于无血清培养基中,将细胞混合液加到基质胶上层,将含20% FBS的培养基加到小室下层,于37 ℃、5% CO2条件下培养24 h后将小室取出,擦拭掉上层细胞后,用PBS冲洗3次,室温下用甲醇进行固定后,用结晶紫进行染色,清水浸洗后晾干,封片。于高倍镜下随机选取5个视野对穿膜细胞进行计数。
1.7RL95-2细胞MMP-2蛋白的检测利用Western blotting法。利用蛋白提取试剂盒提取各组细胞总蛋白,用BCA法对蛋白浓度进行检测。取提取总蛋白进行SDS-PAGE凝胶电泳,湿转PVDF膜后,用5%脱脂牛奶进行封闭60 min,分别将1∶1 000和1∶20 000稀释的MMP-2及对照蛋白特异性一抗加入,于4 ℃下过夜孵育,用TBST进行漂洗4次,每次4 min,将相应浓度二抗加入后,于室温下静置60 min,再用TBST漂洗4次,每次4 min,加入ECL,于暗室条件下显影,利用Quantity One软件对显影条带进行分析。
2结果
2.1子宫内膜癌及癌旁组织中miR-15a的表达比较miR-15a在子宫内膜癌组织中相对表达量为2.37±0.96、癌旁组织为4.83±1.27,两者比较,t=10.896,P=0.000。
2.2miR-15a在子宫内膜癌组织中的表达与临床病理特征的关系miR-15a在子宫内膜癌组织中的表达与组织学分级和肌层浸润无关(P均>0.05),与FIGO分期、淋巴结转移和远处转移有关(P均<0.05),详见表1。
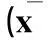
表1 miR-15a表达与子宫内膜癌临床病理特征的关系±s)
2.3各组miR-15a的相对表达量比较miR-15a转染组细胞中miR-15a相对表达量为8.71±2.65、阴性对照组为3.62±1.97、未转染组为3.59±1.83,三组间比较差异有统计学意义(F=27.165,P<0.05),miR-15a转染组高于阴性对照组及未转染组(t分别为14.148、14.190,P均<0.05)。
2.4各组细胞迁移力和侵袭力比较miR-15a转染组穿膜细胞数显著低于阴性对照组和未转染组(P均<0.05),详见表2。
2.5各组MMP-2蛋白表达的比较miR-15a转染
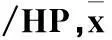
表2 各组细胞迁移力和侵袭力比较(个±s)
注:与未转染组相比,*P<0.05;与阴性对照组相比,#P<0.05。
组细胞中MMP-2蛋白相对表达量为1.62±0.59、阴性对照组为4.57±2.05、未转染组为4.64±2.17,三组间比较差异有统计学意义(F=49.381,P<0.05); miR-15a转染组低于阴性对照组、未转染组(t分别为10.458、7.747,P均<0.05)。
3讨论
子宫内膜癌是妇科常见恶性肿瘤,早期治疗往往预后良好,但随着肿瘤细胞发生浸润和转移,患者5年生存率显著下降[7]。肿瘤细胞浸润和转移是一个连续的、多步骤的生物学过程,需要多种细胞因子和生长因子共同参与完成[8],对肿瘤细胞浸润及转移相关机制的研究,有助于为肿瘤的生物治疗提供作用靶位。miR-15a是miRNA重要类型之一,位于人染色体13q14。研究[9]表明,miR-15a是抑癌基因,在多数恶性肿瘤中呈低表达或不表达。本研究显示,miR-15a在子宫内膜癌组织中相对表达量显著低于癌旁组织,进一步与临床病理特征关系分析显示,miR-15a在子宫内膜癌组织中的表达与FIGO高分期、淋巴结转移和远处转移有关,提示miR-15a可能抑制子宫内膜癌细胞转移和浸润。
为进一步研究miR-15a在子宫内膜癌细胞转移和浸润中的作用,采用体外细胞实验的方法,分别对RL95-2细胞转染不同的miR-15a模拟片段,利用Transwell肿瘤细胞迁移实验和Transwell肿瘤细胞侵袭实验[10]对miR-15a不同表达细胞的迁移力和侵袭力进行检测, 结果显示,miR-15a转染组穿膜细胞数显著低于阴性对照组和未转染组,说明miR-15a与子宫内膜癌细胞的迁移和侵袭力有关,过表达miR-15a可抑制RL95-2细胞体外迁移和侵袭力。
MMP-2作为MMPs家族重要成员,可使细胞外基质中纤维胶原发生裂解;同时,可使骨胶原发生降解,从而加速肿瘤细胞的扩散过程[11]。有研究[12]指出,子宫内膜癌组织中MMP-2蛋白表达量显著升高,且与淋巴转移及组织浸润有关。为进一步探讨miR-15a在抑制肿瘤细胞迁移和侵袭中的可能机制,本研究对不同转染组细胞中MMP-2蛋白表达水平进行检测,结果显示,miR-15a转染组细胞中MMP-2蛋白相对表达量显著低于阴性对照组和未转染组,说明过表达的miR-15a可能通过减少MMP-2蛋白表达而抑制子宫内膜癌细胞的侵袭和转移过程。
综上所述,miR-15a在子宫内膜癌组织中呈低表达,且与FIGO分期、淋巴结转移及远处转移密切相关,过表达的miR-15a可能通过抑制MMP-2显著抑制肿瘤细胞的迁移及侵袭,提示miR-15a在子宫内膜癌中发挥抑癌基因的作用,有望为子宫内膜癌早期发现提供参考及生物学治疗提供新的靶位。
参考文献:
[1] SGO Clinical Practice Endometrial Cancer Working Group, Burke WM, Orr J, et al. Endometrial cancer: a review and current management strategies: part I[J]. Gynecol Oncol, 2014,134(2):385-392.
[2] Barry JA, Azizia MM, Hardiman PJ. Risk of endometrial, ovarian and breast cancer in women with polycystic ovary syndrome: a systematic review and meta-analysis[J]. Hum Reprod Update, 2014,20(5):748-758.
[3] Katoh M. Therapeutics targeting angiogenesis: genetics and epigenetics, extracellular miRNAs and signaling networks (Review)[J]. Int J Mol Med, 2013,32(4):763-767.
[4] Perry MM, Adcock IM, Chung KF. Role of microRNAs in allergic asthma:present and future[J]. Curr Opin Allergy Clin Immunol, 2015,15(2):156-162.
[5] Li Y, Liu S, Zhang F, et al. Expression of the microRNAs hsa-miR-15a and hsa-miR-16-1 in lens epithelial cells of patients with age-related cataract[J]. Int J Clin Exp Med, 2015,8(2):2405-2410.
[6] 徐岷,周冰洁,王国英,等.miR-15a和miR-16通过调控bcl-2蛋白的表达逆转结肠癌细胞的耐药性[J].中华肿瘤杂志,2014, 36(12):897-902.
[7] 林瑞芳.人子宫内膜癌组织COX-2和CD44V6及Bcl-2表达临床意义分析[J].中华肿瘤防治杂志,2013,20(15):1172-1174.
[8] Pilarski R, Burt R, Kohlman W, et al. Cowden syndrome and the PTEN hamartoma tumor syndrome: systematic review and revised diagnostic criteria[J]. J Natl Cancer Inst, 2013,105(21):1607-1616.
[9] Shi L, Jackstadt R, Siemens H, et al. p53-induced miR-15a/16-1 and AP4 form a double-negative feedback loop to regulate epithelial-mesenchymal transition and metastasis in colorectal cancer[J]. Cancer Res, 2014,74(2):532-542.
[10] 常军,刘玲芳,郑殊娟,等.MiR-125b表达与子宫内膜癌细胞侵袭及迁移的研究[J].实用妇产科杂志,2014,30(9):693-697.
[11] Yu Z, Xie M, Fan X, et al. Interferon α2b increases MMP-13 and IL-10 expression in Kupffer cells through MAPK signaling pathways[J]. Hepatogastroenterology, 2015,62(138):350-354.
[12] Honkavuori-Toivola M, Santala M, Soini Y, et al. Combination of strong MMP-2 and weak TIMP-2 immunostainings is a significant prognostic factor in endometrial carcinoma[J]. Dis Markers, 2013,35(4):261-266.
(收稿日期:2015-08-25)
中图分类号:R737.33
文献标志码:A
文章编号:1002-266X(2016)01-0024-03
doi:10.3969/j.issn.1002-266X.2016.01.008

