丹皮酚对肝癌HepG2/ADM细胞株多药耐药性的逆转作用及其机制
孙爱华,陈劲,关恒明,李平
(1安徽医科大学附属省立医院,合肥230001;2安徽医科大学附属合肥医院·合肥市第二人民医院)
·论著·
丹皮酚对肝癌HepG2/ADM细胞株多药耐药性的逆转作用及其机制
孙爱华1,2,陈劲2,关恒明2,李平1
(1安徽医科大学附属省立医院,合肥230001;2安徽医科大学附属合肥医院·合肥市第二人民医院)
摘要:目的探讨丹皮酚体外给药对肝癌耐药细胞株HepG2/阿霉素(ADM)多药耐药性的逆转作用及其可能分子机制。方法 采用人的肝癌细胞株HepG2,体外ADM浓度递增法诱导建立耐药肝癌细胞HepG2/ADM 耐药模型。分别用0、5、10、25、50、100 μmol/L的丹皮酚培养液培养HepG2/ADM、HepG2细胞48 h,选定25、50 μmol/L丹皮酚进行下一步实验。分别采用ADM(0.01、0.2、0.5、0.75、1.5、3.0 μmol/L)和氟尿嘧啶(0、1、2、4、10、20、40 μmol/L)单独刺激,及25、50 μmol/L丹皮酚联合上述各浓度的氟尿嘧啶及ADM联合刺激2种细胞株。采用MTT法检测HepG2/ADM、HepG2细胞的增殖水平,流式细胞仪检测HepG2/ADM、HepG2细胞内细胞毒药物含量,蛋白免疫印迹法检测肿瘤细胞P-糖蛋白表达水平。结果ADM抑制HepG2/ADM、HepG2细胞株的IC50依次为1.48、124.14 μmol/L,耐药指数为83.9;丹皮酚(25、50 μmol/L)能够明显增强ADM、氟尿嘧啶对HepG2/ADM细胞株的细胞毒作用,并降低IC50值(P均<0.01),但对HepG2细胞的细胞毒作用无明显影响;丹皮酚(25、50 μmol/L)能够明显增加HepG2/ADM细胞株对ADM的摄取能力(P均<0.01),但对HepG2细胞株无明显影响;丹皮酚能显著降低HepG2/ADM细胞株P-糖蛋白表达水平(P均<0.01),但对HepG2细胞株P-糖蛋白水平无明显影响。结论 丹皮酚对HepG2/ADM细胞株多药耐药性具有明显的逆转作用,可能与其抑制HepG2/ADM 细胞株P-糖蛋白表达、增加细胞毒药物细胞内摄取有关。
关键词:肝肿瘤;HepG2/阿霉素细胞株;丹皮酚;多药耐药;P-糖蛋白
肝癌是临床最常见的恶性肿瘤,其发病机制未完全阐明[1]。目前临床用于治疗肝癌的化疗药物疗效差,不良反应明显[2]。研究[3]发现,P-糖蛋白介导的肿瘤细胞多药耐药是导致常规化疗药物药效较低的主要原因。丹皮酚是中药牡丹根皮、徐长卿全草的主要活性成分,具有抗心律失常、预防动脉粥样硬化、抑制血小板聚集、抗肿瘤和抗炎等多种药理活性[4,5]。研究[6]发现,丹皮酚不仅对肿瘤细胞株具有显著抑制作用,同时还可以增加人白血病细胞株K562/阿霉素(ADM)对化疗药物的敏感性[7],提示丹皮酚可能会逆转肝癌细胞的多药耐药现象。2015年6~10月,本文初步探讨了丹皮酚对人肝癌耐药细胞株HepG2/ADM是否具有耐药逆转作用以及其潜在的分子机制。
1材料与方法
1.1材料HepG2细胞株来源于中国科学院上海细胞库。药物与试剂:丹皮酚购自宣城百草植物工贸有限公司,纯度99%,批号:100321;ADM(纯度>98%)、氟尿嘧啶(纯度>98%)、维拉帕米(VRP)(纯度>98%)、溴化-3购自美国Sigma公司;DMEM购自美国Gibco公司;鼠抗人P-gp抗体购自美国Abcam公司;β-actin 抗体和化学发光法(ECL)显色试剂盒购自北京康为世纪生物科技有限公司;Bradford蛋白测定试剂盒购自北京索莱宝科技有限公司,其余试剂均为分析纯。实验仪器:BioTek ELx800酶标仪(美国BioTek公司);FACSCanto流式细胞仪(美国BD公司);IX73倒置荧光显微镜(Olympus,日本);3427型CO2细胞培养箱(美国Thermo公司)。
1.2肝癌耐药细胞株HepG2/ADM模型的建立及培养耐药细胞株HepG2/ADM参照ADM浓度梯度倍增进行诱导[8],具体步骤如下:取对数生长期HepG2细胞于培养瓶中培养至状态良好,弃去培养液,用含有ADM(0.005 mg/L) 的培养液继续培养24 h, 弃含药液、胰酶消化,收集细胞,按2×105/mL重新接种于培养瓶(不含ADM培养液),待细胞生长状态良好,进入对数期,重取1×106个细胞进行培养,并用ADM培养液(0.01 mg/L)继续培养24 h,重复上述操作,直至HepG2细胞可在含有0.5 mg/L ADM培养液中进行生长。耐药细胞株在正式实验前1周撤去含药培养液。HepG2及其耐药株HepG2/ADM均采用含10%胎牛血清DMEM培养液进行培养(37 ℃,5% CO2)。
1.3丹皮酚对HepG2和HepG2/ADM 细胞株无毒剂量的筛选采用MTT法[9]。丹皮酚细胞毒实验:取对数生长期HepG2、HepG2/ADM细胞种植于96孔板(1×104/孔),待细胞贴壁后,弃去培养液,换上含有不同浓度(0、5、10、25、50、100 μmol/L)丹皮酚培养液继续培养48 h。在终止培养前4 h,每孔加入10 μL MTT,培养结束后,弃去上清液,每孔加入DMSO 150 μL,均匀振荡10 min,酶标仪570 nm处测定吸光度值。肿瘤细胞生存率(%)=(A570加药组/A570不加药组)×100%。肿瘤细胞生长抑制率(%)=100%-肿瘤细胞生存率(%)。 丹皮酚加药浓度小于50 μmol/L时,对HepG2及其耐药株HepG2/ADM毒性相对较小,两者存活率均在90%以上,因此选定25、50 μmol/L进行下一步实验。
1.4丹皮酚对HepG2及HepG2/ADM细胞株中细胞毒药物IC50值影响的检测采用MTT法,方法同1.3。HepG2、HepG2/ADM细胞分别采用单独给药和联合给药进行处理。HepG2 细胞株给药情况如下:① HepG2单独给药:分别采用ADM(0、0.1、0.2、0.5、0.75、1.5、3.0 μmol/L)和氟尿嘧啶(0、1、2、4、10、20、40 μmol/L)进行刺激;② HepG2联合给药:25 μmol/L丹皮酚+ADM;50 μmol/L丹皮酚+ADM;25 μmol/L丹皮酚+氟尿嘧啶;50 μmol/L丹皮酚+氟尿嘧啶;5 μmol/L VRP+ ADM;5 μmol/L VRP+ 氟尿嘧啶,所采用ADM和氟尿嘧啶浓度同①。HepG2/ADM细胞株给药情况如下:①单独药物:分别采用ADM(0、10、25、50、100、200、400μmol/L)和氟尿嘧啶(0、10、25、50、100、200、400 μmol/L)进行刺激;② HepG2/ADM联合给药:包括以下分组,25 μmol/L丹皮酚+ADM;50 μmol/L丹皮酚+ADM;25 μmol/L丹皮酚+氟尿嘧啶;50 μmol/L丹皮酚+氟尿嘧啶;5 μmol/L VRP+ ADM;5 μmol/L VRP+ 氟尿嘧啶,所采用的ADM和氟尿嘧啶浓度同①。通过计算单独给药与联合给药IC50的比值评价丹皮酚对耐药细胞逆转活性,所有实验均平行制备3份,结果取平均值。
1.5肿瘤细胞摄取ADM能力的检测取对数生长期肿瘤细胞,按照每孔5×106个进行铺板,在含有不同浓度(25、50 μmol/L)丹皮酚培养基中培养24 h,随后细胞以冰冷磷酸盐缓冲液进行洗涤(重复3次),弃清洗液,细胞重悬于含有ADM的培养液中,继续培养24 h后,按照前述步骤,以冰冷缓冲液清洗3次,流式细胞仪检测细胞内平均荧光强度。
1.6肿瘤细胞P-糖蛋白的检测采用Western blotting法。将HepG2及其耐药株HepG2/ADM 接种于6孔板上,按照前述方法培养、加药。培养结束,细胞转移至离心管中,加细胞裂解液和蛋白酶抑制剂,冰上裂解30 min,每间隔5分钟轻微振荡离心管,离心(10 000 r/min,4 ℃,10 min)取上清液, Bradford 法测定蛋白质浓度。采用SDS聚丙烯酰胺凝胶电泳分离目的蛋白,转移至PVDF膜上,常规方法孵育一抗(4 ℃过夜)和通用二抗,超敏免疫印迹试剂检测蛋白表达。
2结果
2.1丹皮酚对HepG2及HepG2/ADM细胞株中细胞毒药物IC50值的影响见表1。在HepG2细胞株中,丹皮酚对ADM、氟尿嘧啶的IC50值无明显影响;在HepG2/ADM细胞株中,丹皮酚能明显降低ADM、氟尿嘧啶IC50值(P均<0.01);此外丹皮酚在50 μmol/L剂量下,对ADM、氟尿嘧啶逆转倍数依次为3.49、6.13,弱于阳性对照药VRP。

表1 丹皮酚对HepG2及HepG2/ADM细胞株中细胞毒药物IC50值的影响
注:与ADM比较,##P<0.01;与氟尿嘧啶比较,ΔΔP<0.01。
2.2丹皮酚对HepG2、HepG2/ADM细胞摄取ADM的影响结果见图1, HepG2/ADM细胞株内平均荧光强度明显低于HepG2细胞株(P<0.01,图1D), 而丹皮酚处理过的HepG2/ADM细胞株内平均荧光强度明显高于未处理的HepG2/ADM细胞株(P<0.01,图1D)。另外,丹皮酚处理的HepG2细胞株内平均荧光强度与未处理的HepG2细胞株之间差异无统计学意义(图1B)。
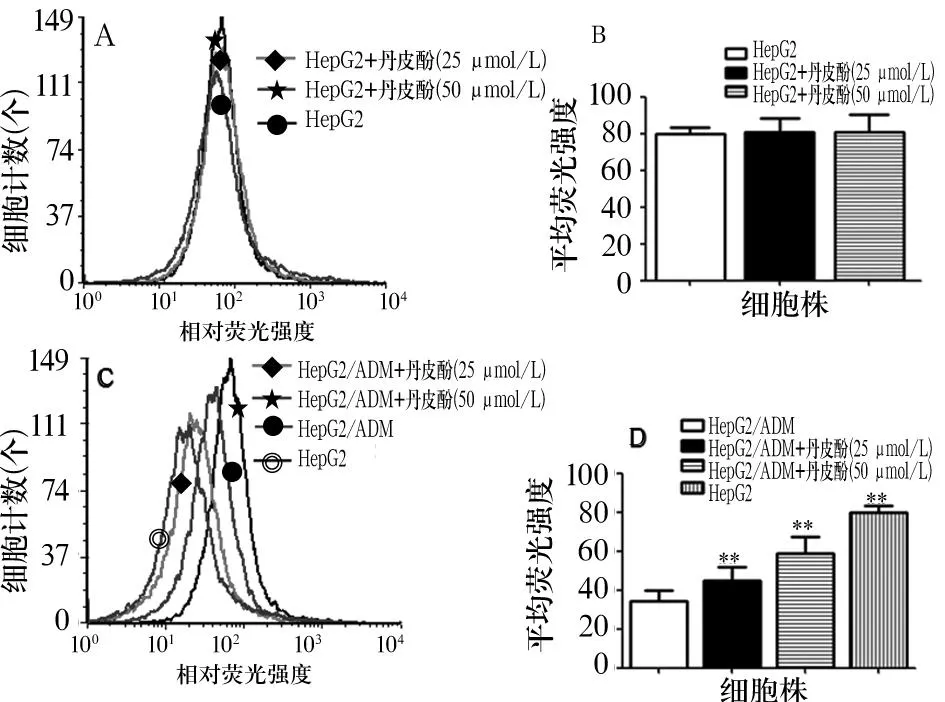
注:A、B: 丹皮酚对HepG2细胞株摄取ADM的影响;C、D: 丹皮酚对HepG2/ADM细胞株摄取ADM的影响;与HepG2/ADM相比,**P<0.01。
图1丹皮酚对HepG2、HepG2/ADM细胞株摄取ADM的影响
2.3丹皮酚对HepG2、HepG2/ADM细胞株P-糖蛋白表达的影响结果如图2所示,丹皮酚体外加药能够明显降低HepG2/ADM细胞株P-糖蛋白的表达(P<0.01,图2B),而对HepG2细胞株P-糖蛋白的表达则无影响(图2D)。

注:A、B:丹皮酚对HepG2/ADM细胞株P-糖蛋白表达的影响;1:HepG2/ADM;2:HepG2/ADM+25 μmol/L丹皮酚;3:HepG2/ADM+50 μmol/L丹皮酚;4:HepG2/ADM+5 μmol/L VRP;与HepG2/ADM相比较,**P<0.01; C、D:丹皮酚对HepG2细胞株 P-糖蛋白表达的影响;1:HepG2;2:HepG2+25 μmol/L丹皮酚;3:HepG2+50 μmol/L丹皮酚;4:HepG2+5 μmol/L VRP。
图2丹皮酚对HepG2、HepG2/ADM细胞株P-糖蛋白表达的影响
3讨论
肝癌细胞多药耐药现象是指临床上长期应用某一类细胞毒药物诱导出的耐药肝癌细胞株会对其他细胞毒药物产生交叉耐药。传统细胞毒药物选择性相对较差,对正常细胞和肿瘤细胞均具有明显杀伤性,因此即使在临床常规剂量下长期服用也能够产生明显的不良作用,如恶心、呕吐、脱发等[10]。针对肝癌多药耐药现象,单纯提高细胞毒药物剂量不是理想途径。P-糖蛋白是ABC转运体超家族成员,可将其作用底物从胞内泵出胞外,进而减弱药物效应[3]。早先研究证实,P-糖蛋白高度活化是肿瘤细胞多药耐药的主要诱因[3],因此近年来关于P-糖蛋白抑制剂的研究广受关注。迄今为止,已经报道的P-糖蛋白抑制剂可分为三代[11,12]。第一代抑制剂主要是Ca2+抑制剂(VRP)和免疫抑制剂(环孢素)。虽然具有较强的体外逆转活性,但在临床允许使用的剂量下往往达不到抑制P-糖蛋白所需的浓度;第二代抑制剂是在第一代抑制剂基础上进一步优化的产物,如右旋VRP、PSC-833。虽然具有更强生物活性,但对代谢细胞毒药物相关p450酶具有明显的抑制作用,延缓细胞毒药物体内清除和代谢,增加了毒性反应;第三代P-糖蛋白抑制剂,诸如LY335979和XY9576,虽然具有高选择性、较弱的药物相互作用,但目前尚无通过临床实验评价的药物上市。丹皮酚主要来源于毛茛科植物牡丹干燥根皮和萝藦科植物徐长卿的全草,具有良好生物活性。目前临床上应用的纯丹皮酚制剂主要有丹皮酚磺酸钠注射液、丹皮酚片和丹皮酚软膏,长期应用安全性较高[13]。研究[6,7, 14]发现,丹皮酚可以显著抑制肝癌细胞恶性增殖,与顺铂可联合抑制人肝癌细胞,同时其还可以显著增加人白血病细胞株K562/ADM对化疗药的敏感性,这些结果提示丹皮酚对耐药肝癌细胞株具有一定增敏作用。本文通过ADM体外刺激、培养出具有多药耐药性HepG2/ADM细胞株。研究发现无毒浓度下丹皮酚体外联合作用不仅可以增加HepG2/ADM对细胞毒性药物ADM和氟尿嘧啶摄取,同时也能明显降低这些抗癌药物IC50值;研究同时也表明丹皮酚对HepG2细胞株敏感性无明显影响。考虑到ADM是P-糖蛋白作用底物[15],进一步研究发现丹皮酚能够明显降低HepG2/ADM细胞株P-糖蛋白的表达,提示降低P-糖蛋白异常表达是丹皮酚增加HepG2/ADM化疗敏感性的原因之一。考虑到丹皮酚具有良好抗肝癌活性,因此在抗癌浓度下与细胞毒药物联合应用可能与药理作用机制上协同、促细胞毒药物胞内摄取两方面均有关。
综上所述,丹皮酚对HepG2/ADM细胞株的耐药性具有明显的逆转活性,可能与其降低耐药细胞株异常高表达的P-糖蛋白及促进细胞毒药物细胞内摄取有关。
参考文献:
[1] Xu LB, Liu C. Role of liver stem cells in hepatocarcinogenesis[J]. World J Stem Cells, 2014,6(5):579-590.
[2] Cao H, Phan H, Yang LX. Improved chemotherapy for hepatocellular carcinoma[J]. Anticancer Res, 2012,32(4):1379-1386.
[3] Namisaki T, Schaeffeler E, Fukui H, et al. Differential expression of drug uptake and efflux transporters in Japanese patients with hepatocellular carcinoma[J]. Drug Metab Dispos, 2014,42(12):2033-2040.
[4] 杨正生,彭振辉,姚青海,等.丹皮酚的药理作用研究进展[J].中国药物与临床,2011,11(5):545-547.
[5] 孙爱华,周碧蓉.小剂量氯吡格雷联合丹皮酚抗血小板聚集研究[J].安徽医科大学学报,2014,49(6):777-779,784.
[6] Sun GP, Wang H, Xu SP, et al. Anti-tumor effects of paeonol in a HepA-hepatoma bearing mouse model via induction of tumor cell apoptosis and stimulation of IL-2 and TNF-alpha production[J]. Eur J Pharmacol, 2008,584(2-3):246-252.
[7] 孙慧君,王晓琦,于丽敏,等.丹皮酚对MDR逆转作用的研究[J].解剖科学进展,2000,6(1):59-62.
[8] Zhai BJ, Shao ZY, Zhao CL, et al. Development and characterization of multidrug resistant human hepatocarcinoma cell line in nude mice[J]. World J Gastroenterol, 2006,12(41):6614-6619.
[9] Liu DL, Li YJ, Yao N, et al. Acerinol, a cyclolanstane triterpenoid from Cimicifuga acerina, reverses ABCB1-mediated multidrug resistance in HepG2/ADM and MCF-7/ADR cells[J]. Eur J Pharmacol, 2014,733:34-44.
[10] Cohen MH, Chen H, Shord S, et al. Approval summary: Cetuximab in combination with cisplatin or carboplatin and 5-fluorouracil for the first-line treatment of patients with recurrent locoregional or metastatic squamous cell head and neck cancer[J]. Oncologist, 2013,18(4):460-466.
[11] 刘念,耿小平,熊茂明.P-糖蛋白抑制剂的研究进展[J].国外医学:药学分册,2006(2):107-110.
[12] Saneja A, Khare V, Alam N, et al. Advances in P-glycoprotein-based approaches for delivering anticancer drugs: pharmacokinetic perspective and clinical relevance[J]. Expert Opin Drug Deliv, 2014,11(1):121-138.
[13] 王祝举,唐力英,赫炎.牡丹皮的化学成分和药理作用[J].国外医药:植物药分册,2006,21(4):155-159.
[14] Xu SP, Sun GP, Shen YX, et al. Synergistic effect of combining paeonol and cisplatin on apoptotic induction of human hepatoma cell lines[J]. Acta Pharmacol Sin, 2007,28(6):869-878.
[15] Zhang J, Sun T, Liang L, et al. Drug promiscuity of P-glycoprotein and its mechanism of interaction with paclitaxel and doxorubicin[J]. Soft Matter, 2014,10(3):438-445.
Reversal effect of paeonol on multidrug resistance of liver cancer cell line HepG2/ADM
SUNAihua1,CHENJin,GUANHeng-ming,LIPing
(1TheAffiliatedProvincialHospitalofAnhuiMedicalUniversity,Hefei230001,China)
Abstract:ObjectiveTo investigate the reversal activity of paeonol on multidrug resistance of liver cancer cell line HepG2/adriamycin (ADM) and its potential molecular mechanism. MethodsThe human HepG2 cell line was used to make the HepG2/ADM model which was induced by the increased concentrations of adriamycin (ADM). MTT assay was performed to detect the proliferation of HepG2/ADM and HepG2. The flow cytometer was used to measure the intracellular accumulation of cytotoxic drugs in HepG2/ADM and HepG2. Western blotting was carried out to determine the levels of P-glycoprotein. ResultsPaeonol with the concentrations from 0 to 50 μmol/L had no cytotoxicity to the HepG2/ADM and HepG2. The IC50values for inhibiting proliferation of HepG2/ADM and HepG2 were 1.48 μM and 124.14 μM, and the resistance index was 83.9. Paeonol (25 μmol/L, 50 μmol/L) could significantly enhance the cytotoxic effects of ADM and 5-fluorouracil on HepG2/ADM, and therefore reduced their IC50values (P<0.01), while It had no effect on those of HepG2. Moreover, Paeonol increased the accumulation of ADM in HepG2/ADM (all P<0.01), but not in HepG2. The further study found that Paeonol obviously reduced the expression level of P-glycoprotein in HepG2/ADM (all P<0.01), while had no effect on that of HepG2. ConclusionPaeonol can reverse the multidrug resistance of HepG2/ADM significantly, which may be related with the inhibition of P-glycoprotein expression and the increased accumulation of cytotoxic drugs.
Key words:liver neoplasms; HepG2/ADM cell line; paeonol; multidrug resistance; P-glycoprotein
(收稿日期:2015-10-12)
中图分类号:R735.7
文献标志码:A
文章编号:1002-266X(2016)01-0001-04
doi:10.3969/j.issn.1002-266X.2016.01.001
通信作者简介:李平(1964-),男,主任医师,主要研究方向为老年医学、中医肿瘤的诊治。E-mail:LiPing64@sina.com
作者简介:第一孙爱华(1979-),男,主治医师,主要研究方向为老年医学。E-mail:409019580@qq.com
基金项目:国家中医药管理局科研基金项目(2009030)。

