IL- 1β通过p38、JNK和NF- κB信号通路促进髓核细胞增殖
王小虎,吴小涛
(1.东南大学医学院,江苏 南京 210009; 2.东南大学附属中大医院 脊柱外科中心,江苏 南京 210009)
IL- 1β通过p38、JNK和NF-κB信号通路促进髓核细胞增殖
王小虎1,2,吴小涛1,2
(1.东南大学医学院,江苏 南京210009; 2.东南大学附属中大医院 脊柱外科中心,江苏 南京210009)
[摘要]目的:探讨白细胞介素1β(IL- 1β)对髓核细胞增殖的影响,并深入研究其机制。方法:体外培养人髓核细胞,用IL- 1β处理髓核细胞,通过CCK- 8实验和Ki67免疫荧光实验检测IL- 1β对髓核细胞增殖能力的影响。用Western blotting检测IL- 1β对MAPK和NF- κB信号通路的影响。通过对细胞信号通路进行特异性抑制,观察上述通路在IL- 1β作用于髓核细胞过程中的作用。结果:CCK- 8实验和Ki67免疫荧光实验均提示IL- 1β提高髓核细胞的增殖能力。Western blotting实验显示IL- 1β显著激活髓核细胞中的MAPK和NF- κB信号通路。使用p38、JNK和NF- κB的抑制剂均能明显抑制 IL- 1β诱导的髓核细胞增殖,而ERK的抑制剂则不能。结论:IL- 1β通过p38、JNK和NF- κB信号通路促进髓核细胞增殖。
[关键词]白细胞介素1β; 髓核细胞; 增殖; MAPK; NF- κB
腰痛是骨科最常见的临床症状之一,约80%的人在其一生中都会受到腰痛的困扰[1]。腰痛不仅给个人、家庭和社会带来了巨大的经济负担,而且还严重影响了患者的生活质量[2]。椎间盘退变被认为是引起腰痛的最重要原因[3]。多位学者证实,在椎间盘退变过程中,椎间盘细胞密度随着椎间盘退变程度的升高而增高[4- 6]。与此同时,退变椎间盘内细胞改变原有均匀的生长方式,转为团簇状聚集生长。Johnson等[7]报道在人退变椎间盘中常常能发现增殖中的细胞,特别是在成簇生长的细胞当中。退变椎间盘内常常出现细胞增殖能力升高,以致于后者已被作为椎间盘退变的一种标志物[8- 9]。随着椎间盘退变,多种炎症因子的表达显著增加。其中,白细胞介素1β(interleukin 1β,IL- 1β)被认为是调控椎间盘退变的最主要的炎症因子[10]。大量文献报道IL- 1β能促进包括肾上腺皮质细胞[11]、平滑肌细胞[12]、关节软骨细胞[13]等多种细胞的增殖。然而对于髓核细胞,IL- 1β是否能促进其增殖尚无定论。本研究在体外培养人髓核细胞,探讨IL- 1β是否影响髓核细胞的增殖,为了解椎间盘退变过程中髓核细胞的生长、增殖状况奠定基础。
1材料与方法
1.1材料
人髓核细胞和髓核细胞培养基购自美国ScienCell公司。重组人IL- 1β购自美国Peprotech公司。Cell Counting Kit- 8 (CCK- 8)试剂盒购自日本Dojindo公司。兔抗人Ki67抗体购自英国Abcam公司。Alexa Fluor 594驴抗兔IgG抗体购自美国Molecular Probes公司。抗磷酸化p65(P- p65)、p65、P- p38、p38、P- ERK、ERK、P- JNK、JNK、HRP标记的抗兔IgG二抗和U0126均购自美国CST公司。SP60025、SB203580和pyrrolidinedithiocarbamate ammonium(PDTC)均购自英国Tocris公司。
1.2方法
1.2.1髓核细胞培养人髓核细胞用含2%胎牛血清、1%髓核细胞生长添加剂和1%青霉素/链霉素溶液的髓核细胞专用培养基,于体积分数5%的CO2中37 ℃下进行培养。第5代细胞用于实验。
1.2.2CCK- 8实验将髓核细胞按照3 500个·孔-1接种于96孔板。待细胞贴壁后,向培养基中加入IL- 1β(0.1、1、10 ng·ml-1),继续培养48 h。然后弃去培养板中原有培养基,在每孔中加入100 μl新鲜培养基和10 μl CCK- 8试剂,继续培养4 h后于酶标仪450 nm波长下检测各孔吸光度值。为了检测信号通路的作用,我们将信号通路抑制剂预处理髓核细胞后,再加入IL- 1β作用细胞。细胞增殖率=(实验组吸光度-空白孔吸光度)/(对照组吸光度-空白孔吸光度)×100%。
1.2.3Ki67免疫荧光实验将髓核细胞接种于细胞爬片上。细胞贴壁后,实验组加入IL- 1β(10 ng·ml-1),继续培养24 h后用PBS洗涤3次,然后用4%多聚甲醛室温固定25 min。将多聚甲醛洗净后加入0.2% Triton X- 100破膜15 min,然后置于5%BSA中室温封闭1 h。随后用兔抗人Ki67抗体4 ℃孵育过夜。PBS洗涤5次后加入驴抗兔荧光二抗,室温孵育2 h。PBS洗涤后加入DAPI于37 ℃下孵育2 min。PBS洗涤5次后甘油封片,于激光共聚焦显微镜(日本Olympus公司)下观察。
1.2.4Western blotting实验实验组加入IL- 1β处理15 min后,提取各组细胞总蛋白。将蛋白样品通过10% SDS- PAGE电泳分离后,恒流(250 mA)转PVDF膜1 h,用5% BSA/TBST封闭1 h,加入一抗4 ℃孵育过夜,TBST洗膜3次×5 min,加入HRP标记的抗兔IgG二抗室温孵育1 h,TBST洗膜3次×5 min,ECL显色拍照。
1.3统计学处理
应用SPSS 17.0软件,采用单因素方差分析和t检验对结果进行统计分析,P<0.05为差异有统计学意义。
2结果
2.1IL- 1β促进髓核细胞增殖
我们首先用CCK- 8实验对细胞增殖进行分析,研究IL- 1β是否促进髓核细胞增殖。如图1,IL- 1β在浓度为0.1 ng·ml-1时即能显著促进髓核细胞增殖(P<0.01)。在0.1~10 ng·ml-1的浓度范围内,IL- 1β均能促进髓核细胞增殖(P< 0.01),且呈浓度依赖性。
为了进一步确定IL- 1β对髓核细胞增殖的影响,我们进行了细胞增殖标志物Ki67的免疫荧光实验。如图2,IL- 1β处理组的Ki67阳性率显著高于对照组(P<0.05)。
2.2IL- 1β激活髓核细胞中MAPK和NF-κB信号通路
为了深入研究IL- 1β诱导髓核细胞增殖的机制,我们先用Western blotting实验观察IL- 1β是否激活髓核细胞中的MAPK和NF-κB信号通路。如图3,IL- 1β作用髓核细胞15 min后,p38、ERK、JNK和p65均发生显著的磷酸化。
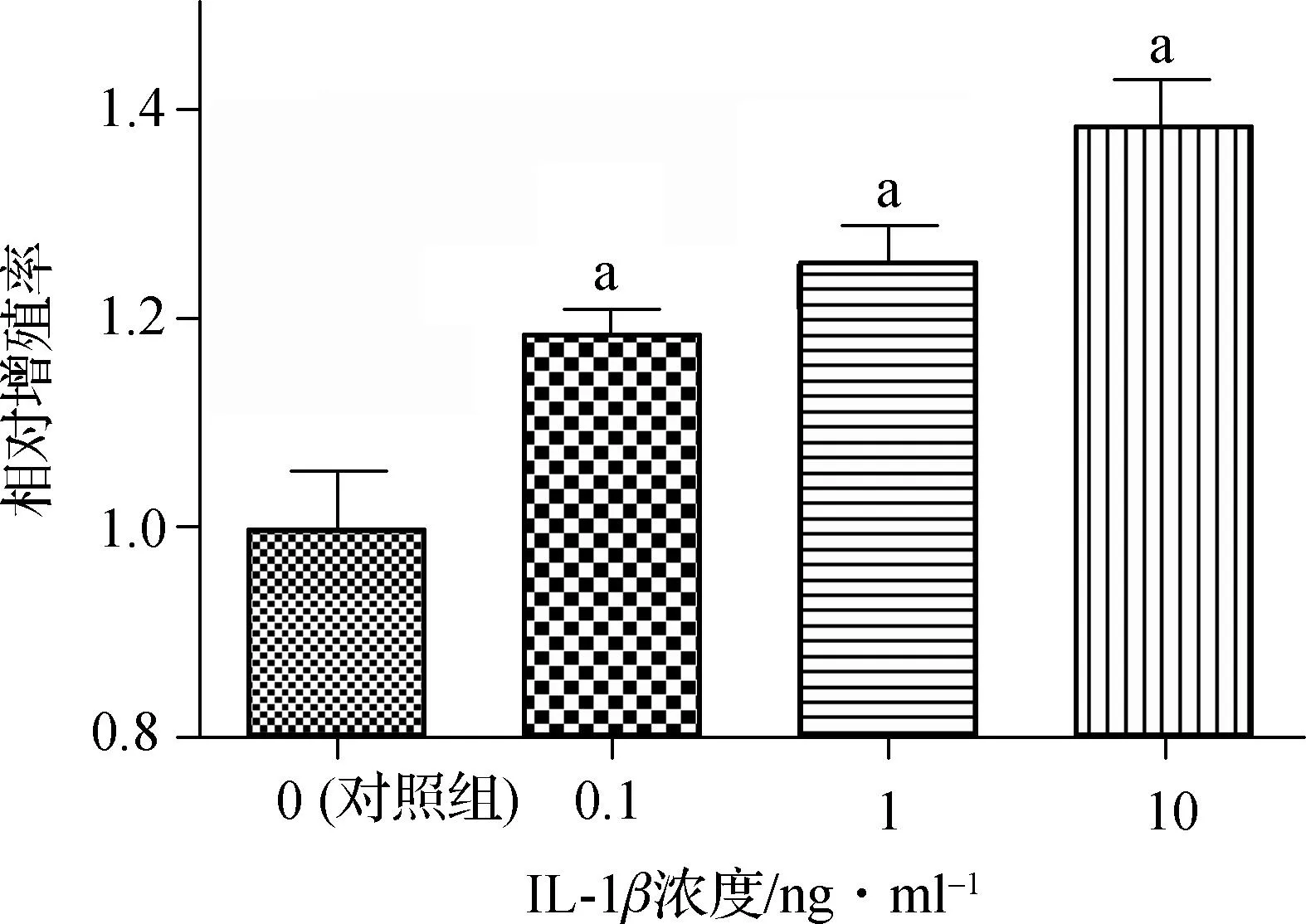
与对照组相比,aP<0.01
图1IL- 1β对人髓核细胞增殖的影响
Fig 1Effect of IL- 1βon proliferation of human nucleus pulposus cells
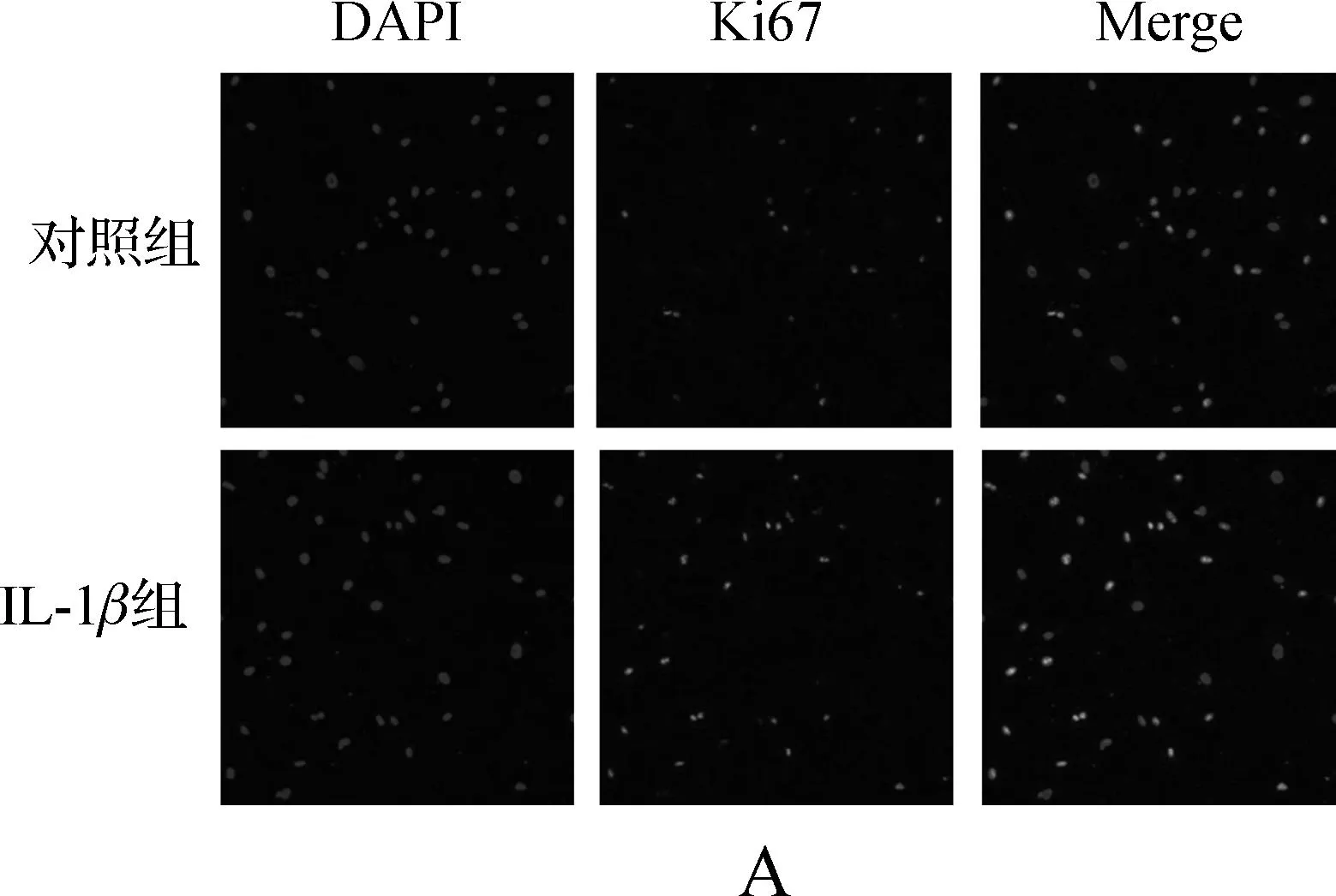
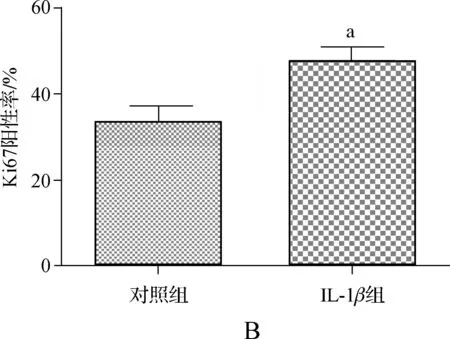
A.IL- 1β对髓核细胞表达Ki67的影响; B.统计结果,与对照组比较,aP<0.05
图2IL- 1β上调髓核细胞中Ki67的表达
Fig 2IL- 1βupregulates the expression of Ki67 in human nucleus pulposus cells
2.3IL- 1β通过激活p38、JNK和NF-κB信号通路诱导髓核细胞增殖
为了探讨MAPK和NF-κB信号通路在IL- 1β诱导髓核细胞增殖中发挥怎样的作用,我们用不同的抑制剂分别预处理髓核细胞,随后加入IL- 1β作用48 h后用CCK- 8检测细胞增殖。如图4,p38的抑制剂SB203580、JNK的抑制剂SP60025和NF-κB的抑制剂PDTC均能显著抑制 IL- 1β诱导的髓核细胞增殖(P< 0.01),而ERK的抑制剂U0126则不能(P>0.05)。
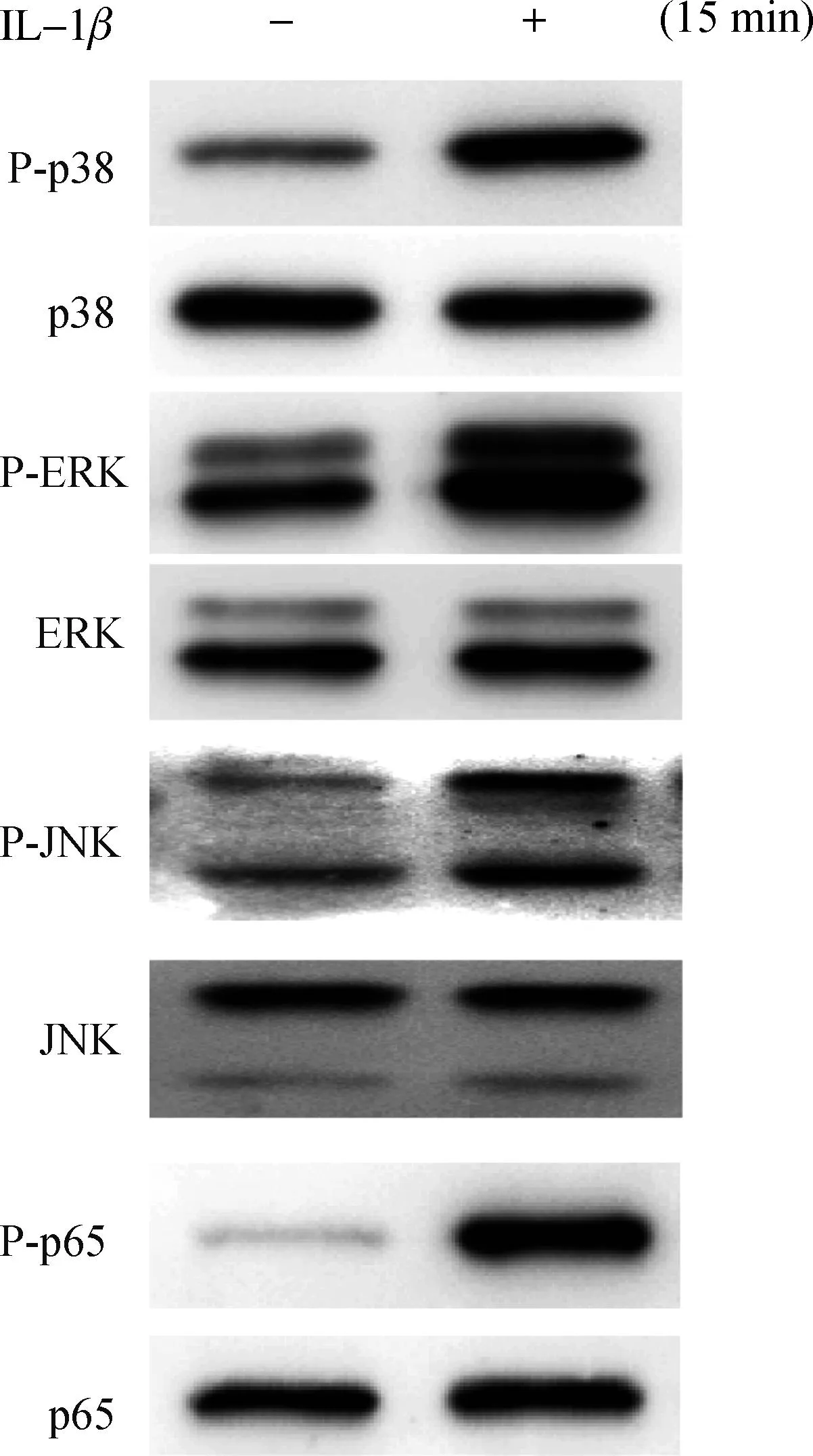
图3IL- 1β激活MAPK和NF-κB信号通路
Fig 3IL- 1βactivates MAPK and NF-κB signaling pathways

1组:未处理组;2组:单纯IL- 1β处理组;3组:p38抑制剂SB203580预处理组;4组:ERK抑制剂U0126预处理组;5组:JNK抑制剂SP60025预处理组;6组:NF-κB抑制剂PDTC预处理组;与单纯IL- 1β组(2组)相比,aP<0.01
图4信号通路抑制剂对IL- 1β诱导的髓核细胞增殖的影响
Fig 4Effect of signaling pathway inhibitors on IL- 1βinduction of nucleus pulposus cell proliferation
3讨论
椎间盘退变是多因素共同参与的复杂的慢性过程[14]。其中,炎症因子发挥了重要作用[15]。le Maitre等[16]通过比较正常椎间盘和退变椎间盘,发现在退变椎间盘中显著高表达IL- 1β。IL- 1β是一种强有力的促炎症因子。在椎间盘退变过程中,IL- 1β扮演了极为重要的角色[10]。IL- 1β不仅能刺激髓核细胞产生其他细胞因子,如IL- 6、前列腺素E2(prostaglandin E2,PGE2)等[17],还能上调基质降解酶的表达和活性,加速细胞外基质的降解[17- 19]。除此之外,IL- 1β还能抑制蛋白多糖和二型胶原的合成,加重椎间盘退变[16]。因此,IL- 1β通过改变髓核细胞的分泌表型调控了椎间盘退变的发生和发展过程。然而,IL- 1β是否会影响髓核细胞的增殖目前尚不明确。一些学者认为IL- 1β诱导髓核细胞凋亡[20- 22],从而导致椎间盘内髓核细胞数量的减少,进一步加重椎间盘退变。但最近的一项研究发现IL- 1β不仅不会抑制髓核细胞的增殖,而且还显著激活与细胞增殖关系密切的NOTCH信号通路[23]。
在动脉粥样硬化、慢性肝炎、慢性肾炎等炎症相关性疾病中,局部组织高表达多种炎症因子,构成了一个炎性微环境。在这种微环境下,炎症因子刺激相关细胞异常增殖,在疾病的病理生理过程中发挥了重要的作用。在退变的椎间盘中,同样高表达IL- 1β、TNF-α等炎症因子,也存在炎症因子的微环境。在这种炎性微环境的刺激下,髓核细胞是否也会出现异常的增殖呢?我们早期的研究已经证实,在短期刺激下,TNF-α能促进髓核细胞增殖[24]。为了探讨IL- 1β是否能诱导髓核细胞增殖,本研究首先通过CCK- 8实验,证实在0.1~10 ng·ml-1的浓度范围内,IL- 1β能促进髓核细胞增殖,且具有浓度依赖性。为了进一步确定IL- 1β对髓核细胞的促增殖作用,我们进行了Ki67免疫荧光实验。Ki67是一种公认的细胞增殖标志物。我们的结果显示,10 ng·ml-1的IL- 1β显著提高了髓核细胞的Ki67表达阳性率。这些结果提示我们短期的IL- 1β刺激促进髓核细胞的增殖。
文献报道MAPK和NF-κB是调控椎间盘退变的关键信号通路[19,25]。而且,MAPK和NF-κB也是调控细胞生长增殖的重要信号通路。在本研究中,我们发现IL- 1β作用髓核细胞15 min后,p38、ERK、JNK和p65均发生显著的磷酸化,表明上述通路被IL- 1β激活,与以往文献报道一致。CCK- 8实验结果显示p38、JNK和NF-κB信号通路的抑制剂均能在不同程度上抑制IL- 1β诱导的髓核细胞增殖,而ERK的抑制剂无效。这些结果提示在IL- 1β促进髓核细胞增殖的过程中,p38、JNK和NF-κB信号通路在其中发挥了重要的作用。
综上所述,本研究在体外初步证实IL- 1β通过激活p38、JNK和NF-κB信号通路促进了髓核细胞增殖,为全面了解髓核细胞在椎间盘内炎症微环境下的生存、增殖状况奠定了基础。与正常椎间盘中髓核细胞均匀生长不同,退变椎间盘中的髓核细胞呈团簇状生长。这种生长方式的改变与炎症因子诱导髓核细胞异常增殖是否紧密相关,以及它们与椎间盘退变的关系,均有待进一步的研究。
[参考文献]
[1] WADDELL G.Low back pain:a twentieth century health care enigma[J].Spine (Phila Pa 1976),1996,21(24):2820- 2825.
[2] DAGENAIS S,CARO J,HALDEMAN S.A systematic review of low back pain cost of illness studies in the United States and internationally[J].Spine J,2008,8(1):8- 20.
[3] JOUD A,PETERSSON I F,ENGLUND M.Low back pain:epidemiology of consultations[J].Arthritis Care Res (Hoboken),2012,64(7):1084- 1088.
[4] MAROUDAS A,STOCKWELL R A,NACHEMSON A,et al.Factors involved in the nutrition of the human lumbar intervertebral disc:cellularity and diffusion of glucoseinvitro[J].J Anat,1975,120(Pt 1):113- 130.
[5] ISHII T,TSUJI H,SANO A,et al.Histochemical and ultrastructural observations on brown degeneration of human intervertebral disc[J].J Orthop Res,1991,9(1):78- 90.
[6] HASTREITER D,OZUNA R M,SPECTOR M.Regional variations in certain cellular characteristics in human lumbar intervertebral discs,including the presence of alpha- smooth muscle actin[J].J Orthop Res,2001,19(4):597- 604.
[7] JOHNSON W E,EISENSTEIN S M,ROBERTS S.Cell cluster formation in degenerate lumbar intervertebral discs is associated with increased disc cell proliferation[J].Connect Tissue Res,2001 42(3):197- 207.
[8] NOMURA T,MOCHIDA J,OKUMA M,et al.Nucleus pulposus allograft retards intervertebral disc degeneration[J].Clin Orthop Relat Res,2001,389:94- 101.
[9] SAKAI D,MOCHIDA J,YAMAMOTO Y,et al.Transplantation of mesenchymal stem cells embedded in Atelocollagen gel to the intervertebral disc:a potential therapeutic model for disc degeneration[J].Biomaterials,2003,24(20):3531- 3541.
[10] PHILLIPS K L,CULLEN K,CHIVERTON N,et al.Potential roles of cytokines and chemokines in human intervertebral disc degeneration:interleukin- 1 is a master regulator of catabolic processes[J].Osteoarthritis Cartilage,2015,23(7):1165- 1177.
[11] ZIELENIEWSKI W,ZIELENIEWSKI J,STEPIEN H.Interleukin- 1 beta,but not IL- 1 alpha,stimulates cell proliferation in the adrenal cortex[J].Cytobios,1995,84(338- 339):199- 204.
[12] DAVIS R,PILLAI S,LAWRENCE N,et al.TNF- alpha- mediated proliferation of vascular smooth muscle cells involves Raf- 1- mediated inactivation of Rb and transcription of E2F1- regulated genes[J].Cell Cycle,2012,11(1):109- 118.
[13] BLANCO F J,GENG Y,LOTZ M.Differentiation- dependent effects of IL- 1 and TGF- beta on human articular chondrocyte proliferation are related to inducible nitric oxide synthase expression[J].J Immunol,1995,154(8):4018- 4026.
[14] 王小虎,吴小涛.椎间盘退变机制的研究概况[J].东南大学学报:医学版,2011,30(5):778- 783.
[15] 范宇栋,吴小涛.退变椎间盘细胞细胞因子分泌的改变及其影响[J].东南大学学报:医学版,2014,33(3):372- 375.
[16] le MAITRE C L,FREEMONT A J,HOYLAND J A.The role of interleukin- 1 in the pathogenesis of human intervertebral disc degeneration[J].Arthritis Res Ther,2005,7(4):R732- 745.
[17] JIMBO K,PARK J S,YOKOSUKA K,et al.Positive feedback loop of interleukin- 1beta upregulating production of inflammatory mediators in human intervertebral disc cellsinvitro[J].J Neurosurg Spine,2005,2(5):589- 595.
[18] SHEN B,MELROSE J,GHOSH P,et al.Induction of matrix metalloproteinase- 2 and- 3 activity in ovine nucleus pulposus cells grown in three- dimensional agarose gel culture by interleukin- 1beta:a potential pathway of disc degeneration[J].Eur Spine J,2003,12(1):66- 75.
[19] TIAN Y,YUAN W,FUJITA N,et al.Inflammatory cytokines associated with degenerative disc disease control aggrecanase- 1 (ADAMTS- 4) expression in nucleus pulposus cells through MAPK and NF- kappaB[J].Am J Pathol,2013,182(6):2310- 2321.
[20] ZHANG C C,ZHOU J S,HU J G,et al.Effects of IGF- 1 on IL- 1beta- induced apoptosis in rabbit nucleus pulposus cellsinvitro[J].Mol Med Rep,2013,7(2):441- 444.
[21] JIANG L,JIN Y,WANG H,et al.Glucosamine protects nucleus pulposus cells and induces autophagy via the mTOR- dependent pathway[J].J Orthop Res,2014,32(11):1532- 1542.
[22] YANG S D,YANG D L,SUN Y P,et al.17beta- estradiol protects against apoptosis induced by interleukin- 1beta in rat nucleus pulposus cells by down- regulating MMP- 3 and MMP- 13[J].Apoptosis,2015,20(3):348- 357.
[23] WANG H,TIAN Y,WANG J,et al.Inflammatory cytokines induce NOTCH signaling in nucleus pulposus cells:implications in intervertebral disc degeneration[J].J Biol Chem,2013,288(23):16761- 16774.
[24] WANG X H,HONG X,ZHU L,et al.Tumor necrosis factor alpha promotes the proliferation of human nucleus pulposus cells via nuclear factor- kappaB,c- Jun N- terminal kinase,and p38 mitogen- activated protein kinase[J].Exp Biol Med (Maywood),2015,240(4):411- 417.
[25] WANG X,WANG H,YANG H,et al.Tumor necrosis factor- alpha- and interleukin- 1beta- dependent matrix metalloproteinase- 3 expression in nucleus pulposus cells requires cooperative signaling via syndecan 4 and mitogen- activated protein kinase- NF- kappaB axis:implications in inflammatory disc disease[J].Am J Pathol,2014,184(9):2560- 2572.
IL- 1βpromotes the proliferation of human nucleus pulposus cells via p38,JNK and NF-κB
WANG Xiao- hu1,2,WU Xiao- tao1,2
(1.SchoolofMedicine,SoutheastUniversity,Nanjing210009,China; 2.SpineCenter,ZhongdaHospital,SoutheastUniversity,Nanjing210009,China)
[Abstract]Objective: To investigate the effect of IL- 1β on proliferation of human nucleus pulposus(NP) cells.Methods: NP cells were treated with IL- 1β.Cell proliferation was determined by CCK- 8 analysis and Ki67 immunofluorescence staining.To identify the mechanism by which IL- 1β induced proliferation of NP cells,Western blotting was carried out and selective inhibitors of MAPK and NF- κB signaling pathways were used.Results: Treatment with IL- 1β increased cell viability (as determined by CCK- 8 analysis) and the number of Ki67- positive NP cells. IL- 1β activated MAPK and NF- κB signaling pathways in NP cells. Moreover,inhibition of p38,JNK and NF- κB blocked IL- 1β- stimulated proliferation of NP cells. Conclusion: The current findings suggest that the effect of IL- 1β on intervertebral disc degeneration involves promotion of the proliferation of human NP cells via the p38,JNK and NF- κB pathways.
[Key words]interleukin 1β; nucleus pulposus cell; proliferation; MAPK; NF- κB
doi:10.3969/j.issn.1671- 6264.2016.01.007
[中图分类号]R329.28
[文献标识码]A
[文章编号]1671- 6264(2016)01- 0032- 05
[通信作者]吴小涛E- mail:wuxiaotao@medmail.com.cn
[作者简介]王小虎(1986-),男,湖北黄冈人,在读博士研究生。E- mail:nk_james@sina.com
[基金项目]国家自然科学基金资助项目(81272035);东南大学基础科研扶持项目(3290005431)
[收稿日期]2015- 09- 28[修回日期] 2015- 11- 13
[引文格式] 王小虎,吴小涛.IL- 1β通过p38、JNK和NF-κB信号通路促进髓核细胞增殖[J].东南大学学报:医学版,2016,35(1):32- 36.
·论著·

