miRNA- 140过表达腺病毒载体的构建及鉴定
贺鹏,段莉
[1.南方医科大学附属深圳恒生医院 口腔科,广东 深圳 518000; 2.深圳市第二人民医院
(深圳大学第一附属医院),深圳市组织工程重点实验室,广东 深圳 518035]
miRNA- 140过表达腺病毒载体的构建及鉴定
贺鹏1,段莉2
[1.南方医科大学附属深圳恒生医院 口腔科,广东 深圳518000; 2.深圳市第二人民医院
(深圳大学第一附属医院),深圳市组织工程重点实验室,广东 深圳518035]
[摘要]目的:构建稳定表达成熟miRNA- 140腺病毒表达载体。方法:从人类基因组中扩增出带有酶切位点的miRNA- 140目的基因,将目的基因连接到穿梭质粒pDC316- mCMV- EGFP,进一步将带有目的基因的穿梭质粒重组到骨架质粒AdEasy,并将重组质粒转染到AAV- 293细胞中包装成腺病毒载体,经过二次扩增之后获得高滴度的腺病毒,并且检测其包装效率及感染滴度。最后,用目的腺病毒感染骨肉瘤细胞,通过荧光定量PCR方法检测miRNA- 140表达情况。结果:酶切鉴定和测序结果均表明,miRNA- 140 成功克隆入pDC316- mCMV- EGFP 载体中。与AdEasy重组后,包装纯化具有感染性的腺病毒miRNA- 140,通过荧光定量PCR检测,软骨肉瘤细胞中miRNA- 140升高4.2±0.2倍。 结论:成功构建了成熟miRNA- 140的腺病毒表达载体。
[关键词]miRNA- 140; AdEasy系统; 荧光定量PCR; 骨肉瘤细胞
microRNA(微小RNA)以下简称miRNA,是真核生物体内广泛分布的一类长约19~25 bp核苷酸的内源性非编码单链小RNA分子,其依赖于miRNA成熟体和靶基因mRNA的3′UTR(非翻译区)互补性的机制,从而在基因的转录水平上对目的基因表达进行负向调控,导致mRNA翻译抑制或者降解[1- 2]。miRNA的功能十分强大,人体内编码蛋白质的基因中有30%受到miRNA的调控,而每个miRNA可以调节数百个靶基因,因此,探讨miRNA在基因表达调控领域的研究有重要意义。其中miRNA表达载体已成为miRNA研究的重要工具之一,miRNA真核表达载体已被广泛应用于生物体内基因的功能研究领域。 目前,在骨肉瘤的治疗过程中一般偏向于采用化疗联合手术切除的综合疗法。然而,随着药物治疗时间的延长, 骨肉瘤耐药性出现极大影响了新开发辅助药物治疗的效果,从而导致骨肉瘤治疗失败。最近研究表明,骨肉瘤的最新生物标记miRNA- 140与骨肉瘤的耐药性关系密切[3- 5]。因此,构建miRNA- 140的过表达腺病毒载体,可为进一步探讨miRNA- 140在骨肉瘤耐药中的作用机制奠定基础。
本研究利用基因工程技术克隆了人miRNA- 140编码基因, 并完成其腺病毒载体的构建。将miRNA- 140与包装载体转染AAV- 293(腺相关病毒- 293)细胞, 收获腺病毒,为探讨miRNA- 140在骨肉瘤耐药中的作用机制提供工具。此外,成功构建可在细胞内稳定表达miRNA- 140的表达载体将为进一步研究相关基因功能奠定基础。
1材料和方法
1.1实验材料
AAV- 293细胞(深圳市第二人民医院中心实验室保存),DH5a感受态细胞(深圳市第二人民医院中心实验室制备),pDC316- mCMV- EGFP和 pBHGloxdeltaE1,3Cre质粒(本实验室保存),Trizol试剂 (Invitrogen公司),DNA提取试剂盒、质粒提取试剂盒(Omega公司),各种工具酶、DNA marker (Takara公司),其余试剂为国产分析纯。
1.2重组腺病毒载体pDC316- miRNA- 140的构建及鉴定
根据GenBank中miRNA- 140的序列设计合成引物,miRNA- 140编码序列碱基NW- 926462.1,核苷酸位置 23546875- 23547470(表1), 以人类基因组为模板,PCR扩增出595bp片段。 载体pDC316- mCMV- EGFP经PstⅠ 和HindⅢ 酶切后直接去磷酸化,琼脂糖凝胶电泳后回收线性化载体。常规方法连接转化,经测序验证。
表1普通PCR以及实时荧光定量引物序列
Tab 1Primers used for stem- loop reverse transcription or polymerase chain reaction of mi- RNAs

RNA引物序列(5'-3')miRNA-140SenseGTAGGCACTGCAGATGAGAGAGAGAGAGCGCTGTAntisenseATCGACAAGCTTCATGCTGCCTTCAGATGAGAmiRNA-140-5pStem-loopprimerGTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCTACCATSenseCGCGCCAGTGGTTTTACCCTAntisenseCCAGTGCAGGGTCCGAGGTAU6Stem-loopprimerGTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACACGATTSenseCCTGCGCAAGGATGACAntisenseGTGCAGGGTCCGAGGT
1.3重组腺病毒miRNA- 140制备
腺病毒包装细胞AAV- 293 用含10%胎牛血清的高糖DMEM培养液进行培养,控制细胞汇合度为50%进行传代扩增。准备进行包装24h前将细胞传代接种于直径10cm 的细胞培养皿,转染前细胞生长密度至培养皿底面积的70%~80%,每皿约3×106个细胞。重组腺病毒穿梭质粒pDC316- miR- 140- EGFP、阳性对照pDC316- GFP,分别通过Biotool DNA Transfection Reagent与腺病毒骨架质粒pBHGloxdeltaE1,3Cre共转染AAV- 293细胞。每天观察细胞出毒现象,出毒现象为细胞变大变圆,呈葡萄状,并开始出现明显噬斑。病毒包装72h后,在激发波长488nm处利用倒置荧光显微镜观察AAV- 293细胞中绿色荧光蛋白的表达,计数表达绿色荧光细胞的比例,确定转染后病毒包装感染效率。
1.4病毒液的收集和纯化
用细胞刮刀把贴壁细胞全部刮落到培养液中,转移到消毒、预冷的50ml离心管中,反复冻融4次(-80℃和37℃水浴), 每次冻融的时间为15 min左右。随后以12000 r·min-1离心10 min 除去细胞碎片。将含病毒的上清转入新的离心管中。向病毒液中加入1/10 体积的氯仿,37 ℃ 300r·min-1剧烈振摇1h。然后加入氯化钠粉末2.56 g至终浓度为1mol·L-1,4℃、12000 r·min-1离心30min后收集离心管中的上清液于一新的50ml离心管中,加入PEG8000至终浓度10%,振摇至其完全溶解,然后冰上放置1h。最后4 ℃、12000 r·min-1离心30min,弃上清,向沉淀中加入4ml PBS溶解沉淀并分装冻存于-80℃, 命名为pAd- has- miRNA- 140。
1.5骨肉瘤细胞中miRNA- 140 表达水平的检测
pAd- has- miRNA- 140感染骨肉瘤细胞后, 提取总RNA,RT- PCR(实时定量聚合酶链反应)方法检测miRNA水平。分别以140- RT和U6- RT为引物,对RNA进行反转录,合成cDNA第一链。以cDNA为模板,用特异性上游引物140- qRTf 或U6- qRTf 以及通用下游引物Reverse(表1)分别对目的基因miR- 140 及内参基因U6 snRNA 进行扩增,反应体系按照SYBR Premix Ex Taq Ⅱ荧光定量PCR 试剂盒说明进行,用ABI 7300荧光定量PCR系统进行检测。采用相对定量方法进行miRNA水平分析,miR- 140表达水平用2- ΔCt表示,其中ΔCt=CtmiR- 140-CtU6。设对照组(感染空载体病毒的骨肉瘤细胞)miRNA- 140表达水平为1,计算实验组(干扰pAd- has- miRNA- 140病毒的骨肉瘤细胞)miRNA- 140的相对表达水平。
1.6统计学处理
应用GraphPad Prism 5.0软件进行数据分析和统计图制作。两组间miRNA- 140表达水平比较用Student’t检验,P<0.05为差异有统计学意义。
2结果
2.1腺病毒穿梭质粒的构建、同源重组及鉴定
pDC316- miRNA- 140- EGFP经PstⅠ和HindⅢ双酶切鉴定(图1)、DNA测序结果证实,与miRNA- 140编码序列的同源性为100%。该结果表明已成功将miRNA- 140定向克隆至穿梭质粒pDC316- mCMV- EGFP中。

M.DNA marker;1、2.pDC316- miRNA- 140- EGFP双酶切
图1重组腺病毒质粒pDC316- miRNA- 140- EGFP的PstⅠ和HindⅢ双酶切鉴定
M.DNA marker;1,2.pDC316- miRNA- 140- EGFP double digestion
Fig 1The recombinant adenovirus plasmid was identified withPstⅠ andHindⅢ digestion
2.2pDC316- miRNA- 140质粒成功转染至腺病毒包装细胞AAV- 293
质粒共转染AAV- 293 细胞24h后倒置显微镜下观察发现,细胞变大变圆,呈葡萄状,并开始出现明显噬斑。72h后荧光显微镜下观察到细胞荧光表达率高达70%(图2)。该结果表明pDC316- miRNA- 140质粒已成功转染腺病毒包装细胞AAV- 293。
2.3实时定量PCR检测miRNA- 140的表达
pDC316- miRNA- 140病毒感染骨肉瘤细胞后,利用实时定量PCR检测miRNA- 140表达情况,与对照组比较,实验组的miRNA- 140明显升高(图3)。该结果表明pDC316- miRNA- 140病毒已成功感染骨肉瘤细胞。
3讨论
越来越多的研究表明,miRNA与肿瘤的发生密切相关[6- 7]。对miRNA在不同组织和疾病中的表达谱分析发现, miRNA 在骨肉瘤表达谱具有明显的组织特异性, 在该类疾病中miRNA的表达谱改变具有明显的特征。这些特点使miRNA有可能成为骨肉瘤诊断的新的生物学标记和治疗药物作用的靶标。大量研究证据也表明,miRNA异常表达在骨肉瘤的发病、后期恶化及转移中扮演重要角色,许多重要的miRNA参与骨肉瘤细胞的免疫逃逸反应、肿瘤新生血管的生成及其耐药性等等。目前,肿瘤相关miRNA具备应用于骨肿瘤的分型、诊断、预后判断、药效评估及用于辅助的相关治疗等方面的潜能[8- 10]。

A.倒置显微镜下观(×100); B.荧光显微镜下观(×100)
图2重组腺病毒质粒pDC316- miRNA- 140- EGFP在包装细胞AAV- 293中的表达情况
A.Under the invert microscope(×100); B.Under the fluorescent microscope(×100)
Fig 2The expression of the recombinant adenovirus plasmid pDC316- miRNA- 140- EGFP in AAV- 293
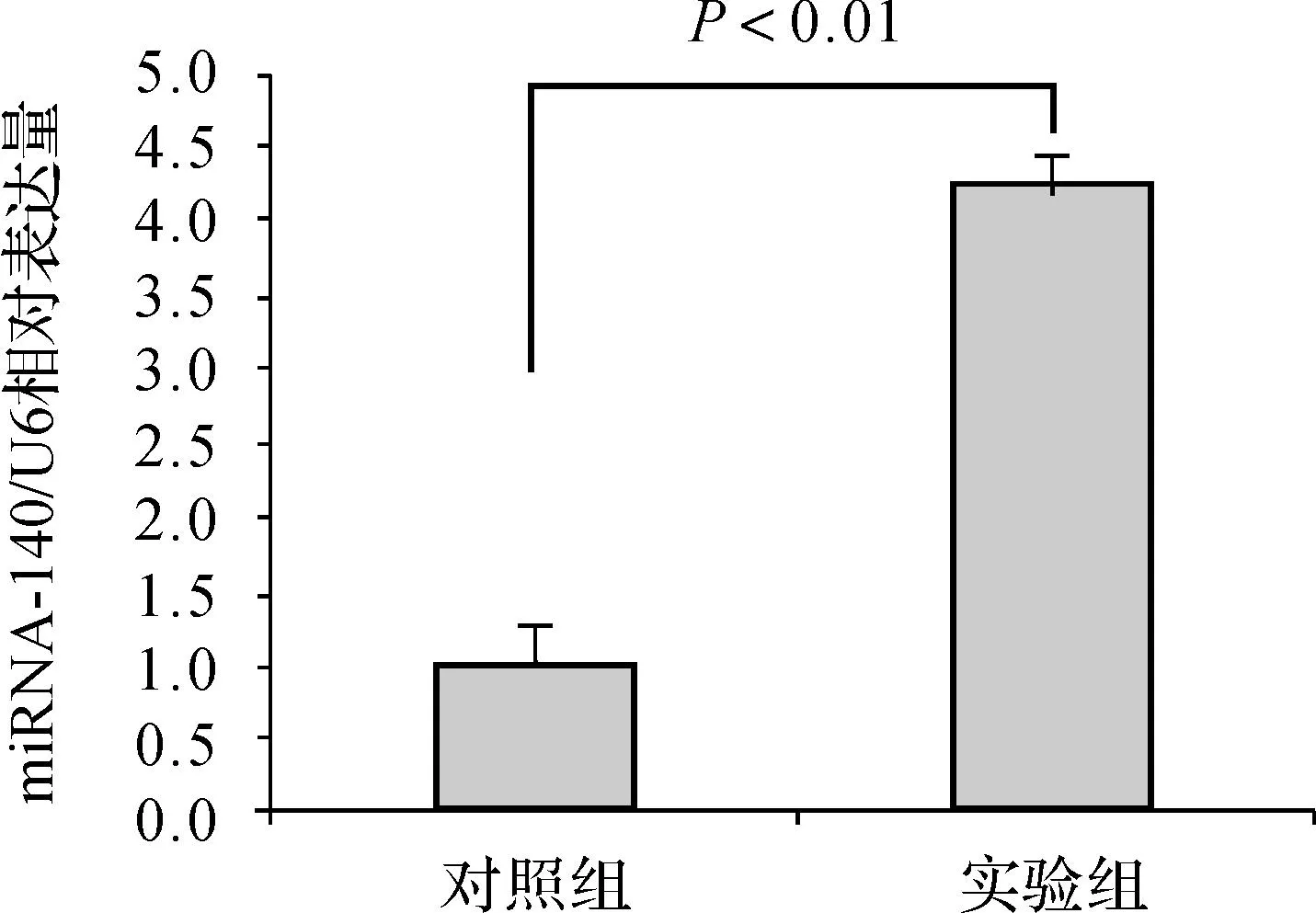
图3实时定量PCR检测重组腺病毒pAd- has- miRNA- 140感染骨肉瘤细胞表达情况
Fig 3The expression of the recombinant adenovirus pDC316- miRNA- 140 in osteosarcoma cells was detected by real- time PCR
在研究miRNA功能时, 最简洁的方法是利用化学方法合成的miRNA 进行转染,但化学合成的这类RNA稳定性差、容易发生降解,不能达到持续稳定的表达,特别是原代细胞存在转染效率低等问题。这些不足使得转染miRNA成为研究者需解决的一道难题。利用miRNA构建病毒类表达载体则能够克服上述缺点。腺病毒载体的miRNA不仅保留了每个miRNA天然的原始独自双臂结构,并且腺病毒载体上的强启动子CMV非常有利于miRNA的大量表达。腺病毒载体容量大,安全系数高,腺病毒不会整合到宿主细胞的染色体当中, 因而产生免疫原性极小, 而且腺病毒包装容易操作, 所制备病毒滴度很高,病毒可以感染多种细胞类型,特别针对一些原代难以转染的细胞可以达到理想的转染效果,成为近来的首选方法[11- 12]。因此,腺病毒包装的miRNA非常适合用于miRNA基因调控功能研究、miRNA基因治疗等方面。
本研究构建的重组穿梭质粒pDC316- mCMV- miRNA- 140中包含加强性GFP表达框,可于感染24h后不同时间段观察荧光表达。因此, 重组病毒载体在293AAV细胞中的包装效率很容易通过荧光显微镜观察, 也为重组病毒滴度测定提供便利; 特别是在带有目的基因的重组腺病毒感染靶细胞时,可以直接通过观察到目的基因转入组织细胞的荧光强度来确定目的基因的表达效果。
本研究利用Adeasy腺病毒包装系统成功完成重组腺病毒pAd- has- miRNA- 140包装与纯化,收获高滴度的重组腺病毒,随后感染目的细胞,其高表达miRNA- 140。这为下一步进行基础研究与临床应用奠定了基础。特别是miRNA- 140的靶基因是HDAC4(组蛋白去乙酰化酶4), 通过抑制HDAC在骨肉瘤中的作用可能还具有一定的治疗方面的应用价值[13]。因此, 本研究成功制备了miRNA- 140重组腺病毒, 为进行miRNA- 140与骨肉瘤耐药作用机制以及miRNA- 140参与骨肉瘤疾病发病机制的研究创造了前提条件。
[参考文献]
[1] WAHID F,SHEHZAD A,KHAN T,et al.MicroRNAs:synthesis,mechanism,function,and recent clinical trials[J].Biochim Biophys Acta,2010,1803(11):1231- 1243.
[2] FARAZI T A,HOELL J I,MOROZOV P,et al.microRNAs in Human Cancer[J].Adv Exp Med Biol,2013,774:1- 20.
[3] SONG B,WANG Y,XI Y,et al.Mechanism of chemoresistance mediated by miR- 140 in human osteosarcoma and colon cancer cells[J].Oncogene,2009,28(46):4065- 4074.
[4] NICOLAS F E,PAIS H,SCHWACH F,et al.Experimental identification of microRNA- 140 targets by silencing and overexpressing miR- 140[J].RNA,2008,14(12):2513- 2520.
[5] KOTA J,CHIVUKULA R R,O’DONNELL K A,et al.Therapeutic microRNA delivery suppresses tumorigenesis in a murine liver cancer model[J].Cell,2009,137(6):1005- 1017.
[6] 蒋森,赵亚萍,杜云翔.MiR- 1在肿瘤中的研究进展[J].东南大学学报:医学版,2012,31(5):648- 651.
[7] 蒋亮,刘春辉,许斌,等.miR- 146a通过抑制ROCK1基因的表达促进去势抵抗性前列腺癌细胞的凋亡[J].东南大学学报:医学版,2015,34(3):357- 360.
[8] OOM A L,HUMPHRIES B A,YANG C.MicroRNAs:novel players in cancer diagnosis and therapies[J].Biomed Res Int,2014,2014:959461.
[9] GUO X,XIA J,YAN J.Promoter methylated microRNAs:Potential therapeutic targets in gastric cancer (Review)[J].Mol Med Rep,2015,11(2):759- 765.
[10] GANDELLINI P,GIOVANNETTI E,NICASSIO F.MicroRNAs in cancer management:big challenges for small molecules[J].Biomed Res Int,2015,2015:982156.
[11] EINFELD D A,ROELVINK P W.Advances towards targetable adenovirus vectors for gene therapy[J].Curr Opin Mol Ther,2002,4(5):444- 451.
[12] LIU F,LI Q,ZHANG P et al.Role of adenovirus- mediated retinoblastoma 94 in the treatment of human non- small cell lung cancer[J].Mol Med Rep,2015,11(5):3349- 3353.
[13] TUDDENHAM L,WHEELER G,NTOUNIA- FOUSARA S,et al.The cartilage specific microRNA- 140 targets histone deacetylase 4 in mouse cells[J].FEBS Lett,2006,580(17):4214- 4217.
The construction and identification of an adenoviral vector expressing mature miRNA- 140
HE Peng1,DUAN Li2
[1.DepartmentofStomatology,SouthernMedicalUniversityShenzhenHengshengHospital,Shenzhen518000,China;2.ShenzhenKeyLaboratoryofTissueEngineering,ShenzhenSecondPeople’sHospital(TheFirstHospitalAffiliatedtoShenzhenUniversity),Shenzhen518035,China]
[Abstract]Objective:To construct an adenoviral vector expressing mature miRNA- 140. Methods: The target Hsa- miRNA- 140 gene amplified from human genome was digested and linked to the shuttle plasmid pDC316- mCMV- EGFP. The recombinant plasmid was confirmed and transfected into AAV- 293 cells for adenoviruses pAd- has- miRNA- 140 packaging. The obtained adenoviruses were used to infect target cells and the cellular expressions of has- miRNA- 140 were detected using fluorescence and quantitative PCR. Results: Has- miRNA- 140 containing the restriction sites was amplified and linked to the shuttle plasmid pDC316- mCMV- EGFP,which was successfully recombined with AdEasy.After packaging in AAV- 293 cells,the adenoviruses were obtained,which caused an increase of miRNA- 140 expression about 4.2±0.2 folds in osteosarcoma cells. Conclusion: The adenoviral vector expressing the mature miRNA- 140 is successfully constructed.
[Key words]miRNA- 140; AdEasy system; quantitative polymerase chain reaction; osteosarcoma cells
doi:10.3969/j.issn.1671- 6264.2016.01.002
[中图分类号]Q782
[文献标识码]A
[文章编号]1671- 6264(2016)01- 0006- 05
[作者简介]贺鹏(1973-),男,湖南衡山人,主治医师。E- mail:hp73514@sina.com
[基金项目]深圳市科技计划项目(201003462)
[收稿日期]2015- 07- 20[修回日期] 2015- 09- 18
[引文格式] 贺鹏,段莉.miRNA- 140过表达腺病毒载体的构建及鉴定[J].东南大学学报:医学版,2016,35(1):6- 10.
·论著·

