利奈唑胺与万古霉素治疗院内获得性肺炎疗效与安全性Meta分析
程 聪,苗新建,顾永丽
(江苏省连云港市第一人民医院药剂科,江苏 连云港 222000)
利奈唑胺与万古霉素治疗院内获得性肺炎疗效与安全性Meta分析
程 聪,苗新建,顾永丽
(江苏省连云港市第一人民医院药剂科,江苏 连云港 222000)
目的 系统评价利奈唑胺与万古霉素治疗院内获得性肺炎(HAP)的疗效与安全性。方法 计算机检索PubMed,Springer,Ovid,Embase,Cochrance Library,Clinicaltrails.gov和CNKI、万方数据库,检索从建库开始至2014年2月的所有相关临床随机对照研究。同时检索纳入文献的参考文献,并逐个进行质量评价和资料提取,统计学分析采用RevMan 5.0软件。结果 共纳入9个随机对照试验(RCT),共计4 023例患者。Meta分析结果显示,两组28 d全因死亡率[RR=0.94,95%CI=0.81,1.10]和临床有效率[RR=1.05,95%CI=0.92,1.19],无统计学差异(P>0.05)。两组微生物清除率[RR=1.11,95%CI=0.95,1.29]和MRSA清除率[RR=1.11,95%CI=0.95,1.29],无统计学差异(P>0.05)。安全性方面,利奈唑胺组发生胃肠道不良反应[RR=1.95,95%CI=1.45,2.62]和血小板减少症[RR=1.54,95%CI=1.21,1.96]的比例高于万古霉素组;但发生肾衰竭[RR=0.5,95%CI=0.33,0.77]的比例低于万古霉素组,差异有统计学意义(P<0.05)。两组患者因药物不良反应而停药[RR=0.98,95%CI=0.74,1.29]的比例相似,无统计学差异(P>0.05)。结论 利奈唑胺与万古霉素治疗HAP的疗效相似,但利奈唑胺比万古霉素易导致胃肠道不良反应和血小板减少症,而万古霉素导致肾衰竭的几率高于利奈唑胺,建议临床选择治疗方案时应权衡考虑。
万古霉素;利奈唑胺;院内获得性肺炎;Meta分析
院内获得性肺炎(HAP)是指患者入院时不存在,也不处于感染潜伏期,而在入院48 h后在医院内发生的肺炎[1]。近年来,由革兰阳性菌(G+)感染的HAP比率升高,且耐甲氧西林葡萄球菌(MRSA)及耐青霉素肺炎链球菌感染的比例升高[2]。万古霉素在治疗革兰阳性菌感染尤其是多重耐药菌中占主导地位。但由于万古霉素的广泛应用,出现了耐万古霉素金黄色葡萄球菌,且万古霉素有潜在的肾毒性和耳毒性,应用受限。利奈唑胺作为新型恶唑烷酮类抗菌药物,对MRSA、耐万古霉素肠球菌、耐青霉素肺炎链球菌均有抗菌活性。但两者在治疗HAP的疗效及安全性方面尚存在争议。笔者检索相关文献,对利奈唑胺与万古霉素治疗HAP的疗效与安全性进行系统评价,为临床选择合理的治疗方案提供参考。
1 资料与方法
1.1 文献选取标准
纳入标准:研究设计为随机对照试验(RCT);患者诊断为院内感染性肺炎(HAP);试验组(L组)方案为静脉滴注利奈唑胺;观察组(V组)方案为静脉滴注万古霉素;必须含有死亡率、临床有效率数据的研究。排除标准:非随机对照研究;非中英文的研究;重复发表的研究。
1.2 临床指标
主要终点:28 d全因死亡率;临床有效率。次要终点:微生物清除率;MRSA清除率。安全性指标:胃肠道不良反应;血小板减少症;肾衰竭;因药品不良反应而停药。
1.3 检索策略
计 算 机 检 索 PubMed,Springer,Ovid,Embase,Cochrance Library,Clinicaltrails.gov和 CNKI、万方数据库,检索从建库开始至2014年2月的所有相关临床随机对照研究。中文检索词:“利奈唑胺”“恶唑烷酮”“万古霉素”“糖肽类”“肺炎”“院内感染性肺炎”“呼吸机相关性肺炎”“葡萄球菌”“随机对照试验”。英文检索词:“linezolid”“oxazolidinone”“vancomycin”“glycopeptide”“Staphylococcus”“hospital-acquired”“ventilator-associated”“nosocomial pneumonia”“randomized”。手工和计算机检索查找检索到文献的参考文献。根据摘要在外文医学期刊全文数据库、Ovid和Springer上检索全文,或与作者直接联系索要全文。
1.4 资料提取和文献质量评价
资料提取:由2位研究者独立进行文献质量评价并严格按照设计好的表格提取资料,如遇分歧,通过讨论或根据第3位研究人员的意见解决。
文献质量评价:根据改良的Jadad评分[3](7分制)标准,由2位研究者独立地对纳入研究进行方法学质量评价,并由第3位研究者协助解决分歧。评价内容包括随机化方法是否正确、分配隐藏是否正确、是否实施盲法、是否报告失访和退出。1~3分为低质量文献,4~7分为高质量文献。
1.5 统计学处理
数据采用RevMan 5.0软件进行定量综合。首先用卡方检验(检验标准为0.05)对纳入研究进行异质性检验,若各研究间不存在异质性(P>0.05),以固定效应模型进行Meta分析;若存在异质性(P<0.05),则寻找产生异质性的原因,并采取亚组分析和敏感性分析,尽可能消除异质性,若仍未找到产生异质性的原因,则采用随机效应模型进行Meta分析。连续变量采用加权平均数(MD)作为分析统计量;计数资料采用相对危险度(RR)作为分析统计量。所有分析均计算95%CI。当纳入研究足够多时,则进行漏斗图分析判断是否存在发表偏倚。若临床提供的数据不能进行Meta分析时,则只对其进行描述性分析。
2 结果
2.1 文献检索结果
最初检出相关文献148篇,剔重后为114篇,通过阅读文题和摘要后初步筛得30篇,再仔细阅读全文后最终纳入9个RCT,均为英文文献,共计4 023例患者,其中L组2 125例,V组1 898例。流程见图1,各研究的基本特征见表1。
2.2 文献质量评价
纳入的9个研究中,5个是随机双盲多中心临床试验,4个是随机开放多中心临床试验。6个具体描述了随机组序列产生的方法;有5个提及双盲。所有研究均比较了两组的基线水平,并给出了详细资料,但有2个研究的基线不一致。8个研究描述了退出或失访情况。4个RCT的Jadad评分≥4分,其余为3分。纳入研究的整体质量较高,见表2。
化工工业园区的发展离不开严格的安全环保管理制度。据工业区发展有限公司董事长孙莉军介绍,几年前,工业区曾为化工企业产生的废气废水扰民、污染环境而深感头痛。通过3年环境综合整治,工业区关停了44家小化工企业,使经济发展和环境质量改善呈现两升三降的良好态势,即工业产值年均增长21%,税收年均增长17%;环境信访量年均下降36%,万元产值能耗年均下降13%,区域VOCs排放量比2016年下降17.6%。经过艰辛努力,通过执行一整套行之有效的管理制度,一定程度上解决了长期困扰工业区发展的环境问题。“对于化工园区来说,安全环保永远在路上。”孙莉军如是说。
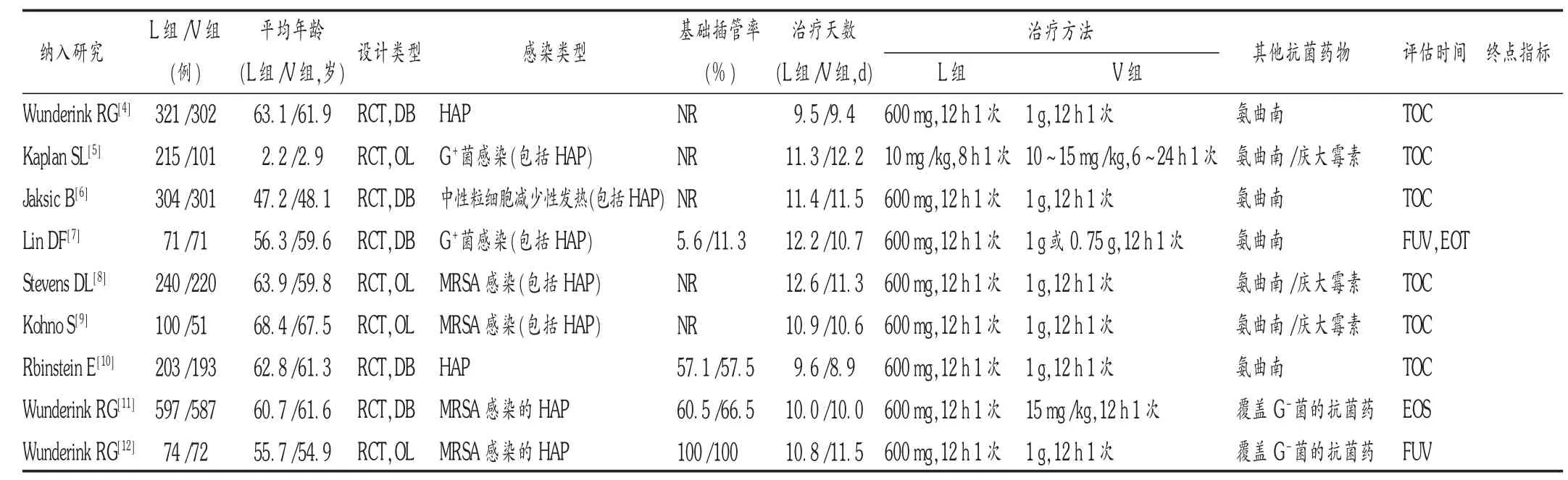
表1 纳入文献的基本特征
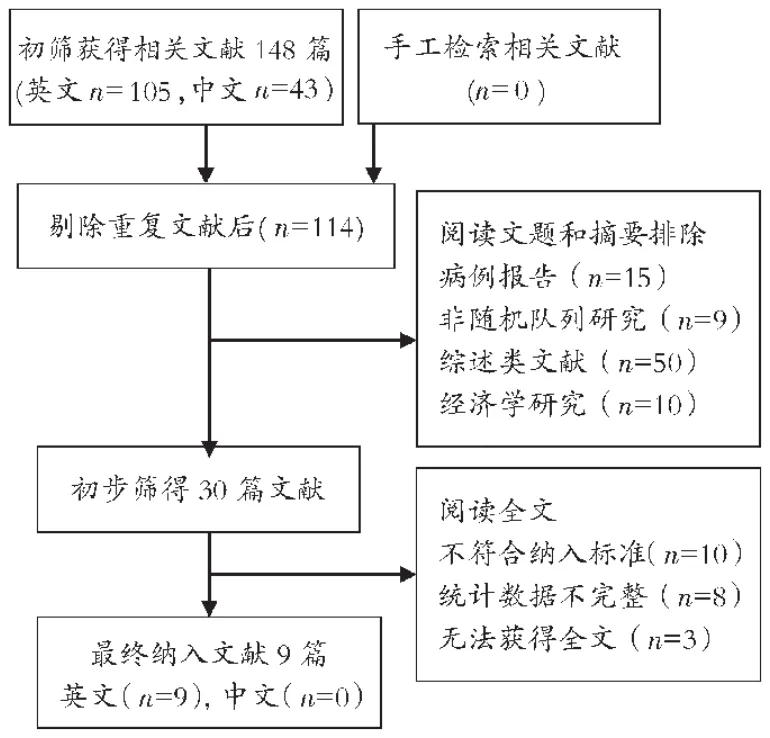
图1 文献检索与筛选流程

表2 纳入文献质量评价
2.3 分析
2.3.1 主要终点
28 d全因死亡率:共纳入9个研究,各研究间不存在异质性(P=0.44),故采用固定效应模型,见图2。Meta分析结果显示,基于意向分析(ITT),L组与V组患者 28 d全因死亡率之间无统计学差异[RR=0.94,95%CI=0.81,1.10]。采用漏斗图进行发表偏倚分析,图形较为对称,表明存在发表偏倚的可能性较小,见图3。

图2 两组患者28 d全因死亡率的Meta分析

图3 利奈唑胺与万古霉素对28 d全因死亡率的发表偏倚分析
临床有效率:共纳入9个研究,各研究间不存在异质性。意向分析中(ITT),Meta分析结果显示两组临床有效率间无统计学差异[RR=1.05,95%CI=0.92,1.19],见图4。符合方案集分析(PP),Meta分析结果显示,两组临床有效率之间无统计学差异[RR=1.08,95%CI=0.99,1.18],见图5。
2.3.2 次要终点
微生物清除率:共纳入7个研究,各研究间不存在异质性(P=0.70),故采用固定效应模型,见图6。Meta分析结果显示,基于符合方案集分析(PP),L组与V组微生物清除率之间无统计学差异[RR=1.11,95%CI=0.95,1.29]。
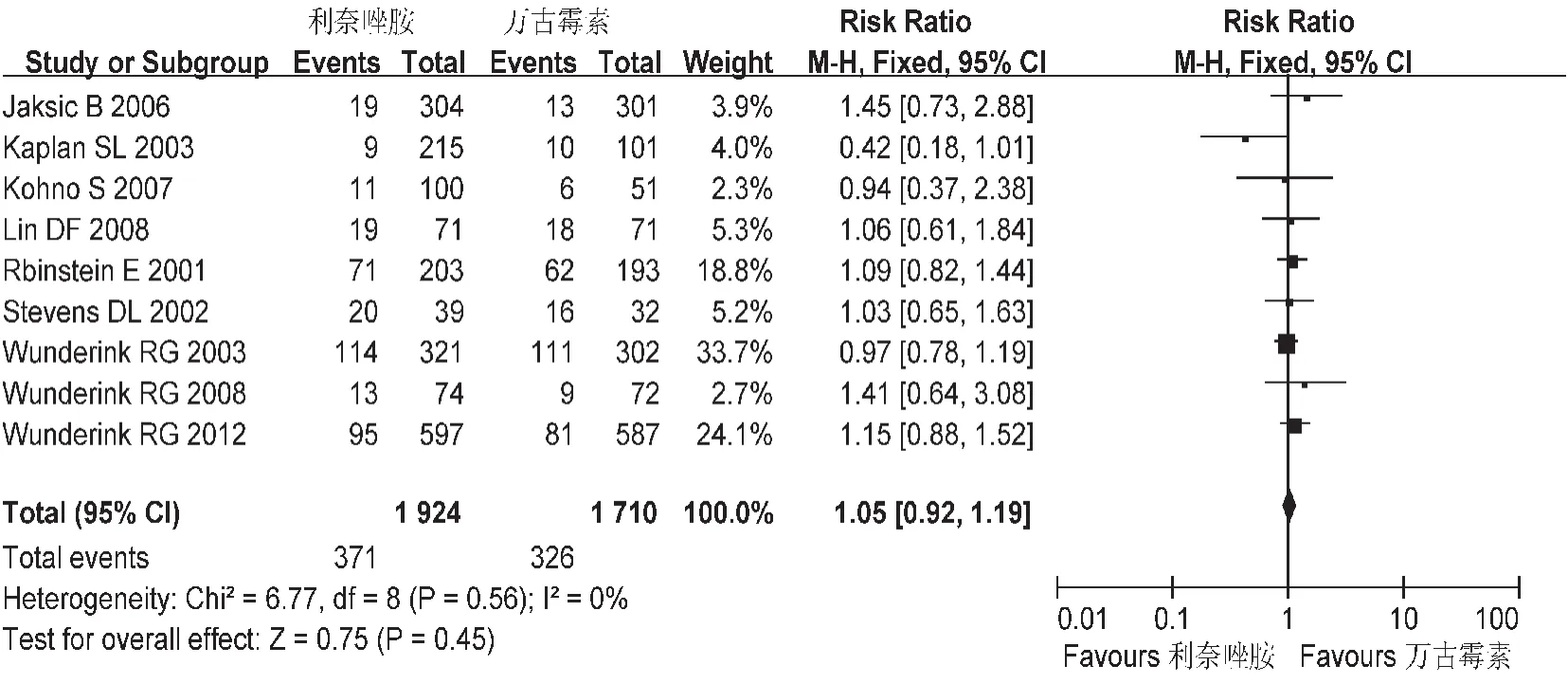
图4 两组临床有效率的Meta分析(ITT)
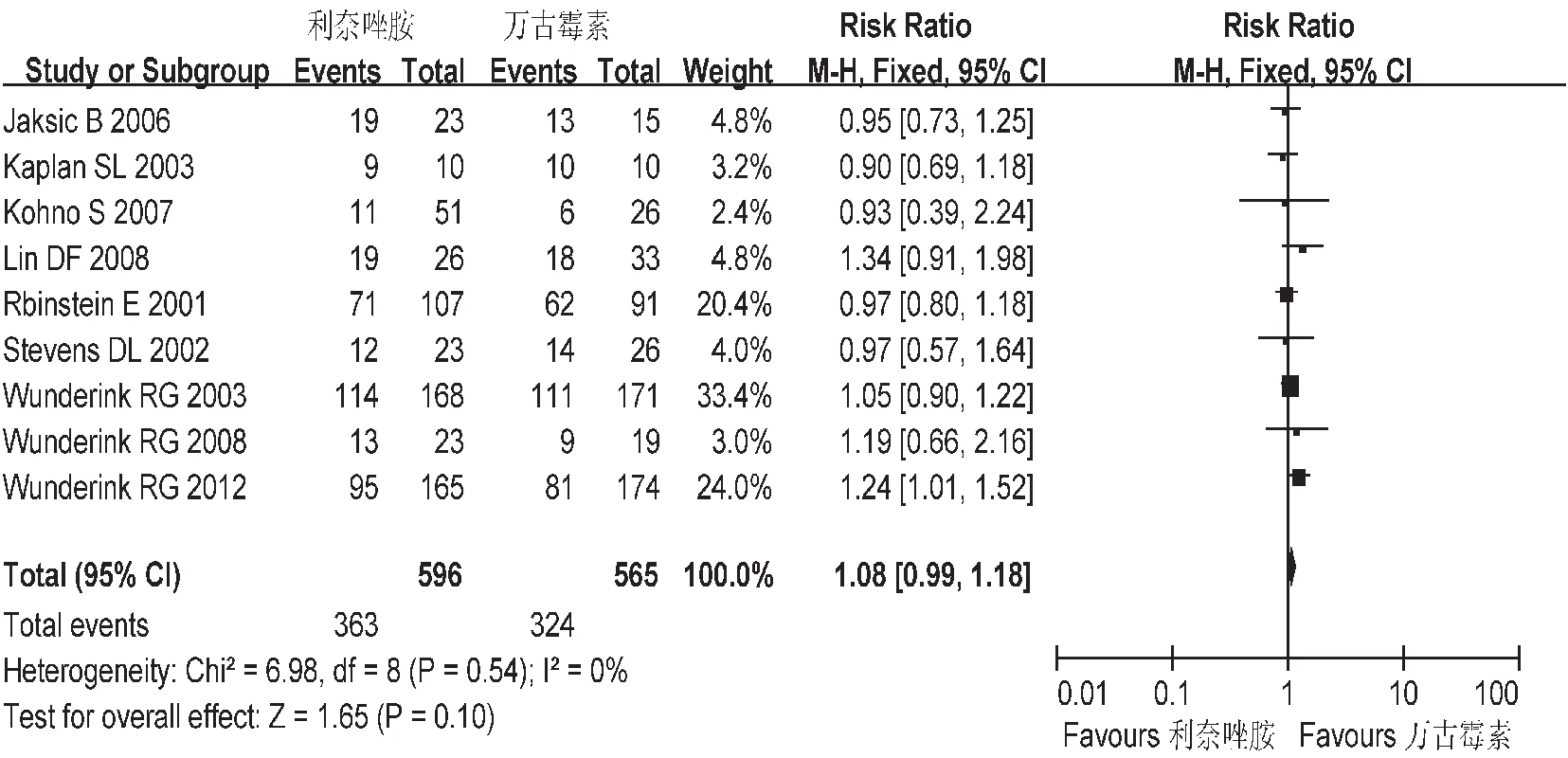
图5 两组临床有效率的Meta分析(PP)
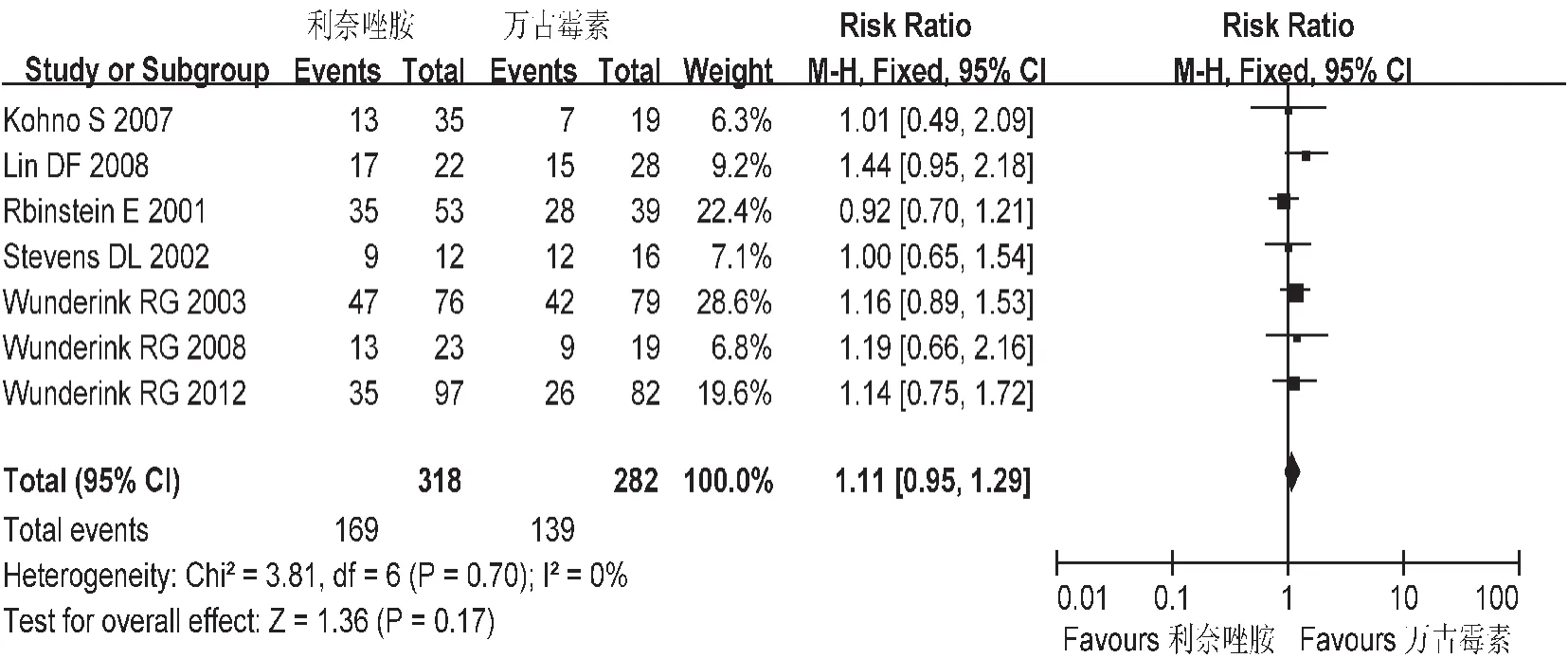
图6 两组微生物清除率的Meta分析(PP)
2.3.3 安全性指标
胃肠道不良反应:共纳入8个研究,各研究间不存在异质性(P=0.20),故采用固定效应模型,见图8。 Meta分析结果显示,基于意向分析(ITT),L组胃肠道不良反应发生率高于 V组,差异有统计学意义[RR=1.95,95%CI=1.45,2.62]。
血小板减少症发生率:共纳入8个研究,各研究间不存在异质性(P=0.09),故采用固定效应模型,见图9。Meta分析结果显示,基于意向分析(ITT),L组血小板减少症发生率高于V组,差异有统计学意义[RR=1.54,95%CI=1.21,1.96]。

图7 两组MRSA清除率的Meta分析(PP)
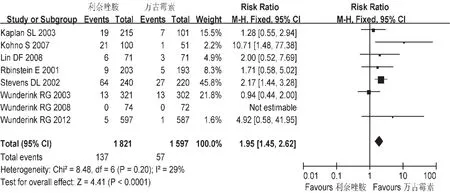
图8 两组胃肠道不良反应的Meta分析

图9 两组血小板减少症发生率的Meta分析
肾衰竭发生率:共纳入8个研究,各研究间不存在异质性(P=0.44),故采用固定效应模型,见图10。Meta分析结果显示,基于意向分析(ITT),L组肾衰竭发生率低于 V组,差异有统计学意义[RR=0.5,95%CI=0.33,0.77]。
因不良反应停药的发生率:共纳入8个研究,各研究间不存在异质性(P=0.62),故采用固定效应模型,见图11。Meta分析结果显示,基于意向分析(ITT),两组因不良反应停药的发生率间无统计学意义[RR=0.98,95%CI=0.74,1.29]。
2.4 敏感性分析
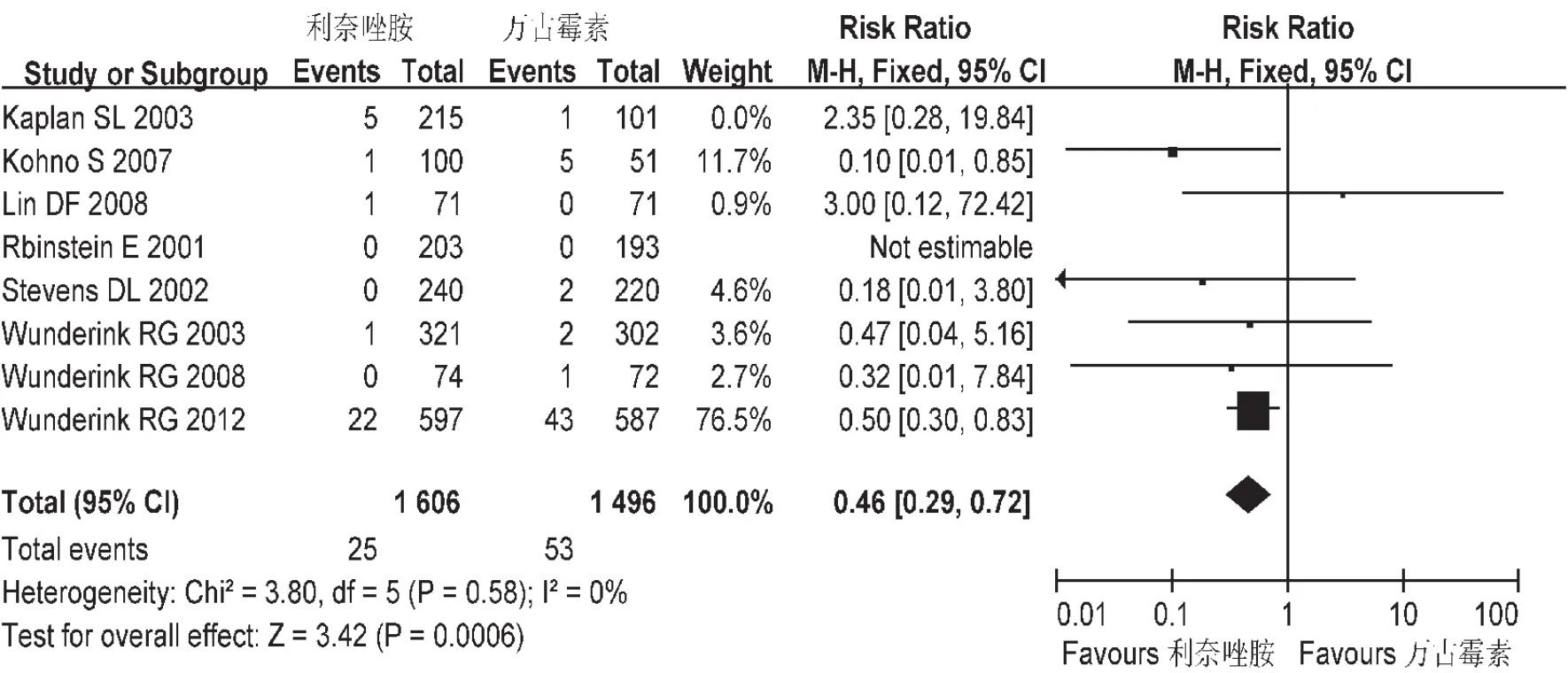
图10 两组肾衰发生率的Meta分析

图11 两组因不良反应停药的发生率的Meta分析
Kaplan SL的研究是唯一针对的儿科患者的研究,将其从各分析中剔除后,重新进行Meta分析。结果显示28 d全因死亡率[RR=0.93,95%CI=0.8,1.08]、临床有效率(ITT)[RR=1.08,95%CI=0.95,1.22]、临床有效率(PP)[RR=1.09,95%CI=0.99,1.19]、胃肠道不良反应发生率[RR=2.07,95%CI=1.57,2.85]、血小板减少症[RR=1.52,95%CI=1.19,1.94]、肾衰竭发生率[RR=0.46,95%CI=0.29,0.72]、因不良反应停药的发生率[RR=0.97,95%CI=0.72,1.30]的结论均不变。故各研究结果的稳定性较好。
3 讨论
HAP是重症监护室(ICU)常见的感染,且死亡率为15% ~57%。万古霉素为三环糖肽类抗生素,通过抑制细菌细胞壁的合成发挥其抗菌作用,是治疗革兰阳性菌特别是MRSA的首选药物。利奈唑胺是第1个获得美国食品药物管理局(FDA)批准用来治疗革兰阳性球菌,尤其是MRSA的唯一的 唑烷酮类抗菌药物[13]。其通过抑制蛋白质合成的最早阶段,与核糖体50s亚基的23s核糖体RNA上的位点结合,通过抑制50s核糖体亚基,阻止70s起始复合物形成发挥抗菌效应[14]。此外,利奈唑胺不易与其他类别的药物发生交叉耐药,还可抑制致病因子的表达,故近年来在临床MRSA感染中广泛应用。
本研究结果显示,万古霉素与利奈唑胺在治疗HAP时,在临床有效率、28 d全因死亡率、微生物清除率和MRSA清除率方面无统计学差异(P>0.05)。安全性方面,L组胃肠道不良反应发生率、血小板发生率均高于 V组,差异有统计学意义(P>0.05);而V组肾衰竭的发生率高于L组,差异有统计学意义(P<0.05);两组因不良反应停药的发生率之间无统计学差异(P>0.05)。
利奈唑胺对患者肝肾功能影响较小,主要不良反应为血小板减少症[15],这与患者本身的基线血小板计数(<200×106/mL)和治疗时间(>14 d)有关,故选择使用利奈唑胺时应监测患者的基线血小板计数,防止血小板减少症的发生。还有研究显示,若利奈唑胺谷浓度维持在2~6.3 mg/L,则既可获得较好的疗效又可降低血小板减少症的发生风险[16],故监测利奈唑胺的血药浓度可能有益。本研究结果显示,胃肠道不良反应发生率明显高于万古霉素,两组因不良反应停药的情况主要为腹泻、皮疹、红颈综合征、呕吐等,但两组发生率无统计学差异(P>0.05)。另外,万古霉素发生肾衰竭的比例高于利奈唑胺。万古霉素导致肾脏损害的可能机制为,对近端肾小管功能损害,尿酶增加;重者出现急性肾衰竭,光镜下可见肾小管上皮细胞广泛坏死,以近端小管最为严重,重者可累及肾单位[17]。有研究显示,当患者合并高血压,接受呋塞米治疗且万古霉素谷浓度≥16.2 μg/mL时,发生肾脏损害的风险最大(OR=4.99)[18];若对患者进行了APACHE评分,则当APACHE总分≥40分时,其发生肾毒性的几率亦明显增加[19]。故应用万古霉素时应监测患者的肾功能,防止发生严重的肾毒性。
综上所述,利奈唑胺与万古霉素治疗HAP均有较好的疗效,但利奈唑胺更易发生胃肠道不良反应及血小板减少症,而万古霉素具有肾毒性,发生肾衰竭的几率高于利奈唑胺。故医生应结合患者的具体情况,如血小板的基线水平、肾功能状态等,选择最佳的治疗方案,尽可能减少不良反应的发生。此外,本试验还存在以下局限:各研究对临床有效率定义不一致;部分研究是开放性的,可能对临床结果产生影响;各随机对照研究均设置了入选标准,故研究结果不一定适用于该标准以外的人群。以上因素均影响了该Meta分析的结果,但本试验的纳入样本量大,检验效力强,结果较可靠。
[1]中华医学会呼吸病学分会.医院获得性肺炎诊断和治疗指南(草案)[J].中华结核和呼吸杂志,1999,22(4):201-202.
[2]康春燕,刘长庭,邹 琳.万古霉素与利奈唑胺治疗老年人院内获得性肺炎评价[J].军医进修学院学报,2010,31(11): 1 060-1 062.
[3]Jadad AR,Moore RA,Carroll D.Assessing the Quality of Reports of Randomized Clinical Trials:Is Blinding Necessary?[J].Control Clin Trials,1996,17(1):1-12.
[4]Wunderink RG,Cammarata SK,Oliphant TH,et al.Continuation of a Randomized,Double-Blind,Multicenter Study of Linezolid Versus Vancomycin in the Treatment of Patients with Nosocomial Pneumonia[J].Clin Ther,2003,25(3):980-982.
[5]Kaplan SL,Deville JG,Yogev R,et al.Linezolid versus vancomycin for treatment of resistant Gram-positive infections in children[J].Pediatr Infect Dis J,2003,22(8):677-685.
[6]Jaksic B,Martinelli G,Perez-oteyza J,et al.Efficacy and safety of linezolid compared with vancomycin in a randomized,doubleblind study of febrile neutropenic patients with cancer[J].Clinical infectious diseases:an official publication of the Infectious Diseases Society of America,2006,42(1):597-607.
[7]Lin DF,Zhang YY,Wu JF,et al.Linezolid for the treatment of infections caused by Gram-positive pathogens in China[J].International journal of antimicrobial agents,2008,32(3):241-249.
[8]Stevens DL,Herr D,Lampiris H,et al.Linezolid versus vancomycin for the treatment of methicillin-resistant staphylococcus aureus infections[J].Clinical infectious diseases:an official publication of the Infectious Diseases Society of America,2002,34(1):1 481-1 490.
[9]Kohno S,Yamaguchi K,Aikawa N,et al.Linezolid versus vancomycin for the treatment of infections caused by methicillinresistant Staphylococcus aureus in Japan[J].The Journal of antimicrobial chemotherapy,2007,60(6):1 361-1 369.
[10]Rubinstein E,Cammarata S,Oliphant T,et al.Linezolid(PNU-100766)versus vancomycin in the treatment of hospitalized patients with nosocomial pneumonia:a randomized,double-blind,multicenter study[J].Clinical infectious diseases:an official publication of the Infectious Diseases Society of America,2001,32(3):402-412.
[11]Wunderink RG,Niederman MS,Kollef MH,et al.Linezolid in methicillin-resistant Staphylococcus aureus nosocomial pneumonia:a randomized,controlled study[J].Clinical infectious diseases:an official publication of the Infectious Diseases Society of America,2012,54(5):621-629.
[12]Wunderink RG,Mendelson MH,Somero MS,et al.Early microbiological response to linezolid vs vancomycin in ventilator-associated pneumonia due to methicillin-resistant Staphylococcus aureus[J].Chest,2008,134(6):1 200-1 207.
[13]Herrmann DJ,Peppard WJ,Ledeboer NA,et al.Linezolid for the treatment of drug-resistant infections[J].Expert review of anti-infective therapy,2008,6(6):825-848.
[14]廖雪梅.利奈唑胺与万古霉素治疗老年耐甲氧西林的金黄色葡萄球菌肺炎的临床疗效分析[J].中华临床医师杂志:电子版,2012,6(2):458-460.
[15]Zhou ZY,Zhao XQ,Shan BZ,et al.Efficacy and safety of linezolid in treating gram-positive bacterial infection in the elderly:a retrospective study[J].Indian J Microbiol,2014,54(1):104-107.
[16]Dong HY,Xie J,Chen LH,et al.Therapeutic drug monitoring and receiver operating characteristic curve prediction may reduce the development of linezolid-associated thrombocytopenia in critically ill patients[J].Eur J Clin Microbiol Infect Dis,2014,33(6): 1 029-1 035.
[17]王金泉.抗生素肾损害的早期诊断和防治[J].肾脏病与透析肾移植杂志,2006,15(3):242-243.
[18]Cappelletty D,Jablonski A,Jung R.Risk factors for acute kidney injury in adult patients receiving vancomycin[J].Clin Drug Investig,2014,34(3):189-193.
[19]鱼爱和,聂昭华,孙 光.万古霉素相关的致肾衰危险因素与预防[J].中国药师,2008,11(10):1 253-1 254.
R969.4;R978.1+9
A
1006-4931(2016)01-0032-07
2014-05-31)

