CNJ甲烷化催化剂反应本征动力学模型
马 磊,张新波,高 振
(1.西南化工研究设计院有限公司,四川 成都 610225;2.中海石油气电集团有限责任公司技术研发中心,北京 100028)
CNJ甲烷化催化剂反应本征动力学模型
马 磊1,张新波1,高 振2
(1.西南化工研究设计院有限公司,四川 成都 610225;2.中海石油气电集团有限责任公司技术研发中心,北京 100028)
选取280~580℃,1.0~2.5MPa和汽气比0.1~0.7的反应条件,研究了CNJ型合成气甲烷化催化剂的本征动力学。实验所用原料气体积组成为:H256%~58%,CO 6%~7%,CO2≈3%,CH424%~25%,C2H61.5%~2%,其余为N2。利用Matlab对实验数据采用幂函数模型回归得到本征动力学方程。将数据拟合得到的本征动力学方程利用ASPEN PLUS软件进行模拟,并与工业装置结果进行对比验证。结果表明,出口关键组分模拟值与实验值接近,证明模型的合理性。
甲烷化;本征动力学;催化剂
目前,国内天然气供应的缺口逐年增大,对外依存度近两年呈快速上升之势。据发改委能源研究所预测,到2020年我国天然气的消费量将达到2500亿m3,国内天然气缺口达1000亿m3以上[1]。在我国富煤贫油少气的资源环境下,利用低阶褐煤分层利用生产天然气具有重要意义。而且在煤炭深加工的几个发展方向中,煤制天然气的能量转化效率高,单位能量水耗低、投资省,工程化建设成熟度高,是有效的煤炭利用方式和煤制能源产品较好途径[2]。
甲烷化是煤制天然气及焦炉煤气制天然气项目中的核心工段,而甲烷化催化剂又是其中的关键。本文的目的在于研究甲烷化催化剂的动力学特征[3],为针对催化剂特征设计最佳反应器提供基础条件。
1 实验部分
1.1 实验装置
实验装置流程[4]如图1所示,试验用原料气采用配制的钢瓶气,经过减压计量后分别进入预热器及蒸发器,进料水经平流泵加压进入蒸发器蒸发,同时与原料气充分混合后进入反应器发生反应,反应器采用外加热形式控制出口温度,出口气体经冷却、分离、计量后一部分去色谱进行组分分析,另一部分直接排空。实验采用PID控温,以保证反应器热点温度的一致性。
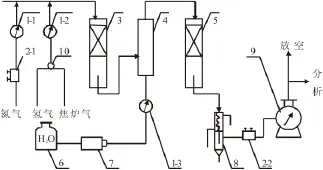
图1 甲烷化实验装置示意图Fig.1 Schematic diagram of methanation experimental installation
1.2 实验方法
(1)催化剂还原
以催化剂床层出口处热电偶为控制热电偶,关闭放空阀,用氢气缓慢升压至 0.5MPa,时间为10min,系统定压,缓慢打开放空阀,以4℃/min的速度升温至400℃(见结果讨论),氢气空速2000h-1,温度升至400℃时开始计时,还原时间为2h。
(2)甲烷化反应
打开氮气钢瓶顶阀及控制面板开关通入氮气,关闭稳压阀2-2,系统压力升至试验压力时定压,打开稳压阀2-2;打开总电源,进行程序升温设置,以4℃/min的速率升至目标温度:第一段,室温~280℃,时间60min;第二段,280℃保温,时间10min,同时投入原料气;第三段,280℃至目标温度。
1.3 分析方法
采用安捷伦7820A气相色谱仪及微量CO2红外分析仪(0~50×10-6)为分析设备,并对分析设备进行了标定。
常量组分分析采用气相色谱仪进行,工作条件见表1。
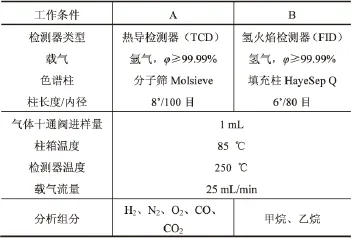
表1 色谱工作条件Table 1 Working conditions of chromatography
微量CO2分析采用微量CO2红外分析仪,操作条件为气体流速为0.5mL/min。
2 结果与讨论
2.1 实验数据
选用CNJ型工业化甲烷化催化剂进行甲烷化实验,条件实验采用的原料气为典型的合成气组成,见表2。
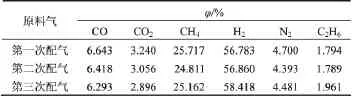
表2 合成气条件实验原料气组成Table 2 Composition of feed gas
在催化剂性能稳定的基础上,进行了动力学测试。测试选用的反应温度280~580℃,压力1.0~2.5MPa,汽气比(物质的量比)0.1~0.7。反应器催化剂装填量为10.98g。实验结果如表3所示。实验期间,根据催化剂特点,选择入口温度为280℃进行测试。
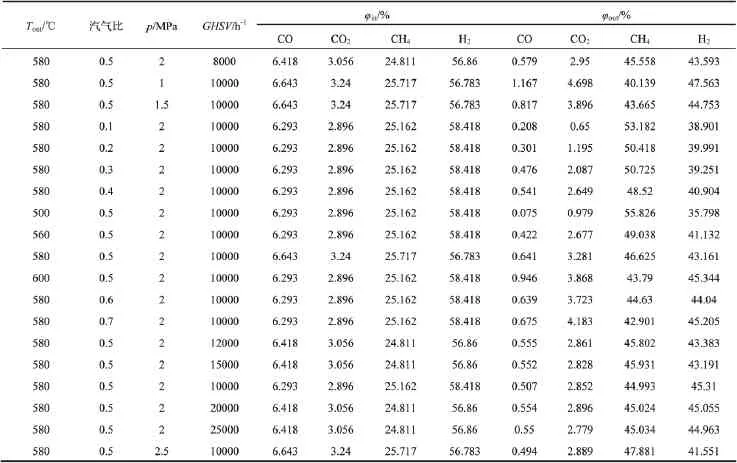
表3 实验结果表Table 3 Experimental data
2.2 数据回归
甲烷化反应是指合成气中CO、CO2和H2在一定温度、压力和催化剂作用下生成CH4的反应[5]。主反应如下:
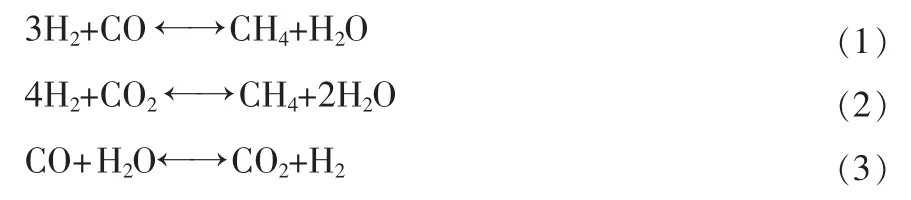
主反应式(1)和(3)可以代替主反应式(2),在数据回归的过程中考虑(1)和(3)即可。通过出口入口分析数据,可以得知CNJ型催化剂同时具有促进变换反应的功能,利用幂函数模型进行回归。
由于甲烷化反应为偏离平衡的反应,可以得到动力学方程式如下[2]:
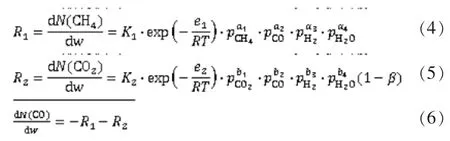
利用MATLAB软件[6]采用4阶Runge-Kutta法解微分方程组(4)和(6)[7-8],对进出口条件进行拟合,阻尼最小二乘法进行参数估计,得到:
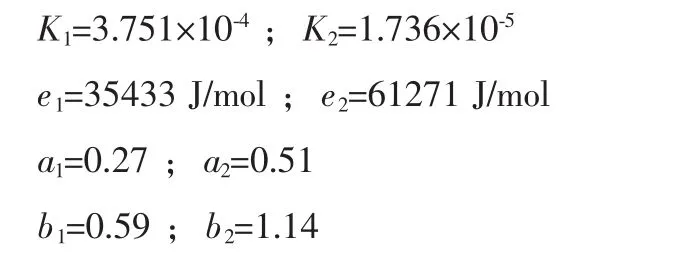
将 a3、a4、b3、b4圆整为零后得到的甲烷化反应动力学模型如下:
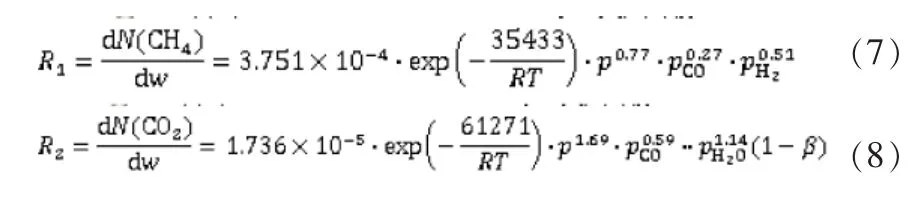
2.3 模拟验证
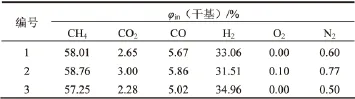
表4 甲烷化入口气组成Table 4 Inlet gas composition of methanation reactor
为验证甲烷化反应动力学方程的可靠性,将使用动力学方程(7)和(8)的模拟软件结果与采用CNJ催化剂的工业装置结果进行比较[1]。模拟过程采用工业装置运行实际数据,并尽可能排除其他因素对结果的影响。为避免偶然性,采取同一装置不同时间的3组数据(表4)进行模拟[6]。
气体流量Qn≈57000m3/h,压力2.83MPa(G),入口温度280℃,汽气比0.30。参照以上条件利用ASPEN PLUS模拟软件搭建反应器模型(图2)。模拟过程采用了RKS-BM热力学方程[5]。该方程是为了提高SPK方程所进行的修正,其方程式为:
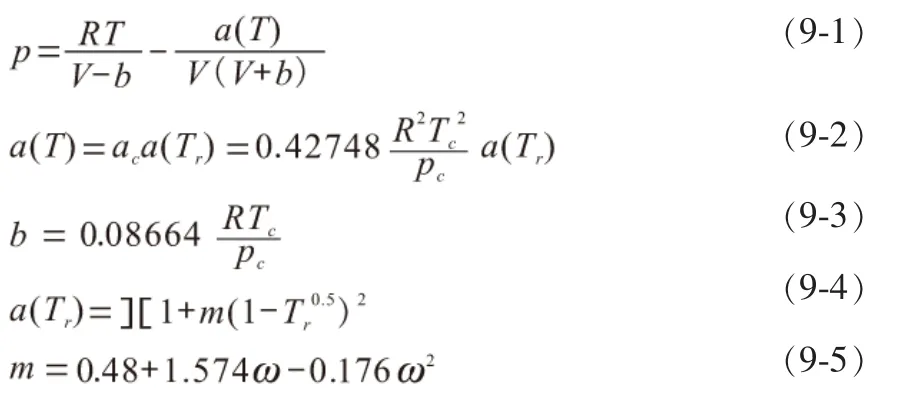
式中,ω为偏心因子。
此方程是一个广泛被工程界接受和使用的立方形方程,它能准确的计算极性物质及含氢物质的p-V-T数据。
图2 反应模型示意图Fig.2 Schematic diagram of reactor
与工业装置一致,选择绝热反应器为模拟研究对象进行模拟实验。模拟结果与实际结果见表5。
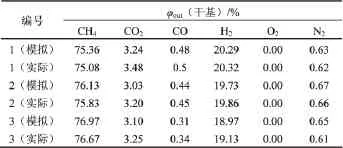
表5 模拟结果与实验数据对比Table 5 Comparison of simulated results and experimental data
由表5可以看出,模拟结果与工业装置实际值差别极小,甲烷化反应远离平衡。
通过分析动力学方程的特性,可以得知甲烷化反应中气体组分的分压对于反应存在较大的影响,反应过程中通过增加原料气中H2O、CH4等含量会抑制甲烷化反应的进行。由于甲烷化反应为强放热反应,通过动力学方程的研究可以得知,可通过改变进入反应器的H2O、CH4等含量来控制反应器热点温度不超过设备的耐受极限;将动力学方程运用在工艺设计的过程中,通过计算不同空速条件下的反应情况,可以得到甲烷化反应过程中的最佳空速条件;根据动力学方程,可以得到压力与反应程度存在正相关,但过高的压力条件会造成较大的能耗。甲烷化反应的动力学方程为甲烷化工艺的设计、设备的选型、控制方案的确定提供了参考。
3 结论
(1)在280~580℃,1.0~2.5MPa及汽气比0.1~0.7的反应条件下,研究得出了CNJ型合成气甲烷化催化剂的本征动力学方程;
(2)甲烷化催化剂本征动力学方程与实验结果和工业数据结果吻合度高;
(3)动力学方程的研究能够为工业装置的工艺开发、设备设计、控制方案提供可靠的分析。
[1]侯建国,高振,王秀林,等.中国甲烷化工艺技术专利现状及分析 [J].天然气化工·C1化学与化工,2015,40(2): 66-70.
[2]Bell D A,Towler B F,Fan M H.Coal Gasification and its applications[M].2011.
[3]于建国,于遵宏,沈才大.半水煤气耐硫甲烷化催化剂的研制及其本征动力学的测试 [J].化工学报,1991,(1):96-103.
[4]华新雷,王立刚,徐勇华.利用高通量技术研究钴基费托催化剂的宏观动力学[J].催化学报,2009,30(8):740-747.
[5]福格勒.化学反应工程原理[M].第四版.北京:化学工业出版社,2006.
[6]Hahn B H,Valentine D T.Essential MATLAB for Engineers and Scientists[M].5th Ed.Academic Press, 2013.
[7]王健红,冯树波,杜增智.化工系统工程理论与实践[M].北京:化学工业出版社,2009.
[8]包宗宏,武文良.化工计算与软件应用[M].北京:化学工业出版社,2011.
Intrinsic kinetics model of CNJ methanation catalyst
MA Lei1,ZHANG Xin-bo1,GAO Zhen2
(1.The Southwest Research and Design Institute of the Chemical Industry Co.,Ltd.,Chengdu 610225,China;2.Research and Development Center of CNOOC Gas and Power Group,Beijing 100028,China)
The intrinsic kinetics of methanation reaction over the CNJ catalyst was studied at the reaction conditions of 280-580℃,1.0-2.5MPa and the steam/syngas molar ratio of 0.1-0.7.A raw gas consisting of 56%-58%H2,6%-7%CO,3%CO2,24%-25%CH4,1.5%~2%C2H6,and N2for balance by mole was used for the experiments.Matlab was used to fit the experimental data by the power function model to get the intrinsic dynamic equation.The intrinsic kinetic equation obtained by fitting the data was simulated by ASPEN PLUS,and the results were compared with the data of the industrial plant.The results show that the simulated values of the key components at outlet are close to the experimental values,which proves the rationality of the model.
methanation;intrinsic kinetics;catalyst
TQ013.2;TQ221.11;TQ426.94
:A
:1001-9219(2016)06-87-04
2016-06-18;
:马磊(1986-),男,工程师,从事煤制天然气甲烷化、低阶煤分级利用等方面的研究,电话:028-85962275,E-mail:victor.mau@outlook.com。

