麦冬皂苷B体外调控非小细胞肺癌A549细胞miRNA-34b表达的研究*
邱雯莉,姜泽群,陈海彬,周红光
(南京中医药大学基础医学院 江苏省中医药防治肿瘤协同创新中心 南京 210023)
麦冬皂苷B体外调控非小细胞肺癌A549细胞miRNA-34b表达的研究*
邱雯莉,姜泽群,陈海彬,周红光**
(南京中医药大学基础医学院 江苏省中医药防治肿瘤协同创新中心 南京 210023)
目的:本研究主要观察不同方式处理后的非小细胞肺癌(NSCLC)A549细胞中miRNA-34b表达水平,探讨miRNA-34b对MET信号 通路的调控机制,以及麦冬皂苷B(OPB)抑癌效应的分子机理,探寻治疗NSCLC的新靶点。方法:采用非小细胞肺癌A549 细胞、胚肺成纤维细胞MRC-5、A549+OPB细胞、感染过表达慢病毒LV-hsa-mir-34b的A549细胞、以及感染阴性对照CON181B病毒的A549细胞作为研究对象,分别设为CON组、MRC-5组、CON+OPB组、Micro-up组、NC组。采用qRT-PCR方法检测miR-34b在CON组、MRC-5组、A549+OPB组A549细胞中的表达情况。使用生物信息学软件预测miRNA-34b可能的下游功能靶基因。使用qRT-PCR 的方法定量分析OPB对MET基因表达的影响,用Western blot检测miRNA-34b和OPB对靶MET蛋白表达的影响。结果:与MRC-5组相比,A549细胞中miRNA-34b的表达明显减少,加入OPB后miR-34b的表达增加。生物信息学预测显示MET基因是miR-34b可能的关键下游靶基因。加入OPB后,MET基因水平和蛋白水平的表达均降低。结论:OPB可能通过上调A549细胞miRNA-34b表达,抑制下游靶基因MET进而发挥抗癌作用。
非小细胞肺癌 miRNA-34b MET基因 麦冬皂苷B
肺癌严重危害人类健康是目前世界上最常见的恶性肿瘤,在恶性肿瘤相关死亡原因中占第1位,造成极大的疾病负担[1]。其中非小细胞肺癌(Non-Small Cell Lung Cancer,NSCLC)是肺癌的主要病理类型,占所有肺癌病例的80.0%以上。随着综合治疗模式以及分子生物化学的发展,NSCLC的治效有所提高,但预后仍不理想,5年总生存率不到20.0%。微小核糖核酸(miRNA)是一类广泛存在的非编码蛋白的小分子RNA,miRNA表达及调控失衡在恶性肿瘤的发生、发展中发挥重要作用[2]。近年来,随着对miRNA研究的深入,越来越多的研究显示miRNA在肺癌的发展过程中占有重要的地位[3]。其中miRNA-34b被证实与NSCLC的发生和发展密切相关。
“周氏克金岩方”为国医大师周仲瑛教授临床经验总结的抗肺癌有效验方,由软坚散结、燥湿化痰、活血祛瘀、养阴益气等4类功效药物组成。经高通量筛选,得到对非小细胞肺癌(NSCLC)有细胞毒作用的单体靶点有20余种,包括麦冬皂苷、异甘草素、槲皮素、人参皂苷和联苄类化合物等单体化合物。在这张抗肺癌方剂,麦冬皂苷B(OPB)[4]作为一味不可或缺的中药组分,具有显著的体外抗癌作用,但其相关机理有待进一步研究。本实验通过检测感染过表达慢病毒LV-hsa-miR-34b的A549细胞株以及加入了OPB的A549细胞株中miRNA-34b及MET基因的表达,来揭示OPB抗NSCLC的可能机制。
1 材料与方法
1.1.1 细胞
胚胎肺成纤维细胞MRC-5和人非小细胞肺癌细胞A549均购于中国科学院上海细胞库。
1.1.2 分组
实验细胞共分为CON组(A549细胞)、MRC-5组、CON+OPB组、Micro-up组(感染过表达慢病毒)、NC组(感染阴性对照病毒)。
1.1.3 主要试剂
1640、MEM、胎牛血清和链霉素(10 000 μg·mL-1)/青霉素(10 000 U·mL-1)(美国 Gibco公司,批号分别为:8115211、8114274、8172881、1491907);Trizol (上海普飞公司,批号:3101-100);oligo dT(上海化工,批号:B0205);M-MLV、dNTPS、Rnase Inhibitor (promega 公司,批号分别为:M1705、U1240、N2115);SYBR Master Mixture(TAKARA公司,批号:DRR041B);hsa-miR-34b过表达慢病毒LV-hsa-miR-34b病毒(批号:17056-2)和阴性对照CON181B病毒以及Primer由上海吉凯基因有限公司合成;Lipofectamine 2000(Invitrogen公司,批号:11668);兔抗人MET一抗(Abcam 公司,批号:ab193599),山羊抗兔 IgG 二抗(Santa公司,批号:B0513);BCA Protein Assay(上海碧云天生物科技有限公司,批号:P0010S);Polybrene 和 Enhanced Infection Solution (上海凯基基因,货号:REVG0001、REVG0002);麦冬皂苷B(南京泽朗医药科技有限公司,批号:ZL20110412B),配成 10 mmol·L-1贮液备用。
1.2 方法
1.2.1 细胞培养
MRC-5细胞用含有10%浓度的胎牛血清和1%浓度的青霉素/链霉素双抗的MEM培养基,A549细胞用含有10%浓度的胎牛血清和1%浓度的青霉素/链霉素双抗的1640培养基,均在37℃、5% CO2的培养箱内培养。
1.2.2 给药
根据前期的实验结果[5],A549细胞密度达80.0%时,加麦冬皂苷B 10 μmol·mL-1,处理6 h后收样。1.2.3 目的细胞A549慢病毒感染
将指数生长期的A549细胞用胰酶消化,用完全培养基配制成5×104个·mL-1的细胞悬液,6孔板每孔加入2 mL,继续培养至感染时细胞铺板量达20.0%,每孔更换为1 mL的无双抗培养基。根据MOI值公式计算每孔加入的过表达hsa-miR-34b的慢病毒LV-hsa-miR-34b和空白阴性对照慢病毒LV-NC病毒量(109TU·mL-1)来感染A549细胞,感染时加入5 μg·mL-1的polybrene以增加感染率。感染12 h后更换为完全培养基培养细胞。观察细胞状况,根据其生长状况更换培养基。感染96 h后,倒置荧光显微镜观察荧光蛋白的表达情况,并摄像。
1.2.4 细胞总RNA的提取及纯化
分别收集CON组细胞,CON+OPB组细胞,MRC-5细胞,Micro-up组细胞及NC组细胞2×106个,按照Trizol试剂盒上的说明方法提取总RNA。待RNA沉淀基本透明时,加入RNase-free水至完全溶解,NanoDropTM2000/2000C分光光度计分别测定所抽提RNA的浓度及质量。
1.2.5 实时荧光定量PCR
为了证实过表达慢病毒感染的情况,以及感染过表达病毒和加入OPB前后MET基因表达的变化,我们进行了qRT-PCR 验证(以U6为内参)。qRTPCR反应条件为:95℃变性30 s;95℃退火5 s,60℃延伸30 s,30个循环。分析目的基因循环次数(Cycle Time,Ct值),通过2-△△Ct法计算目的基因差异表达倍数。所有实验重复3次。
1.2.6 miRNA-34b的靶基因预测
通过生物学信息软件对miRNA-34b的靶基因进行预测。研究常用的三大miRNA 靶基因预测软件PicTar、Targetscan 和 Miranda同时对miRNA-34b的潜在靶基因进行预测。
1.2.7 Western blot 检测MET蛋白的表达
将指数生长期的各组细胞用PBS洗涤两次后用轻轻刮下细胞转移入EP管中,用含有苯甲基磺酰氟(Phenylmethyl Sulfonylfluoride,PMSF)的RIPA裂解液提取细胞总蛋白,BCA法测定蛋白浓度,调整每个样品浓度为2 μg·mL-1,每孔上样20 μL,用SDSPAGE 胶进行电泳,然后将蛋白转移到PVDF膜上,用含5%脱脂牛奶的TBST溶液封闭PVDF 1 h,加入一抗(1:500稀释),4℃过夜,TBST洗4次,每次8 min,再加入含有辣根过氧化物标记的二抗(1:2 000 稀释)孵育1.5 h,TBST洗4次,每次8 min。以1:40的比例混合A液和B液均匀滴加到硝酸纤维素膜上,曝光检测。β-actin作为内参对照。所有实验至少重复3次。

图1 miRNA-34b的表达
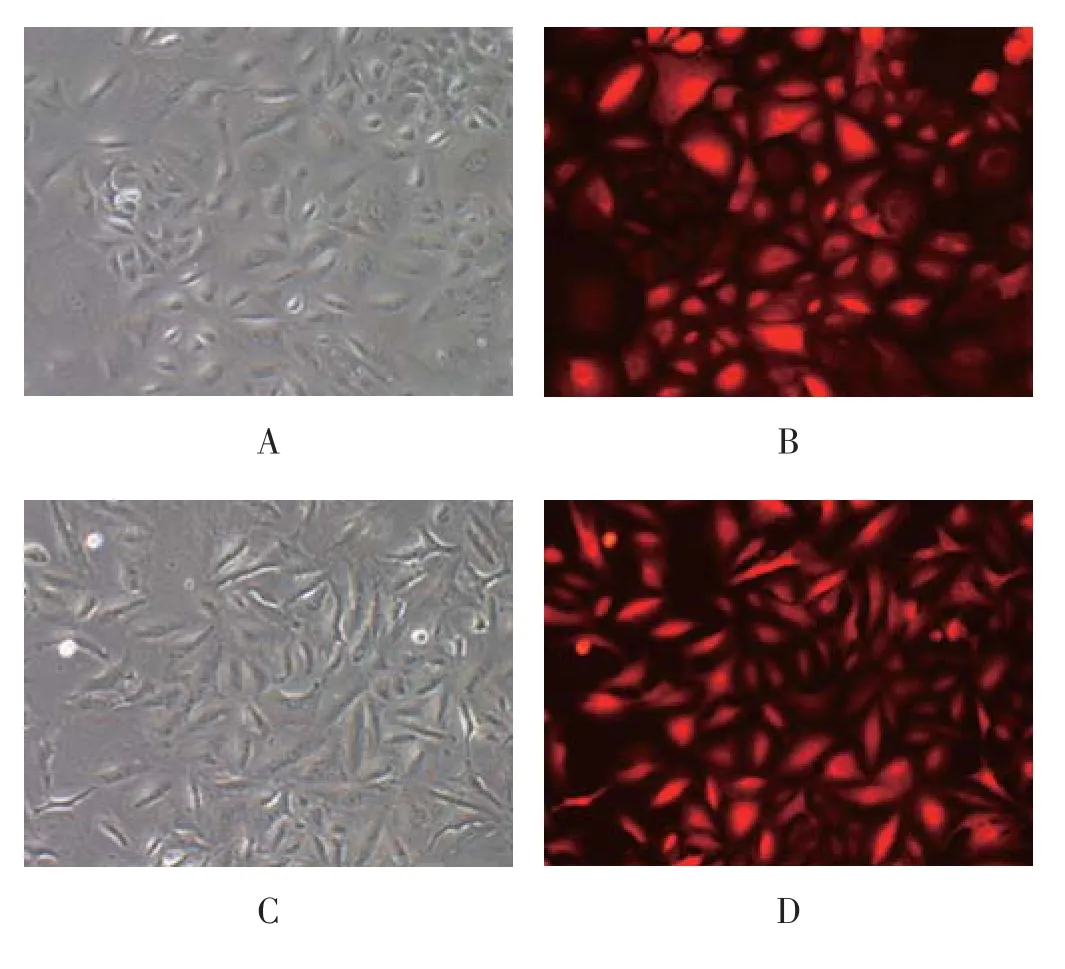
图2 各组细胞荧光视野下病毒感染结果(×100倍)

图3 miR-34b的表达
1.2.8 统计学处理
采用SPSS 17.0 统计学软件进行单因素方差分析,所有实验数据采用平均数±标准差(x-±s)表示,组间两样本的均数比较采用成组 t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 miRNA-34b在MRC-5组、A549组、A549+ OPB组的表达
以U6为内参,MRC-5组为基准,校正计算各组2-△△Ct值。miRNA-34b在非小细胞肺癌中的表达明显降低,加入抑制肿瘤的OPB后其含量升高,说明miRNA-34b具有明显的抑癌作用,且OPB能升高A549细胞中miRNA-34b的含量(图1)。
2.2 各组细胞感染结果
Micro-up组感染LV-hsa-mir-34b(17056-2)病毒,NC对照组感染阴性对照CON181病毒,病毒感染后96 h进行荧光拍照,放大100倍,各组细胞荧光拍照结果见图2,可见病毒感染成功。
2.3 miRNA-34b潜在靶基因的预测
通过查阅相关文献并利用生物学靶基因预测软件分析,发现miRNA-34b预测的靶基因中包括MET,且提示MET可能是miRNA-34b的关键下游靶基因,这种基因已被证实在多种恶性肿瘤中发挥作用。
2.4 通过qRT-PCR验证miR-34b的表达以及miR-34b和OP-B对MET基因表达的影响
为验证A549细胞是否感染成功,以及OPB和miR-34b和MET基因的影响,感染96 h后通过qRT-PCR来测定miR-34b和MET基因的表达水平,以NC组为基准,计算各组细胞2-△△Ct。qRTPCR结果显示,Micro-up组miR-34b的表达丰度是NC组的398.456倍(P=0.012),说明过表达慢病毒感染成功;转染LV-hsa-miR-34b病毒和加入OPB后,都能使MET基因表达减少,说明miR-34b和OPB能抑制MET基因的表达,结果见图3、图4。
2.5 miR-34b以及OPB对MET蛋白表达的影响
过表达慢病毒LV-hsa-miR-34b感染96 h以后,以及加入OP-B6h以后,检测A549细胞MET蛋白的表达水平。灰度分析结果显示,转染过表达慢病毒以及加入OP-B均使MET蛋白的表达量下调,与CON组相比P<0.05,结果见图5。
3 讨论
microRNA(miRNA)是一类长度大约21-25 nt的内源性非编码小分子RNA,它们由较长的初级转录前体(pri-miRNA)被剪切形成具有发卡结构初级miRNA(pre-miRNA)。pre-miRNAs 从细胞核转运到细胞质中,并被Dicer酶切割为成熟的miRNA。miRNA主要通过与靶标基因3’非编码区(3’-UTR)的完全或不完全互补配对,降解靶标基因mRNA或抑制其翻译,从而参与调控细胞增殖、分化 凋亡、代谢,个体发育,肿瘤形成[6]。近年来随着肿瘤研究的不断深入,miRNA已经成为肿瘤研究领域的一个新靶点[7]。miRN的调控相当复杂,至今miRNA数据库“miRBas”中已收录近1 000种人类的miRNA,并且每一个miRNA都有很多潜在的作用靶点。据统计,microRNA调控了人体中近1/3的基因表达[8]。已发现的miRNA约50%在基因组上定位于与肿瘤发生相关的区域和脆性位点,miRNA在肿瘤的发生发展过程中起到调控的枢纽作用。miRNA-34家族包括miRNA-34a、miRNA-34b和miRNA-34,其中miRNA-34a有独立的转录本,而miRNA-34b和miRNA-34c共用一个转录本[9]。由于miRNA-34b在肺部组织的特异性表达,且miRNA-34b影响肿瘤细胞的增殖、凋亡、转移,在肿瘤发展过程中发挥抑制肿瘤的作用[10],提示miRNA-34b对于肺癌研究的价值。因此,我们以非小细胞肺癌A549细胞与正常胚肺成纤维细胞中miRNA-34b的表达差异为切入点,研究其在非小细胞肺癌A549细胞中的作用及作用机制。
MET基因是原癌基因,其蛋白产物是肝细胞生长因子(Hepatocyte Growth Factor, HGF)的受体,具有酪氨酸激酶活性[11]。MET蛋白及其配体HGF的结合在多种恶性肿瘤如食管癌、肺癌、乳腺癌、肝癌等的发生、浸润、转移中发挥重要作用[12]。研究发现,几乎所有的非小细胞肺癌中都有MET蛋白的表达,其中超过60%为过表达[13]。而通过生物学信息软件预测发现MET基因可能为miRNA-34b下游调控靶基因,我们推测miRNA-34b可以通过调控MET基因的表达而发挥其抑癌作用[14]。miRNA-34b通过与MET mRNA的3’-UTR不完全互补配对结合而降解MET的mRNA,抑制其表达。本实验发现感染了过表达慢病毒LV-hsa-miR-34b的非小细胞肺癌A549细胞中,MET基因的表达降低,说明miRNA-34b对MET基因的表达起抑制作用。
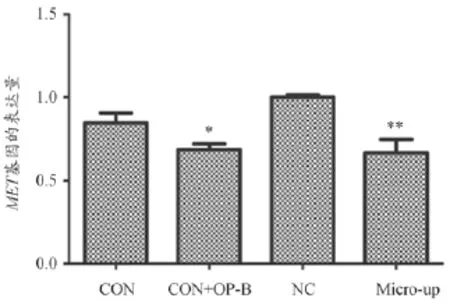
图4 MET基因的表达
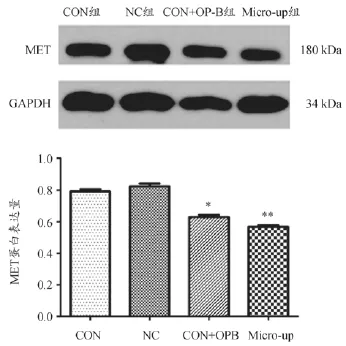
图5 MET蛋白的表达
OPB是近年来发现的一种具有抑癌作用的单体。研究发现OPB对于多种NSCLC细胞株均具有明显的抑制作用。通过抑制MMP-2和MMP-9,抑制 NSCLC细胞转移和迁移;通过抑制PI3K/Akt通路,OPB能诱导NSCLC肿瘤细胞发生自噬;还可以通过抑制CyclinB1、CyclinA2、CDK2等基因的表达,诱导周期抑制蛋白P21和P27的表达而促进细胞周期阻滞[15]。在实验中,我们发现加入OPB后A549细胞的miRNA-34b表达量升高,而MET基因和蛋白表达均降低;感染过表达慢病毒LV-hsa-miR-34b的A549细胞中MET基因和蛋白表达也降低。所以推测在非小细胞肺癌A549细胞中OPB的抑癌效应可能是通过调控miRNA-34b,从而调控MET通路来实现的。这一研究为明确miRNA-34b调控非小细胞肺癌的发生发展机制以及OPB的新药研发提供了一种新的思路。
1 韦堂军,程银.略论传统中医的肿瘤辨治观.世界科学技术-中医药现代化, 2015, 17(4): 891-896.
2 孟建忠,景欣悦,朱冰梅. MicroRNA-193b与肥胖的研究进展.世界科学技术-中医药现代化, 2015, 17(10): 2130-2135.
3 Reddy K B. MicroRNA (miRNA) in cancer. Cancer Cell Int, 2015, 15: 38.
4 许秋菊,侯莉莉,胡国强,等.麦冬皂苷B诱导人宫颈癌HeLa细胞自噬的机制.药学学报, 2013, 48(6): 855-859.
5 张旭,陈美娟,赵若琳.麦冬皂苷对非小细胞肺癌细胞株NCI-H157细胞周期及PI3K-AKT-mTOR信号通路的影响研究.中药药理与临床, 2014, 30(5): 40-44.
6 Callegari E, Gramantieri L, Domenicali M, et al. MicroRNAs in liver cancer: a model for investigating pathogenesis and novel therapeutic approaches. Cell Death Differ, 2015, 22(1): 46-57.
7 张瑞娟,许建华,余文燕,等. MicroRNA介导肿瘤多药耐药及中药的作用.世界科学技术-中医药现代化, 2013, 15(7): 1515-1520.
8 Yin H, Peng X, Ren P, et al. MicroRNAs as a novel class of diagnostic biomarkers in detection of hepatocellular carcinoma: A meta-analysis. Tumour Biol, 2014, 35(12): 12317-12326.
9 Stahlhut C, Slack F J. Combinatorial action of microRNAs let-7 and miR-34 effectively synergizes with erlotinib to suppress non-small cell lung cancer cell proliferation. Cell Cycle, 2015, 14(13): 2171-2180.
10 Pigazzi M, Manara E, Baron E, et al. miR-34b targets cyclic AMP-responsive element binding protein in acute myeloid leukemia. Cancer Res, 2009, 69(6): 2471-2478.
11 Gallo S, Sala V, Gatti S, et al. Cellular and molecular mechanisms of HGF/Met in the cardiovascular system. Clin Sci (Lond), 2015, 129(12): 1173-1193.
12 Hultberg A, Morello V, Huyghe L, et al. Depleting MET-expressing tumor cells by ADCC provides a therapeutic advantage over inhibiting HGF/MET signaling. Cancer Res, 2015, 75(16): 3373-3383.
13 Raghav K P, Gonzalez-Angulo A M, Blumenschein G R Jr. Role of HGF/MET axis in resistance of lung cancer to contemporary management. Transl Lung Cancer Res, 2012, 1(3): 179-193.
14 Brighenti M. MicroRNA and MET in lung cancer. Ann Transl Med, 2015, 3(5): 68.
15 Chen M, Du Y, Qui M, et al. Ophiopogonin B-induced autophagy in non-small cell lung cancer cells via inhibition of the PI3K/Akt signaling pathway. Oncol Rep, 2013, 29(2): 430-436.
A Research on miRNA-34b Expression Regulated by Ophiopogonin-B in Vitro in Non-Small Cell Lung Cancer A549 Cells
Qiu Wenli, Jiang Zequn, Chen Haibin, Zhou Hongguang
(School of Basic Medical Sciences, Nanjing University of Chinese Medicine, Nanjing 210023, China)
This study aimed to observe miRNA-34b expression through different treatments of non-small cell lung cancer (NSCLC), and investigate the regulatory effect of miR-34b on MET signaling pathway and the molecular mechanism of anti-tumor effect of ophiopogonin-B (OPB), and explore the new target for the treatment of NSCLC. Taking A549 cells, MRC-5 cells, A549 cells with OPB treatment, A549 cells infected with hsa-miR-34b-over-expressed lentivirus vector, and A549 cells infected with negative control CON181B virus as researchobjects, the CON group, the MRC-5 group, the CON+OPB group, the Micro-up group and the NC group were involved in the study. The expression of miR-34b in the A549 group, the MRC-5 group and the A549+OPB group were detected by qRT-PCR. Downstream targets of miR-34b were predicted by a bioinformatics software. Quantitative analysis was performed to quantify the expression of MET gene by qRT-PCR method with OPB administration. The effects of miR-34b and OPB on the expression of MET protein was tested by Western blot. Compared with the MRC-5 group, the expression of miR-34b in A549 cells was significantly decreased, but increased combining with OPB. TargetScan bioinformatics software showed that MET gene was prodicted to be the high-related downstream target gene of miR-34b. Within the administration of OPB, both genatic and protein levels of MET were decreased. In conclusion, OPB may present its anti-tumor effects through up-regulating miR-34b expression in A549 cells and supposing its downstream gene MET.
Lung cancer, miRNA-34b, MET gene, ophiopogonin-B
10.11842/wst.2016.04.011
R73-3
A
(责任编辑:马雅静,责任译审:朱黎婷)
2016-03-07
修回日期:2016-03-25
* 国家自然科学基金委面上项目(81473608):基于microRNA调控网络的消癌解毒方抗肿瘤作用机制研究,负责人:周红光; 国家自然科学基金委面上项目(81273717):基于蛋白组学方法的“癌毒”病机研究,负责人:吴勉华;国家自然科学基金委青年科学基金项目(81503535):基于mTOR信号通路调控缺氧微环境下细胞自噬的消癌解毒方抗肿瘤作用机制研究,负责人:李黎。
** 通讯作者:周红光,医学博士,副教授,副主任中医师,主要研究方向:中西医结合抗肿瘤研究。

