糖肾平对糖尿病肾病KK-Ay小鼠肾脏保护作用及对TGF-β1/ Samd6 / BMP7信号通路影响的研究*
吴阿敏,赵宗江,张新雪,杨美娟,杨冠男,苗永辉,徐昌君,黄雅薇
(北京中医药大学基础医学院 北京 100029)
糖肾平对糖尿病肾病KK-Ay小鼠肾脏保护作用及对TGF-β1/ Samd6 / BMP7信号通路影响的研究*
吴阿敏,赵宗江**,张新雪,杨美娟,杨冠男,苗永辉,徐昌君,黄雅薇
(北京中医药大学基础医学院 北京 100029)
目的:本研究主要探讨糖肾平对糖尿病肾病(DKD)KK-Ay小鼠肾脏保护作用及其对TGF-β1/ Samd6 / BMP7信号通路的影响。方法:10只雌性C57BL/6J小鼠作为对照组。雌性10周龄KK-Ay小鼠60只,KK鼠料诱导10周后建立糖尿病肾病动物模型。模型小鼠按体质量和血糖区组分层随机法分为模型组、厄贝沙坦组与糖肾平小、中、大剂量组。厄贝沙坦组,糖肾平小、中、大剂量组均灌胃给药,正常组、模型组用等体积去离子水灌胃。每4周称体质量和测24 h尿蛋白定量。实验第26周,眼球取血并处死小鼠,称肾脏质量、测血糖,分离血清测BUN、Scr、TG、MDA、NO和SOD;HE染色和Mallory染色观察肾组织病理形态;原位杂交、免疫组化、Western blot检测肾组织TGF-β1、Samd6、BMP7、α-SMA、E-Cadherin mRNA及蛋白表达。结果:与模型组比较,各治疗组体质量、肾质量/体质量、尿蛋白降低,其中糖肾平中、大剂量组有显著性差异(P<0.01);肾脏病理损害明显减轻,FBG、血清BUN、Scr、TG和MDA含量明显降低(P<0.01),NO、SOD含量明显增加(P<0.01),Samd6、BMP7和E-Cadherin mRNA及蛋白的表达量增加,TGF-β1和α-SMA mRNA及蛋白的表达量减少,其中糖肾平大剂量组有显著性差异(P<0.01),糖肾平的治疗效果呈剂量依赖关系。结论:糖肾平对DKD KK-Ay小鼠肾脏保护及逆转肾小管上皮细胞转分化的作用,可能与下调氧化应激水平及调节TGF-β1/ Samd6 / BMP7信号通路有关,这为DKD“肾痿”学说提供了新的实验依据。
糖尿病肾病 糖肾平 肾痿 KK-Ay小鼠 TGF-β1/ Samd6 / BMP7通路 肾小管上皮细胞转分化
目前中国约7%的成年人患糖尿病(Diabetes Mellitus,DM),人数高达0.92亿[1],DM病程持续10-20年,约1/3的患者会发展为糖尿病肾病(Diabetic Kidney Disease,DKD)[2]。DKD治疗远较一般肾病复杂,预后也较差,目前西医主要以降低血糖、血脂、血压及改善微循环来控制病情,但由于尚无有效的治疗药物,故难以阻止其病程发展。DKD的发病机制尚未完全明确,DKD的典型病理改变是肾小球硬化和肾小管间质纤维化,对肾小管间质纤维化的研究发现[3],超过1/3的间质成纤维细胞来源于肾小管上皮-间质细胞转分化(Epithelial-Mesenchymal Trandifferentiation,EMT),肾小管上皮细胞EMT被认为是DKD肾单位功能丧失的一个关键因素[4],表现为失去上皮细胞的标志物E-钙黏素(E-cadherin)而获得间质成纤维细胞的标志物α-平滑肌肌动蛋白(α-Smooth Muscle Actin,SMA)。TGF-β1/ Samd6 / BMP7信号通路参与肾小管上皮细胞EMT[5]。糖肾平是“肾痿”假说[6]指导下的中药复方,本课题组前期观察到糖肾平能够通过改善足细胞EMT[7],维持足细胞裂孔隔膜蛋白:肾病蛋白(nephrin)和CD2相关蛋白(CD2 Associated Protein,CD2AP)的稳定性[8],保护足细胞来延缓DKD的病程进展。此次实验采用DKD KK-Ay小鼠模型,观察糖肾平对DKD KK-Ay小鼠的肾脏保护作用的机制和对肾小管上皮细胞EMT的影响,为进一步阐释糖肾平防治DKD的机制提供实验依据。
1 材料
1.1 实验动物与实验药物
SPF级健康、雌性10周龄KK-Ay小鼠60只,SPF级健康、雌性10周龄C57BL/6J小鼠10只(北京华阜康生物科技有限公司,许可证编号:SCXK京2014-0004),KK鼠料(北京华阜康生物科技有限公司,专利号:CN102648734A、11003800003551)。实验动物于洁净动物橱(北京文慧净化设备厂制造,专利号:EJ932041477)中饲养,饲养环境为室温23-25℃,相对湿度50%-60%。
糖肾平(生黄芪6 g、熟地黄3 g、山萸肉2 g、丹皮3 g、地骨皮3 g、水蛭2 g,北京中医药大学中药学院制剂室制备);厄贝沙坦片(赛诺菲安万特,进口药品注册证号:H20130118,国药准字J20130049)。
1.2 主要实验试剂与仪器
液体蛋白抽提试剂盒-II(北京普利莱基因技术有限公司,货号/批号:P1255/20150309);BCA法蛋白定量试剂盒(北京普利莱基因技术有限公司,货号/批号:P1511/20151511052003);一抗β-actin(美国Cell Signaling Technology公司,货号/批号:4970/0011);TGF-β1(英国Abcam公司,货号/批号:ab92486/GR253274-1);Samd6(美国Novus Biologicals公司, 货号/批号:NBP1-19812/ G22121);BMP7(英国Abcam公司,货号/批号:ab54904/GR196216-4);α-SMA(英国Abcam公司,货号/批号:ab32575/GR32377-41);E-Cadherin(英国Abcam公司,货号/批号:ab76055/GR216035-1);二抗山羊抗兔(英国Abcam公司,货号/批号:ab6721/GR231489-1);山羊抗鼠(英国Abcam公司,货号/批号:ab6789/GR215715-5);ECL超敏发光液(德国Merck Millipore公司,货号/批号:WBKLS0100/1316802)。
原位杂交探针:TGF-β1(天津灏洋生物工程有限公司,货号/批号:BSH0087F/20150521);Smad6、BMP7、α-SMA、E-Cadherin(武汉博士德生物工程有限公司,货号/批号:MK2123/01907TW509171 12050VI、MK1787/000600108-101050FH、MK3558 /01906TW50917112059VI、MK1181/01908TW5091 7115050VI),探针序列分别为:TGF-β1:5′-AG CCCTGTATTCCGTCTCCTTGGTTCA-3′;Smad6:5′-TATTCTCGGCTGTCTCCTCCTGACCAGTACAA GCC-3′;BMP7:5′-TGCGGCGCCGCACAGCTTC GTGGCGCTCTG-3′;α-SMA:5′-TGTGAAGAGG AAGACAGCACAGCCCTGGTGTGCGACAATGGCT CT-3′;E-Cadherin:5′-AACGATCCTGACCAGCA GTTCGTTGTTGTCACAGA-3′。
2 方法
2.1 模型制备与分组
C57BL/6J小鼠喂食普通小鼠饲料,作为对照组;KK-Ay小鼠喂食KK鼠料,自由饮水及进食,适应性喂养1周。KK鼠料诱导10周后,尾静脉采血,罗氏血糖仪及配套试纸测空腹血糖(Fasting Blood Glucose,FBG)≥16.7 mmol·L-1,并代谢笼收集24 h尿液,当24 h尿蛋白≥0.4 mg确认为DKD动物模型建立。
将造模成功的小鼠按照按体质量和FBG分层随机分为模型组、厄贝沙坦组、糖肾平小剂量组、糖肾平中剂量组、糖肾平大剂量组。厄贝沙坦组按人临床用药剂量10倍(每日25 mg·kg-1)灌胃给药;糖肾平小、中、大剂量组分别按人临床用药剂量5倍(每日44 mg·kg-1)、10倍(每日88 mg·kg-1)、20倍(每日176 mg·kg-1)灌胃给药;对照组、模型组小鼠用等体积去离子水灌胃,灌胃剂量按0.1 mL/10 g体质量计算,用药16周。
2.2 观察指标
2.2.1 一般情况
观察小鼠的精神状态、饮食、二便、皮毛及活动情况等。
2.2.2 器官系数
每4周称量小鼠体质量,实验第26周,眼球取血后,摘取肾脏并称重,计算各组肾质量与体质量比。
2.2.3 24 h尿蛋白定量测定
实验第10、14、18、22、26周末分别收集24 h尿液,用500 μL液体蛋白抽提试剂盒-II抽提100 μL尿液,排除尿酸等杂质干扰,用BCA法96孔板测蛋白浓度:将25 μL蛋白样品与200 μL工作液混合,37℃温箱孵育30 min,测562 nm光密度值;绘制标准曲线,计算蛋白浓度。
2.2.4 生化指标
全血测FBG;小鼠腹腔注射4%水合氯醛麻醉,摘眼球取血,4℃静置2 h,4℃2 500 rpm离心20 min,吸取上层血清,-20℃保存,用7150全自动生化分析仪检测血清BUN、Scr、TG、MDA、NO和SOD的含量。
2.2.5 肾组织病理形态学观察及免疫组化、原位杂交
摘取肾脏,固定后包埋。将肾组织石蜡切片行常规HE染色、Mallory染色及免疫组化;用DEPC水处理肾组织,行原位杂交,具体步骤参照文献[9]。
2.2.6 Western blot测定肾组织TGF-β1、Samd6、BMP7、α-SMA和E-cadherin的蛋白表达
一抗稀释浓度分别为TGF-β11:2 000、Samd6 1∶900、BMP7 1∶2 000、α-SMA 1∶2 000、E-cadherin 1∶1 000、β-actin 1∶1 000。电泳80 V、30 min,指示剂待到达浓缩胶下缘时,调节电压为120 V继续电泳1.5 h终止电泳、60 V恒压转膜2 h。具体步骤参照文献[7]。
2.3 图像分析
采用Image-Pro Plus 6.0图像分析软件对免疫组化及原位杂交结果进行图像分析,用Image J图像分析软件分析Western blot图像。
2.4 统计学方法
采用SPSS 20.0系统进行数据分析,数据用均值±标准差(±s)表示,组间比较用单因素方差分析、多重比较用LSD法。P<0.05为有统计学意义。
3 结果
3.1 一般情况
KK-Ay小鼠喂养KK鼠料后,精神渐显不佳,皮毛欠光泽,饮食饮水量和排尿排便量均增加,行动减少、稍见迟缓、体型圆润、体质量增加明显。实验第10周,部分小鼠出现糖尿病并发症,如溃疡、尿路感染等。与模型组比较,各治疗组小鼠一般状态有所改善,且糖尿病并发症小鼠数量相对较少,糖肾平大剂量组最为明显。每组各死亡4只,予以剔除。
3.2 糖肾平对DKD KK-Ay小鼠体质量及肾质量/体质量的影响
与对照组相比,模型组小鼠体质量明显增加(P<0.01);糖肾平治疗16周后体质量均呈下降趋势,其中糖肾平大剂量组体质量下降最为明显(P<0.01)。实验第26周取材后,与对照组相比,模型组小鼠肾质量/体质量明显增加(P<0.01);与模型组比较,糖肾平小、中、大剂量组肾质量/体质量均明显降低(P<0.01),其中糖肾平大剂量组肾质量/体质量降低最为明显。详见表1。
表1 糖肾平对DKD KK-Ay小鼠体质量和肾质量/体质量的影响(±s,n=8)
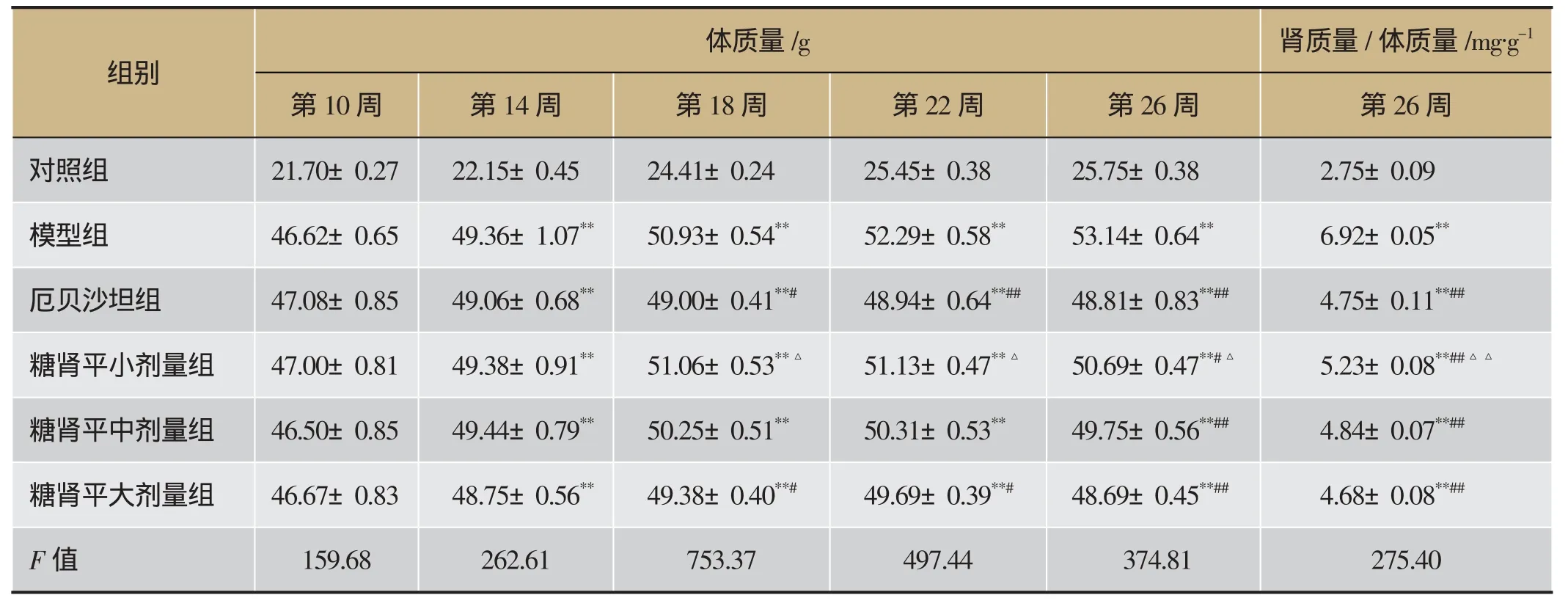
表1 糖肾平对DKD KK-Ay小鼠体质量和肾质量/体质量的影响(±s,n=8)
注:与对照组相比,**P<0.01;与模型组相比,#P<0.05,##P<0.01;与糖肾平大剂量组相比,△P<0.05,△△P<0.01。
体质量/g肾质量/体质量/mg·g-1第10周第14周第18周第22周第26周第26周对照组21.70±0.27 22.15±0.45 24.41±0.24 25.45±0.38 25.75±0.38 2.75±0.09模型组46.62±0.65 49.36±1.07**50.93±0.54**52.29±0.58**53.14±0.64**6.92±0.05**厄贝沙坦组47.08±0.85 49.06±0.68**49.00±0.41**#48.94±0.64**##48.81±0.83**##4.75±0.11**##糖肾平小剂量组47.00±0.81 49.38±0.91**51.06±0.53**△51.13±0.47**△50.69±0.47**#△5.23±0.08**##△△糖肾平中剂量组46.50±0.85 49.44±0.79**50.25±0.51**50.31±0.53**49.75±0.56**##4.84±0.07**##糖肾平大剂量组46.67±0.83 48.75±0.56**49.38±0.40**#49.69±0.39**#48.69±0.45**##4.68±0.08**##F值159.68262.61753.37497.44374.81275.40组别
3.3 糖肾平对DKD KK-Ay小鼠24 h尿蛋白的影响
与对照组相比,模型组24 h尿蛋白定量明显增加(P<0.01);与模型组比较,糖肾平中、大剂量组24 h尿蛋白定量明显降低(P<0.01),糖肾平小剂量组24 h尿蛋白定量降低(P<0.05),详见表2。
3.4 糖肾平对DKD KK-Ay小鼠FBG、血清BUN、Scr、TG、MDA、NO和SOD的影响
实验第26周,与对照组比较,模型组FBG明显升高(P<0.01);与模型组比较,糖肾平中、大剂量组FBG明显降低(P<0.05)。与对照组相比,模型组血清BUN、Scr、TG、MDA含量显著升高,NO、SOD含量明显降低(P<0.01)。与模型组比较,血清BUN、Scr、TG、MDA含量降低,NO、SOD含量增高,其中糖肾平大剂量组血清BUN、MDA、NO、SOD改变有显著性差异(P<0.01),糖肾平大剂量降低血清Scr作用优于厄贝沙坦。详见表3、表4。
表2 糖肾平对DKD KK-Ay小鼠24 h尿蛋白的影响/mg(±s,n=8)
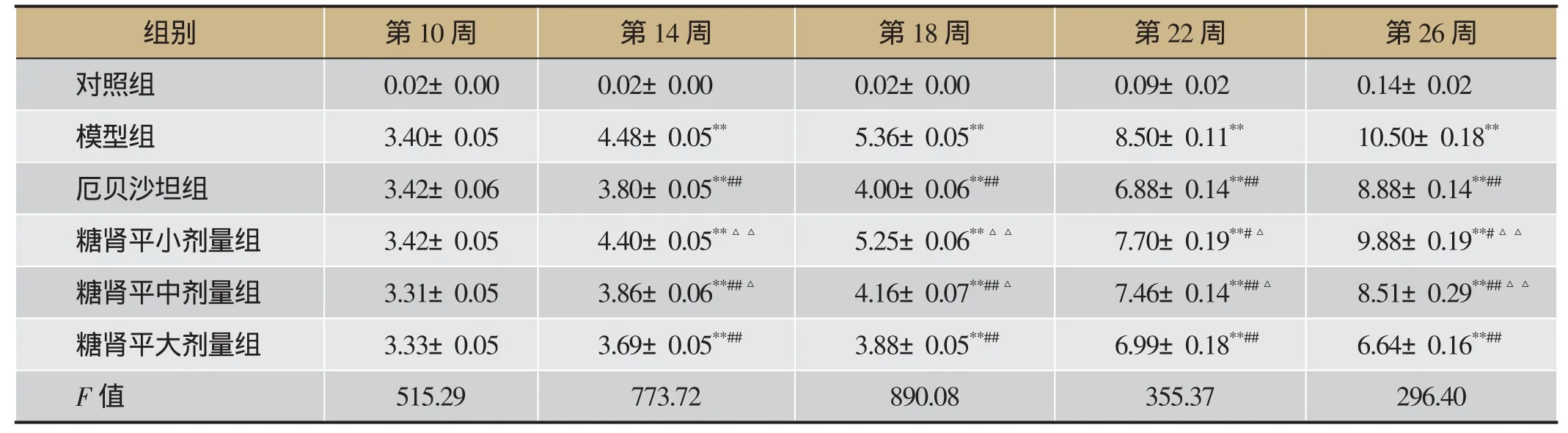
表2 糖肾平对DKD KK-Ay小鼠24 h尿蛋白的影响/mg(±s,n=8)
注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与糖肾平大剂量组比较,△P<0.05,△△P<0.01。
组别第10周第14周第18周第22周第26周对照组0.02±0.00 0.02±0.00 0.02±0.00 0.09±0.02 0.14±0.02模型组3.40±0.05 4.48±0.05**5.36±0.05**8.50±0.11**10.50±0.18**厄贝沙坦组3.42±0.06 3.80±0.05**##4.00±0.06**##6.88±0.14**##8.88±0.14**##糖肾平小剂量组3.42±0.05 4.40±0.05**△△5.25±0.06**△△7.70±0.19**#△9.88±0.19**#△△糖肾平中剂量组3.31±0.05 3.86±0.06**##△4.16±0.07**##△7.46±0.14**##△8.51±0.29**##△△糖肾平大剂量组3.33±0.05 3.69±0.05**##3.88±0.05**##6.99±0.18**##6.64±0.16**##F值515.29 773.72 890.08 355.37 296.40
表3 糖肾平对DKD KK-Ay小鼠FBG及血清BUN、Scr的影响(±s)

表3 糖肾平对DKD KK-Ay小鼠FBG及血清BUN、Scr的影响(±s)
注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与糖肾平大剂量组比较,△P<0.05。
组别n FBG BUN/mmol·L-1Scr/μmol·L-1第10周第26周对照组10 4.50±0.16 4.30±0.13 5.92±0.34 48.36±1.67模型组8 28.80±0.80**21.70±2.56**9.70±0.62**68.77±1.05**厄贝沙坦组8 29.00±0.84**16.20±1.85**#6.86±0.45##62.46±1.37**#糖肾平小剂量组8 28.60±1.72**20.80±1.50**7.63±0.17*#△65.17±1.43**糖肾平中剂量组8 28.10±1.02**15.30±1.66**#6.70±0.36##63.79±3.30**糖肾平大剂量组8 28.50±1.28**15.70±2.34**#6.33±0.52##60.21±1.60**#F值103.80 13.74 9.71 15.21
表4 糖肾平对DKD KK-Ay小鼠血清TG、MDA、NO、SOD含量的影响(±s)
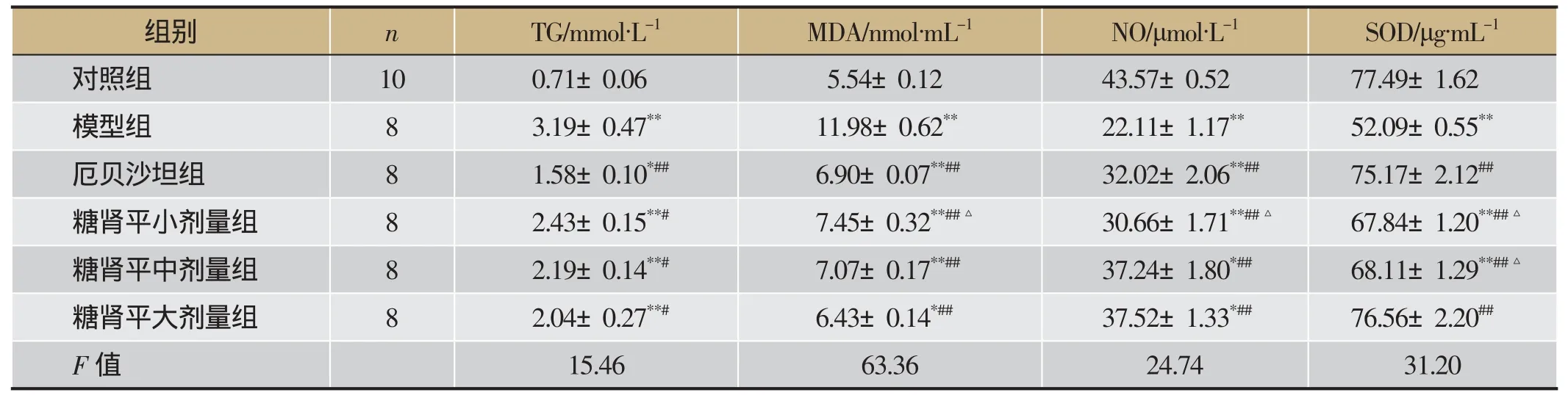
表4 糖肾平对DKD KK-Ay小鼠血清TG、MDA、NO、SOD含量的影响(±s)
注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与糖肾平大剂量组比较,△P<0.05。
组别n TG/mmol·L-1MDA/nmol·mL-1NO/μmol·L-1SOD/μg·mL-1对照组10 0.71±0.06 5.54±0.12 43.57±0.52 77.49±1.62模型组8 3.19±0.47**11.98±0.62**22.11±1.17**52.09±0.55**厄贝沙坦组8 1.58±0.10*##6.90±0.07**##32.02±2.06**##75.17±2.12##糖肾平小剂量组8 2.43±0.15**#7.45±0.32**##△30.66±1.71**##△67.84±1.20**##△糖肾平中剂量组8 2.19±0.14**#7.07±0.17**##37.24±1.80*##68.11±1.29**##△糖肾平大剂量组8 2.04±0.27**#6.43±0.14*##37.52±1.33*##76.56±2.20##F值15.46 63.36 24.74 31.20
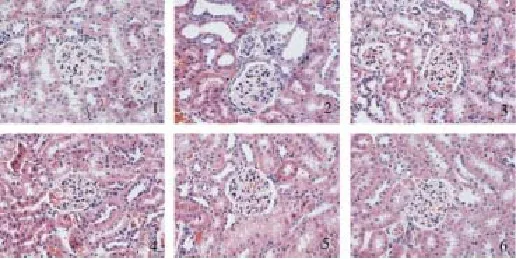
图1 各组肾组织HE染色(×400)
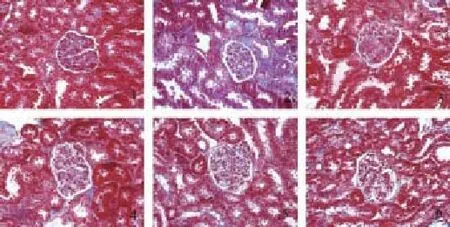
图2 各组肾组织Mallory染色(×400)
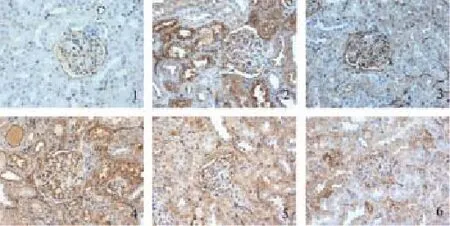
图3 糖肾平对各组肾组织TGF-β1mRNA表达的影响(×400)
3.5 糖肾平对肾组织病理形态的影响
光镜下见对照组小鼠肾小球、肾小管及间质组织结构正常;与对照组相比,模型组可见肾小球肥大、重度系膜细胞增生、大量胶原纤维,肾小球壁层上皮细胞增生,肾间质炎细胞浸润;与模型组比,糖肾平大剂量组和厄贝沙坦组系膜细胞轻度增生,少量胶原纤维,间质轻度纤维化,糖肾平小、中剂量组肾间质纤维化有一定减轻,中等量胶原纤维,系膜细胞中轻度增生,间质中等量炎细胞浸润,间质轻中度纤维化。见图1、图2。
3.6 糖肾平对肾组织TGF-β1、Samd6、Bmp7、α-SMA和E-Cad mRNA表达的影响
与对照组相比,原位杂交结果显示模型组肾小管上皮细胞Samd6、Bmp7和E-Cad mRNA表达明显减少,TGF-β1和α-SMA mRNA表达明显增加,均为棕黄色颗粒(P<0.01);与模型组相比,各治疗组Samd6、Bmp7和E-Cad mRNA的表达量明显增加,TGF-β1和α-SMA mRNA的表达明显减少,其中糖肾平大剂量组有显著性差异(P<0.01),糖肾平的治疗效果呈剂量依赖关系。见表5及图3-图7。
3.7 糖肾平对肾组织TGF-β1、Samd6、BMP7、α-SMA和E-cadherin蛋白表达的影响
免疫组化结果显示对照组肾小管上皮细胞大量表达Samd6、BMP7和E-cadherin,少量表达TGF-β1和α-SMA,均为棕黄色颗粒显色;与对照组相比,模型组Samd6、BMP7和E-cadherin蛋白表达明显减少,TGF-β1和α-SMA蛋白表达明显增加(P<0.01);与模型组相比,各治疗组Samd6、BMP7和E-cadherin的表达明显增加,TGF-β1和α-SMA的表达量明显减少,其中糖肾平大剂量组有显著性差异(P<0.01),糖肾平的治疗效果呈剂量依赖关系。详见表6及图8-图12。
表5 糖肾平对肾组织TGF-β1、Samd6、Bmp7、α-SMA、E-Cad mRNA表达的影响(±s,n=8)
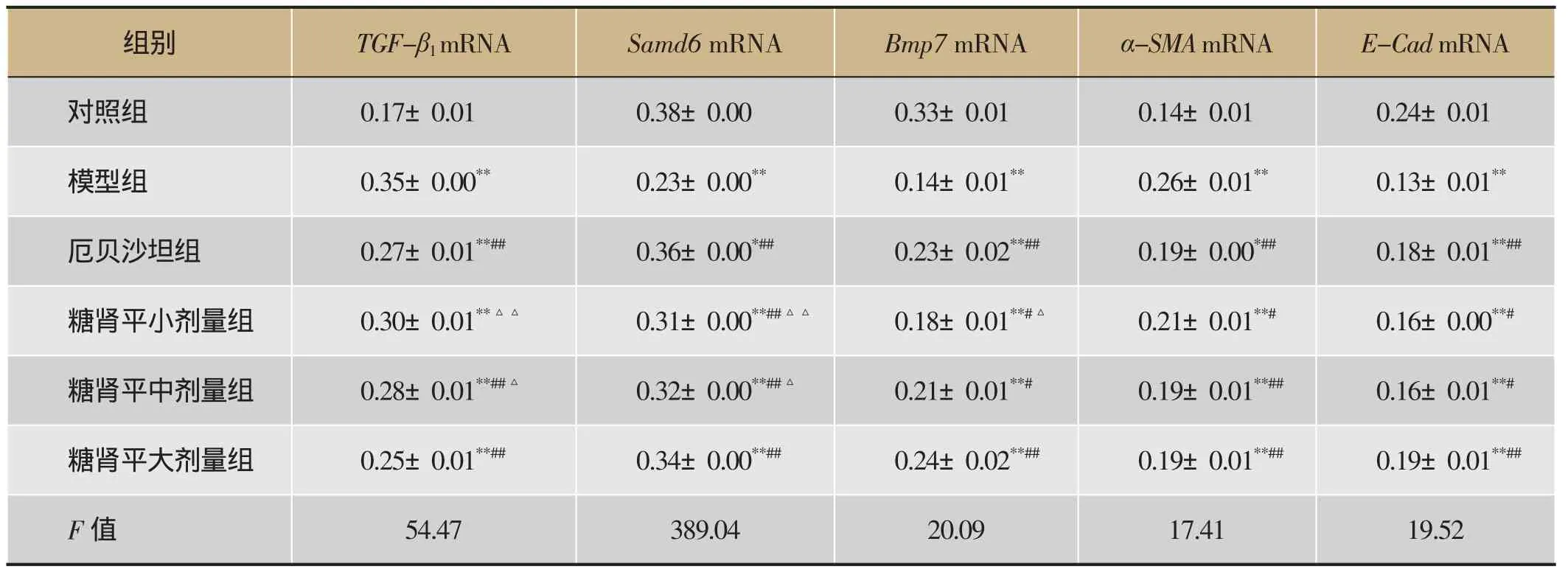
表5 糖肾平对肾组织TGF-β1、Samd6、Bmp7、α-SMA、E-Cad mRNA表达的影响(±s,n=8)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与糖肾平大剂量组比较,△P<0.05,△△P<0.01。
组别TGF-β1mRNA Samd6 mRNA Bmp7 mRNAα-SMA mRNA E-Cad mRNA对照组0.17±0.01 0.38±0.00 0.33±0.01 0.14±0.01 0.24±0.01模型组0.35±0.00**0.23±0.00**0.14±0.01**0.26±0.01**0.13±0.01**厄贝沙坦组0.27±0.01**##0.36±0.00*##0.23±0.02**##0.19±0.00*##0.18±0.01**##糖肾平小剂量组0.30±0.01**△△0.31±0.00**##△△0.18±0.01**#△0.21±0.01**#0.16±0.00**#糖肾平中剂量组0.28±0.01**##△0.32±0.00**##△0.21±0.01**#0.19±0.01**##0.16±0.01**#糖肾平大剂量组0.25±0.01**##0.34±0.00**##0.24±0.02**##0.19±0.01**##0.19±0.01**##F值54.47 389.04 20.09 17.41 19.52
Western blot显示对照组肾组织高表达Samd6、BMP7和E-cadherin,少量表达TGF-β1和α-SMA;与对照组相比,模型组肾组织Samd6、BMP7和E-cadherin表达明显减少,TGF-β1和α-SMA表达明显增加(P<0.01);与模型组相比,各治疗组Samd6、BMP7和E-cadherin的表达量明显增加,TGF-β1和α-SMA的表达量明显减少,其中糖肾平大剂量组有显著性差异(P<0.01),糖肾平的治疗效果呈剂量依赖关系。详见表7及图13。
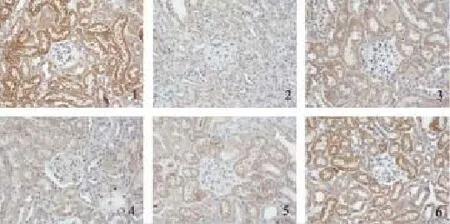
图4 糖肾平对各组肾组织Smad6 mRNA表达的影响(×400)
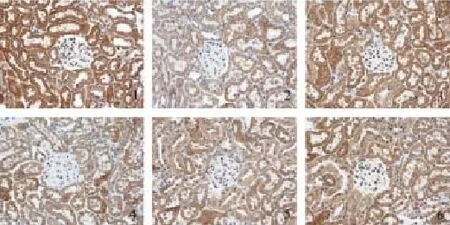
图5 糖肾平对各组肾组织Bmp7 mRNA表达的影响(×400)
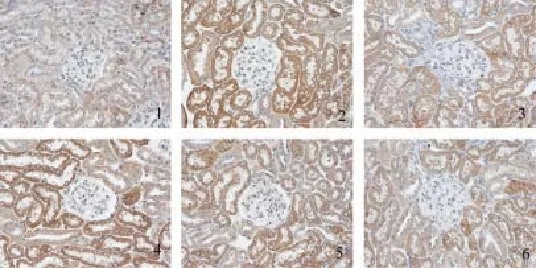
图6 糖肾平对各组肾组织α-SMA mRNA表达的影响(×400)
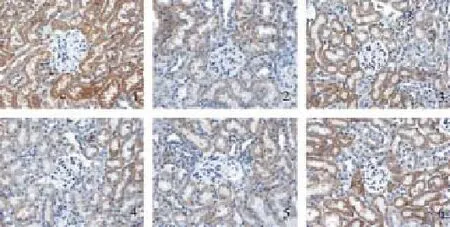
图7 糖肾平对各组肾组织E-Cad mRNA表达的影响(×400)
4 讨论
KK-Ay小鼠是一种基因(Ay)突变的2型DM动物模型[10],具有遗传信息完整、个体差异小、繁育时间短、可操作性较强和实验重复性好等优点。遗传因素和饮食因素共同参与了KK-Ay小鼠糖尿病的发生,与人类2型DM极为相似。有研究显示,高脂饲料诱导的18周龄KK-Ay小鼠出现高血糖、24 h尿蛋白排泄率增加等病变,肾质量和体质量均明显增加[11]。本实验观察到模型组DKD KK-Ay小鼠体质量明显增加,24 h尿蛋白定量明显升高,氧化应激水平升高,肾脏病理显示系膜细胞重度增生、间质炎细胞浸润等。
在DKD病理过程中,众多细胞因子和信号通路参与肾小管上皮细胞EMT,在一定条件下这一过程是可逆的[12]。TGF-β1/Samd6/BMP7信号通路参与EMT过程,TGF-β1具有促进细胞外基质的合成和沉积、诱导细胞凋亡和参与炎症反应等作用,从多个方面、多角度加快DKD病理进程。Smads蛋白家族是TGF-β1受体激酶的底物,是TGF-β1信号通路中一类非常重要的信号传导分子。Smad6是抑制型Smad,可以在C末端5个氨基酸的结构域(Pro-Leu-Asp-Leu-Ser,PLDLS)序列介导下与C末端结合蛋白(C-terminal Binding Protein,CtBP)结合,形成Smad6-CtBP复合物,并由此抑制骨形态发生蛋白(BMP)信号通路[13,14]。BMP7能通过抑制EMT,抑制肾小管上皮细胞I型胶原和α-SMA的表达,逆转EMT[15]。BMP7及Smad6在DKD肾纤维化发生发展中起重要的反馈性抑制作用,是重要的肾脏保护因子。α-SMA和E-Cadherin是常见的间充质细胞标志物和上皮细胞标志物[12,15]。
表6 糖肾平对肾组织TGF-β1、Samd6、BMP7、α-SMA和E-cadherin蛋白表达的影响(±s,n=8)
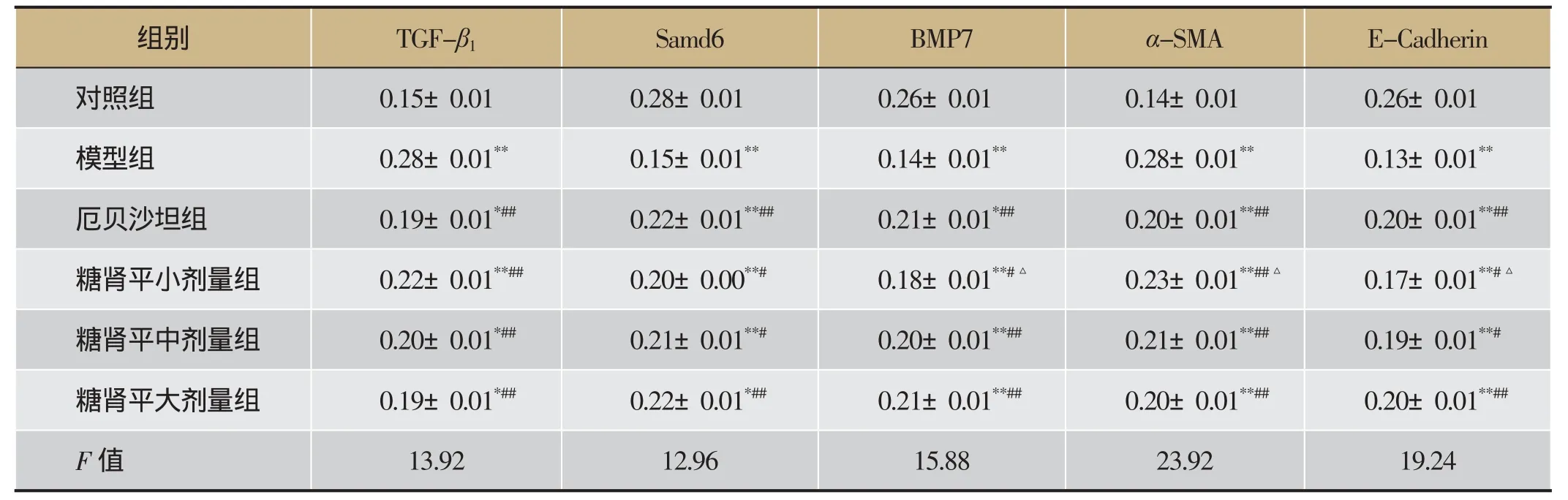
表6 糖肾平对肾组织TGF-β1、Samd6、BMP7、α-SMA和E-cadherin蛋白表达的影响(±s,n=8)
注:与正常对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与糖肾平大剂量组比较,△P<0.05。
组别TGF-β1Samd6 BMP7α-SMA E-Cadherin对照组0.15±0.01 0.28±0.01 0.26±0.01 0.14±0.01 0.26±0.01模型组0.28±0.01**0.15±0.01**0.14±0.01**0.28±0.01**0.13±0.01**厄贝沙坦组0.19±0.01*##0.22±0.01**##0.21±0.01*##0.20±0.01**##0.20±0.01**##糖肾平小剂量组0.22±0.01**##0.20±0.00**#0.18±0.01**#△0.23±0.01**##△0.17±0.01**#△糖肾平中剂量组0.20±0.01*##0.21±0.01**#0.20±0.01**##0.21±0.01**##0.19±0.01**#糖肾平大剂量组0.19±0.01*##0.22±0.01*##0.21±0.01**##0.20±0.01**##0.20±0.01**##F值13.92 12.96 15.88 23.92 19.24
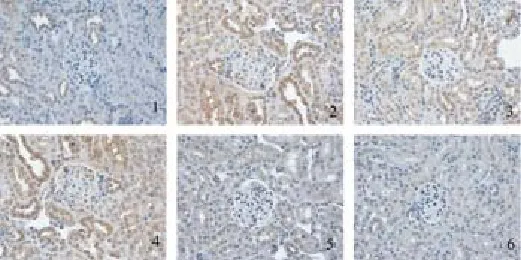
图8 糖肾平对各组肾组织TGF-β1蛋白表达的影响(×400)
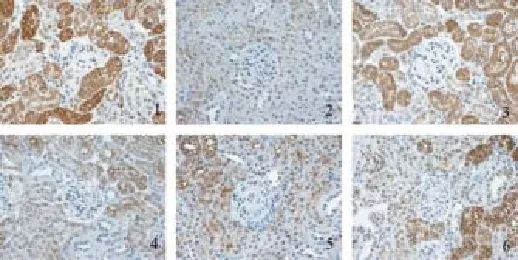
图9 糖肾平对各组肾组织Samd6蛋白表达的影响(×400)
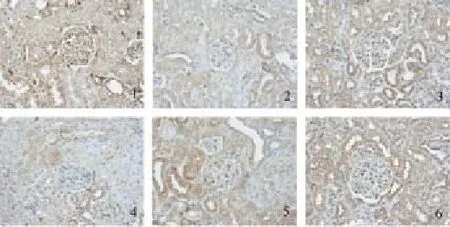
图10 糖肾平对各组肾组织BMP7蛋白表达的影响(×400)
赵宗江教授对DKD有丰富的临床经验和研究经历,对其病因病机和辨证论治具有独特见解,在《素问·痿论》、《金匮要略·肺痿肺痈咳嗽上气病脉证治第七》和《华佗神医秘传》等论著并参照现代科学研究技术的基础上,提出“肾痿”假说,在此基础上指导组方应用于临床治疗,并对糖肾平治疗DKD的机制展开了研究[7-9]。本虚标实为DKD基本病机,本虚是指气血阴阳亏虚,标实指兼挟症,如痰饮、瘀血、水湿、浊毒等,贯穿DKD全程。治疗要以补虚扶正为本,以期调整脏腑气血阴阳平衡,辅以祛邪排毒、活血化瘀。“肾痿”的病机涉及众多脏腑,病位在肝、脾、肾,以肾为主。糖肾平有滋补肝肾、益气固精的功效,并能活血化瘀通肾络,其特点为补而不滞、祛瘀而不伤正,治疗DKD之气阴两虚、瘀血阻络者为宜[16]。方中黄芪为君,熟地、山萸肉为臣,共奏固摄精微、补益肝肾、益气消肿之功;丹皮、地骨皮为佐,兼去虚热;水蛭为使,活血通经,以引诸药直达肾络。
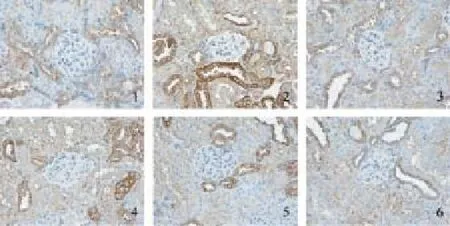
图11 糖肾平对各组肾组织α-SMA蛋白表达的影响(×400)
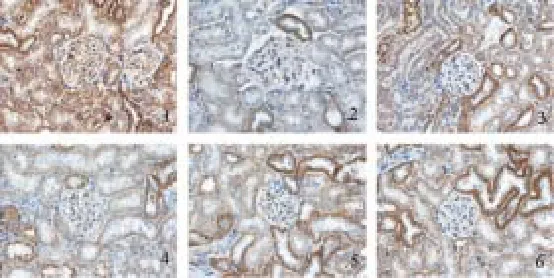
图12 糖肾平对各组肾组织E-cadherin蛋白表达的影响(×400)
本实验结果表明,模型组小鼠血清MDA的含量显著增加,NO、SOD的含量显著降低,处于氧化应激激活状态。Gomes等[17]研究发现在高糖环境下,肾小管上皮细胞MDA含量明显增加,反映大量脂质过氧化分解产物堆积、细胞严重受损,SOD含量明显下降,抗氧化酶活性降低,清除过氧化产物的能力也随之下降,提示高糖可以刺激肾小管上皮细胞损伤。糖肾平小、中、大剂量组小鼠血清MDA的含量下降,NO、SOD的含量升高,糖肾平能够通过改善DKD KK-Ay小鼠体内的抗氧化系统,减轻肾脏的损伤,减少尿蛋白的产生,从而延缓DKD病程的进展。糖肾平小、中、大剂量组Samd6和BMP7 mRNA及蛋白的表达量明显增加,TGF-β1mRNA及蛋白的表达量明显减少,并能够减少间充质细胞标志物α-SMA mRNA及蛋白的表达,增加上皮细胞标志物E-cadherin mRNA及蛋白的表达,且糖肾平的治疗效果呈剂量依赖关系,糖肾平大剂量组疗效最佳。由此可见,糖肾平对DKD KK-Ay小鼠的肾脏保护及逆转肾小管上皮细胞EMT作用,延缓了DKD的发展,为丰富和发展DKD“肾痿”学说提供了新的实验依据,至于糖肾平其他作用机制有待进一步研究证实。
表7 糖肾平对肾组织TGF-β1、Samd6、BMP7、α-SMA和E-cadherin蛋白表达的影响(±s,n=3)
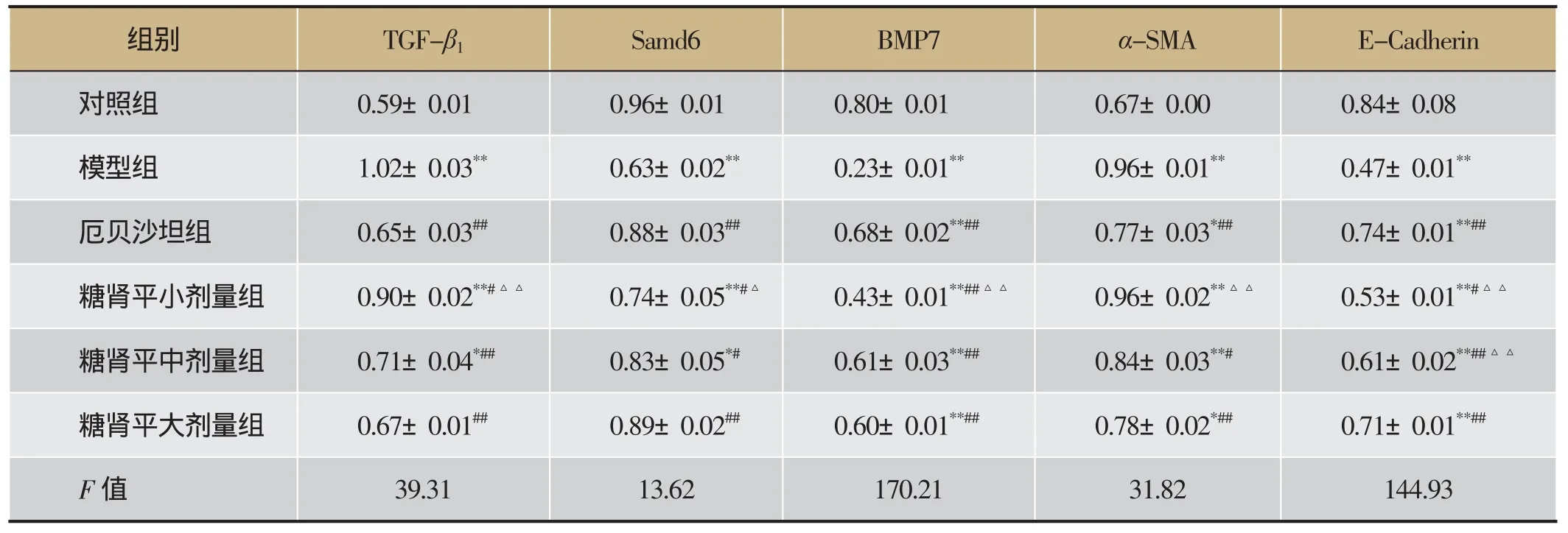
表7 糖肾平对肾组织TGF-β1、Samd6、BMP7、α-SMA和E-cadherin蛋白表达的影响(±s,n=3)
注:与正常对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与糖肾平大剂量组比较,△P<0.05,△△P<0.01。
组别TGF-β1Samd6 BMP7α-SMA E-Cadherin对照组0.59±0.01 0.96±0.01 0.80±0.01 0.67±0.00 0.84±0.08模型组1.02±0.03**0.63±0.02**0.23±0.01**0.96±0.01**0.47±0.01**厄贝沙坦组0.65±0.03##0.88±0.03##0.68±0.02**##0.77±0.03*##0.74±0.01**##糖肾平小剂量组0.90±0.02**#△△0.74±0.05**#△0.43±0.01**##△△0.96±0.02**△△0.53±0.01**#△△糖肾平中剂量组0.71±0.04*##0.83±0.05*#0.61±0.03**##0.84±0.03**#0.61±0.02**##△△糖肾平大剂量组0.67±0.01##0.89±0.02##0.60±0.01**##0.78±0.02*##0.71±0.01**##F值39.31 13.62 170.21 31.82 144.93

图13 糖肾平对各组肾组织TGF-β1、Samd6、BMP7、α-SMA和E-Cadherin蛋白表达的影响
1 Jia W, Tong N. Diabetes prevention and continuing health-care reform in China. Lancet Diabetes Endocrinol, 2015, 3(11): 840-842.
2 Farag Y M K, Al Wakeel J S. Diabetic nephropathy in the Arab Gulf countries. Nephron Clin Pract, 2011, 119(4): c317-c323.
3 赵宗江,李相辉.上皮-间质转化信号转导在肾间质纤维化中机制的研究进展.中国中西医结合肾病杂志, 2007, 8(2): 113-115.
4 Hills C E, Squires P E. TGF-β1-induced epithelial-to-mesenchymal transition and therapeutic intervention in diabetic nephropathy. Am J Nephrol, 2010, 31(1): 68-74.
5 Liu L, Wang Y, Yan R, et al. Oxymatrine inhibits renal tubular EMT induced by high glucose via upregulation of SnoN and inhibition of TGF-β1/Smad signaling pathway. PLoS One, 2016, 11(3): e0151986.
6 赵宗江,豆小妮,张新雪.糖尿病肾病“肾痿”假说探讨.中医杂志, 2011, 52(S1): 8-10.
7 赵敬,王颖超,赵宗江,等.糖肾平通过TGF-β1-Smad2/3-ILK信号通路干预高糖+LPS诱导足细胞上皮间质转分化的分子机制研究.中国中西医结合肾病杂志, 2014, 15(5): 392-396.
8 王颖超,赵宗江,赵敬,等.糖肾平对糖尿病肾病大鼠足细胞nephrin与CD2AP蛋白及其mRNA表达的影响.中国中西医结合肾病杂志, 2014, 15(2): 107-109.
9 乌格敦其其格,赵宗江,蒋玉凤,等.糖肾平胶囊对STZ诱导糖尿病肾病大鼠肾脏保护及其对TGF-β1/p38MAPK信号转导通路的影响.中华中医药杂志, 2012, 26(4): 1092-1097.
10 Bazhan N M, Makarova E N. The effect of the "yellow" mutation at the mouse agouti locus on the hormonal profile of pregnancy and lactation. Ross Fiziol Zh Im I M Sechenova, 2009, 95(11): 1254-1257.
11 周静鑫,艾志敏,孙文,等.三七总皂苷对糖尿病肾病小鼠足细胞保护作用的机制研究.中华中医药杂志, 2014, 29(5): 1316-1321.
12 He J, Xu Y, Koya D, et al. Role of endothelial-to-mesenchymal transition in renal fibrosis of chronic kidney disease. Clin Exp Nephrol, 2013, 17(4): 488-497.
13 Upton P D, Davies R J, Tajsic T, et al. Transforming growth factor-β1 represses bone morphogenetic protein-mediated Smad signaling in pulmonary artery smooth muscle cells via Smad3. Am J Respir Cell Mol Biol, 2013, 49(6): 1135-1145.
14 Rodrigues-Diez R, Rodrigues-Diez R R, Lavoz C, et al. Gremlin activates the Smad pathway linked to epithelial mesenchymal trans differentiation in cultured tubular epithelial cells. Biomed Res Int, 2014, 2014(2): 802841.
15 Mccormack N, Molloy E L, O’Dea S. Bone morphogenetic proteins enhance an epithelial-mesenchymal transition in normal airway epithelial cells during restitution of a disrupted epithelium. Respir Res, 2013, 14(1): 36.
16 王之琳,赵宗江.赵宗江教授治疗糖尿病肾病的学术思想及临床经验撷英.世界科学技术-中医药现代化, 2015, 17(10): 2162-2166.
17 Gomes I B, Porto M L, Santos M C L, et al. Renoprotective, antioxidative and anti-apoptotic effects of oral low-dose quercetin in the C57BL/6J model of diabetic nephropathy. Lipids Health Dis, 2014, 13(1): 1-10.
Renoprotective Effects ofTangshenpingon TGF-β1/ Samd6 / BMP7 Signaling Pathway in KK-Ay Mice with Diabetic Kidney Disease
Wu Amin, Zhao Zongjiang, Zhang Xinxue, Yang Meijuan, Yang Guannan, Miao Yonghui, Xu Changjun, Huang Yawei
(School of Basic Medical Science, Beijing University of Chinese Medicine, Beijing 100029, China)
This study aimed to explore the renoprotective effects of Tangshenping on TGF-β1/ Samd6 / BMP7 signaling pathway in KK-Ay mice with diabetic kidney disease (DKD). Ten female C57BL/6J mice were made up for the control group. Sixty female 10-week-old KK-Ay mice were used to establish the animal model of diabetic kidney disease with 10-week special food intake. Mice were randomly divided into the model group, the irbesartan group and the Tangshenping low-, medium- and high-dose groups depending on their body weight and blood glucose levels. The mice of the irbesartan group and Tangshenping low-, medium- and high-dose groups were intragastrically administered with irbesartan and Tangshenping, respectively, while the mice of the control group and the model group were treated with deionized water with the equal volume. 24 h urine protein quantification and body weight were tested every 4 weeks. At the end of the 26thweek, all the mice were sacrificed and the biochemical indicators, such as serum BUN, SCR, TG, MDA, SOD and NO were measured; while HE staining and Mallory staining were used to observe the pathological morphology of the kidney tissues, and in situ hybridization, immunohistochemistry and western blot to detect TGF-β1, Samd6, BMP7,α-SMA, E-cadherin mRNA and protein expressions in the renal tissues. As a result, compared with the model group, it was found that the body weight, the ratio of kidney weight to body weight, and 24 h albuminuria in all the treatment groups were reduced, and significant differences showed between Tangshenping medium- and high-dose groups (P < 0.01); renal pathological damage was improved, the contents of FBG, serum BUN, Scr, TG and MDA were decreased significantly (P < 0.01), while serum NO and SOD increased (P < 0.01); the protein and mRNA expressions of Samd6, BMP7 and E-cadherin were enhanced, while the expressions of TGF-β1andα-SMA attenuated. These changes were especially obvious in the Tangshenping high-dose group (P < 0.01). Moreover, the therapeutic effect of Tangshenping was dose dependent. In conclusion, it was demonstrated that Tangshenping protected and reversed the epithelial-mesenchymal transdifferentiation of renal tubular epithelial cells in DKD KK-Ay mice, which may be achieved via a reduction in oxidative stress and the regulation of TGF-β1/Samd6/BMP7 signaling pathway. This study provided new experimental evidence for the theory of "kidney impotence" in DKD.
Diabetic kidney disease, Tangshenping, consumptive kidney disease, KK-Ay mice, TGF-β1/ Samd6 /BMP7 signaling pathway, epithelial-mesenchymal transdifferentiation of renal tubular epithelial cells
10.11842/wst.2016.08.018
R2-031
A
(责任编辑:朱黎婷,责任译审:朱黎婷)
2016-04-28
修回日期:2016-06-02
* 国家自然科学基金委面上项目(81373831):基于“肾痿”组方的糖肾平干预糖尿病肾病肾小管上皮细胞转分化的分子机制研究,负责人:赵宗江。
** 通讯作者:赵宗江,本刊编委,教授,博士生导师,主要研究方向:中医药防治糖尿病肾病的机制研究。

