烟草种子油的毒理学评价
苏 彬,傅 泳,侯小东,张超英,梁 惠,*(. 青 岛大学公共卫生学院,山东 青岛 660;. 中国农业科学院烟草研究所,山东 青岛 6600)
烟草种子油的毒理学评价
苏 彬1,傅 泳1,侯小东2,张超英1,梁 惠1,*
(1. 青 岛大学公共卫生学院,山东 青岛 266021;2. 中国农业科学院烟草研究所,山东 青岛 266100)
【摘要】目的: 研究烟草种子油的毒理学安全性。方法:参照卫生部《保健食品检验与评价技术规范》,采用急性经口毒性试验,检测烟草种子油有无急性毒性作用;采用Ames试验、小鼠骨髓细胞微核试验和小鼠骨髓细胞染色体畸变试验3项遗传毒性试验,检测烟草种子油有无致突变作用;采用30 d喂养试验检测烟草种子油亚慢性毒性。结果:小鼠14 d内未见中毒和死亡现象,即烟草种子油对小鼠的半数致死剂量(LD50)>21 500 mg/kg;Ames试验中烟草种子油各剂量组回变菌落数均未超过自发回变菌落数2倍,亦无剂量-效应关系,4株试验菌株,在加与不加S9时,均未呈现阳性结果;小鼠骨髓细胞微核试验中烟草种子油各剂量组小鼠的微核率在正常范围内,与阴性对照组相比,差异均无统计学意义(P 均>0.05);小鼠骨髓细胞染色体畸变试验中阳性对照组染色体畸变率明显大于阴性对照组,烟草种子油各剂量组的染色体畸变率与阴性对照组间的差异均无统计学意义(P>0.05);30 d喂养结束后,未见试验动物有中毒及死亡状况,烟草种子油各剂量组的体质量、食物利用率、脏体比、血常规及血液生化指标与空白对照组相比均在正常范围内(P>0.05);病理组织学检查除烟草种子油高剂量组部分肝组织中见少量脂肪空泡外,各组大鼠主要脏器未见明显病理学改变。结论:在本实验条件下,烟草种子油未见明显的急性毒性,无致突变作用及亚慢性毒性作用。
【关键词】烟草种子油;安全性;急性经口毒性试验;遗传试验;致突变;30 d喂养试验
作者信息: 苏 彬,E-mail:948292544@qq.com。*通信作者,梁 惠,E-mail:qdlianghui@126.com
Toxicity evaluation of tobacco seed oil
SU Bin1,FU Yong1,HOU Xiaodong2,ZHANG Chaoying1,LIANG Hui1,*
(1. School of Public Health, Qingdao University, Qingdao 266021; 2. Tobacco Institute, Chinese Academy of Agricultural Sciences, Qingdao 266100, Shandong, China)
【ABSTRACT】OBJECTIVE: To evaluate the toxicity and safety of tobacco seed oil in mice. METHODS:Mice were orally exposed to tobacco seed oil for 14 and 30 days according to Care Food Inspection and Evaluation of Technical Specifications. Three genetic toxicology tests were used to evaluate mutagenic effects. In addition thirty day feeding test was conducted to detect sub-chronic toxicity. RESULTS:There was no evidence of toxicity or death in mice within 14 day,which indicated the median lethal dose (LD50) was more than 21 500 mg/kg. In the Ames test,the revertant colonies numbers in each dose group were two times less than the numbers of spontaneous revertant colonies,and no doseresponse relationship occurred. Four bacterial strains did not show positive results with or without S9 activation. In the mouse bone marrow cell micronucleus test,the rates from the exposed groups were similar to that of the negative control group (P>0.05). In the mouse bone marrow cell chromosome aberration test,the rates from the exposed groups were no significantly difference with the negative control group. After feeding for 30 days,there was no poisoning and death in the exposed mice. There was no significant difference from the control group in body weight,food utilization,organ-body ratios,and blood biochemical indexes. Histopathologic examination showed that fat vacuoles were observed in the liver tissue of high-dose group,but the other main organs of mice in the other groups had no pathological changes. CONCLUSION:Tobacco seed oil was non-toxic and did not show potentially mutagenic effects and sub-chronic toxicity within the text d oses.
【KEY W ORDS】tobacco s eed o il;safety;acute t oxicity t est;genetic t oxicity t est;mutagenesis;30 d ays f eeding t est
烟草种子油从烟草种子中提取,其含油量为35.9%~42.0%,平均为39.4%,不同类型不同品种变异不大。烟草种子油中脂肪酸含量较高,主要饱和脂肪酸为棕榈酸、硬脂酸,不饱和脂肪酸为油酸、亚油酸、亚麻酸。不饱和脂肪酸含量77.1%~82.5%,亚油酸含量最高,平均为71.6%,是橄榄油的4~5倍。其主要成分不饱和脂肪酸是人体不能自身合成的,它们一方面可以促进胆固醇的代谢,降低血液中低密度脂蛋白胆固醇和血总胆固醇[1];另一方面可以软化血管,维持毛细血管的健康,从而预防和治疗高血压、动脉硬化等心脑血管疾病。因此对烟草种子油的急性毒性、遗传毒性等方面进行安全性评价,为后期烟草种子油的开发利用提供安全性保障至关重要。目前,关于烟草种子油的毒理学安全性评价鲜有报道,本实验根据中华人民共和国《保健食品检验与评价技术规范》,通过大鼠经口急性毒性试验、Ames试验、小鼠骨髓微核试验、小鼠骨髓细胞染色体畸变试验及30 d喂养试验[2-3],对其进行毒理学评价,为其以后的研究开发提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 受试物 烟草种子油由中国农业科学院烟草研究所提供,为淡黄色油状物,贮存于干燥、密封处。
1.1.2 实验动物与环境 昆明种小鼠120只,SD大鼠80 只(许可证号为SCXK鲁20130001),雌雄各半,饲料及动物均购自山东鲁抗医药集团有限公司。动物实验室条件为SPF级动物实验室,湿度40%~70%,温度20~24℃。在青岛大学医学院营养所饲养3 d 以适应环境。
1.1.3 试验菌株 组氨酸营养缺陷型鼠伤寒沙门氏菌TA97、TA98、TA100和TA102,经鉴定符合试验要求。
1.2 试验方法
1.2.1 小鼠急性经口毒性试验 采用霍恩氏法,选用健康昆明种小鼠20只,体质量20~25 g,按完全随机化的方法,将小鼠分为4组,每组5只,给予基础饲料、水,适应性喂养3 d,确定其为健康小鼠。通过预实验确定正式试验的剂量分别为2.15、4.64、10.00、21.50 g/kg。分别对各组小鼠进行灌胃,一次性给予受试物,并观察小鼠灌胃后的状况,连续观察14 d,记录中毒和死亡情况。
1.2.2 Ames试验 采用组氨酸营养缺陷型鼠伤寒沙门氏菌TA97、TA98、TA100和TA102共4个试验菌株。代谢活化系统为多氯联苯(polychlorodiphenyls, PCBs)诱导的大鼠肝匀浆S9液。试验设8、40、200、1 000、5 000 μg/皿5个剂量组,每个剂量组做3个平行皿,同时设空白对照(双蒸水)、二甲基亚砜(dimethyl s ulfoxide,DMSO)对照和阳性对照组(阳性对照物为敌克松,叠氮钠,2-氨基芴,1,8-二羟蒽醌)。称取样品1.25 g,用DMSO溶解并定容至25 mL,混匀,0.055 Mpa压力下灭菌20 min,4 ℃存放备用。临用前将以上溶液按1∶4依次用DMSO稀释成以下浓度:50 000 μg/mL(原液)、10 000、2 000、400、80 μg/mL。采用标准平皿渗入法,每个受试浓度做3个平行皿。在顶层琼脂中加入0.1 mL试验菌液、0.1 mL受试样品溶液(溶剂对照加入0.1 mL灭菌DMSO)和0.5 mL S9混合液(当需要代谢活化时),混匀后倒入底层培养基平板上。37 ℃培养48 h,计数每皿回变菌落数,重复2次。
1.2.3 小鼠骨髓细胞微核试验 选用体质量在25~30 g健康昆明种小鼠50只,随机分为5组,即生理盐水阴性对照组(10 g/kg),烟草种子油低、中、高剂量组(分别为2.5、5、10 g/kg)和环磷酰胺阳性对照组(40 mg/kg),每组雌雄各5只。采用30 h给予受试物法,即2次给受试物间隔24 h,第2次给受试物6 h后,颈椎脱臼处死动物,取股骨,用生理盐水冲洗骨髓腔,将悬液1 500 r/min,离心10 min后,制成细胞悬液涂片,自然干燥后放入甲醇中固定10 min,再放入Giemsa应用液中,染色5 min后,用蒸馏水冲洗晾干,写好标签,于阴凉干燥处保存后阅片。每只动物观察1 000个嗜多染红细胞,计算微核率。
1.2.4 小鼠骨髓细胞染色体畸变试验 选用体质量在25~30 g健康昆明种小鼠50只,动物分组及各组处理方法同微核试验,于处死动物前6 h按4 mg/kg注射秋水仙素,颈椎脱臼处死动物。制备标本,阅片。每只动物分析100个中期相细胞,每个剂量组不少于1 000个中期相细胞,观察染色体结构和数目的改变。
1.2.5 30 d喂养试验 选用健康SD大鼠80只,雌雄各半,按体质量随机分为4组,即空白对照组,烟草种子油低、中、高剂量组(分别为5、10、20 g/kg),每组雌雄各10只[4],每只大鼠单笼饲养,适应性喂养3 d后,采用饲喂给予受试物的方式,将烟草种子油掺入饲料中,搅拌机搅拌均匀,按体质量的10%折算,将受试物剂量按每100 g体质量摄入的量折算为饲料量,每只大鼠用苦味酸标记,每天观察进食及活动情况,每周称取体质量并记录食物摄入量。30 d后,将大鼠用7%水合氯醛麻醉,腹主动脉取血8~10 mL,取部分血样3 500 r/min离心10 min留取血清,测定血常规及血液生化指标;取完整肝脏、肾、脾、睾丸、卵巢及部分胃和小肠称取质量,分别切取1~2 mm3组织放入甲醛溶液中固定,制备肝脏、肾、脾、睾丸、卵巢、胃和小肠病理学切片,观察有无病变。
采用SPSS 17.0统计软件进行统计学分析,数据以表示,多组间比较采用方差分析,率的比较采用卡方检验,以α=0.05为检验水准。
2 结 果
2.1 急性经口毒性试验
灌胃后14 d,各剂量组的小鼠均无明显中毒症状及死亡表现,行为表现及进食情况均正常,根据霍恩氏法判断,LD50>21 500 mg/kg。按急性毒性分级标准,烟草种子油属无毒级。
2.2 遗传毒性试验
2.2.1 Ames试验 2次重复测试的实验结果见表1。受试样品各剂量组回变菌落数均未超过自发回变菌落数2倍,亦无剂量-效应关系,对鼠伤寒沙门氏菌TA97、TA98、TA100、TA102,在加与不加S9时,均未呈现阳性结果。
表1 烟草种子油对鼠伤寒沙门氏菌TA97、TA98、TA100、TA102回变菌落数的影响

表1 烟草种子油对鼠伤寒沙门氏菌TA97、TA98、TA100、TA102回变菌落数的影响
阳性对照:TA97、TA98、TA102不加S9为敌克松50 μg/皿;TA100 不加S9为叠氮钠2.5 μg/皿;TA97、TA98、TA100加S9为2-氨基芴10 μg/皿;TA102加S9为1,8-二羟蒽醌50 μg/皿.
组别 TA97 TA98 TA100 TA102 -S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9烟草种子油 5 000 μg/皿 125±11 137±12 33±3 38±4 143±10 148±11 251±22 246±22 1 000 μg/皿 133±12 129±14 30±3 36±4 137±15 133±14 247±26 254±24 200 μg/皿 119±9 134±11 36±5 34±2 135±13 140±10 263±23 249±22 40 μg/皿 126±13 119±9 40±4 35±3 148±11 139±12 256±21 260±24 8 μg/皿 141±14 133±11 35±4 29±4 151±13 142±16 245±20 252±25空白对照组 137±15 126±10 32±3 37±4 145±12 149±15 243±24 250±23溶剂对照组 128±12 135±11 37±2 41±4 138±13 145±14 253±20 259±19阳性对照组 1 310±152 1 585±220 1 067±96 1 454±124 2 270±204 1 638±201 1 995±243 1 423±152
2.2.2 小鼠骨髓细胞微核试验 小鼠骨髓细胞微核试验结果见表2。雌、雄小鼠阴性对照组微核率分别为2.1‰±0.1‰、2.0‰±1.0‰,阳性对照组微核率高达12.2‰±2.4‰、12.6‰±3.3‰,明显高于阴性对照组(P<0.05),烟草种子油各剂量组小鼠的微核率与阴性对照组相比,差异均无统计学意义(P>0.05)。
2.2.3 小鼠骨髓细胞染色体畸变试验 小鼠骨髓细胞染色体畸变试验结果见表3。阳性对照组染色体畸变率明显大于阴性对照组(P<0.05)。烟草种子油各剂量组的染色体畸变率与阴性对照组相比,差异均无统计学意义(P>0.05)。
表2 烟草种子油对小鼠骨髓嗜多染红细胞微核率的影响

表2 烟草种子油对小鼠骨髓嗜多染红细胞微核率的影响
与阴性对照组比较,*P<0.05.
组别 观察细胞数(个)微核细胞数(个) 微核率(‰)雄雌 雄 雌 雄 雌阴性对照组 5 000 5 000 27 23 2.1±0.1 2.0±1.0烟草种子油 10 g/kg 5 000 5 000 35 41 2.4±1.1 2.8±1.0 5 g/kg 5 000 5 000 32 31 2.2±1.3 2.2±0.8 2.5 g/kg 5 000 5 000 22 21 1.9±0.8 1.8±1.0阳性对照组 5 000 5 000 102 109 12.2±2.4*12.6±3.3*
表3 烟草种子油对小鼠骨髓细胞染色体畸变率影响

表3 烟草种子油对小鼠骨髓细胞染色体畸变率影响
c:染色体断裂;d:粉碎;e:环状染色体;f:易位;g:微小体. 与阴性对照组比较,*P<0.05.
组别 观察细胞数 多倍体畸变 染色体结构畸形改变 畸变细胞数 畸变率(‰) cdefg阴性对照组 1 000 0 2 0 0 0 1 3 3烟草种子油 2.5 g/kg 1 000 0 1 3 1 1 2 8 8 5 g/kg 1 000 0 1 2 1 0 1 5 5 10 g/kg 1 000 0 1 0 1 1 1 2 4阳性对照组 1 000 2 13 5 2 6 10 38 38*
2.3 30 d 喂养试验
2.3.1 一般状况 实验期间对照组和烟草种子油各剂量组大鼠生长及行为状态良好,各组大鼠均无中毒、死亡和其他异常症状。
2.3.2 烟草种子油对大鼠体质量及食物利用率的影响 烟草种子油各剂量组雌、雄大鼠每周的体质量与各自的对照组比较差异无统计学意义(P>0.05,具体数据略)。表明烟草种子油对大鼠每周的体质量无明显影响。
烟草种子油对大鼠食物利用率的影响结果见表4。烟草种子油各剂量组大鼠的增重、总进食量及食物利用率与同性别的对照组大鼠相比,差异均无统计学意义(P>0.05),从而表明其对大鼠的生长发育无明显影响。
2.3.3 烟草种子油对大鼠脏体比的影响 烟草种子油对大鼠脏体比的影响结果见表5。烟草种子油各剂量组大鼠的主要脏器(肝、肾、脾、睾丸)质量与对照组相比差异均无统计学意义(P>0.05),且均在正常范围之内。各剂量组大鼠主要脏器的脏体比与同性别对照组相比,差异均无统计学意义(P>0.05)。可认为烟草种子油喂养30 d后大鼠的脏器无明显改变。
2.3.4 烟草种子油对大鼠血常规指标的影响 烟草种子油对大鼠血常规指标的影响结果见表6和表7。烟草种子油喂养30 d后,各剂量组雌雄大鼠的血小板、红细胞计数、白细胞计数及血红蛋白均在正常值范围之内,且与对照组相比差异均无统计学意义(P>0.05)。说明烟草种子油对大鼠血常规指标无显著影响。
表4 烟草种子油对大鼠食物利用率的影响

表4 烟草种子油对大鼠食物利用率的影响
性别 组别 增重(g) 总进食量(g)食物利用率(%)雄 对照组 122.6±20.18 655.6±16.18 18.7±2.74烟草种子油 2.5 g/kg 112.6±18.74 653.8±30.97 17.1±2.12 5 g/kg 143.6±52.92 663.7±42.74 21.3±6.82 10 g/kg 144.3±36.49 672.9±35.51 21.4±4.42雌 对照组 120.6±21.91 633.5±31.46 18.9±2.58烟草种子油 2.5 g/kg 103.1±28.06 599.8±64.52 17.1±4.46 5 g/kg 105.4±35.55 607.9±85.29 16.9±4.84 10 g/kg 135.6±13.28 639.6±28.25 21.2±2.02
表5 烟草种子油对大鼠脏体比的影响

表5 烟草种子油对大鼠脏体比的影响
性别 组别 空腹体质量(g) 肝/体(%) 肾/体(%) 脾/体(%) 睾丸/体(%)雄 对照组 290.0±31.77 3.26±0.350 0.668±0.098 0.327±0.107 0.831±0.152烟草种子油 2.5 g/kg 282.0±24.97 3.54±0.306 0.761±0.067 0.392±0.153 0.901±0.089 5 g/kg 302.1±55.10 3.67±0.419 0.787±0.104 0.403±0.203 0.869±0.104 10 g/kg 329.7±53.19 3.49±0.424 0.713±0.079 0.369±0.081 0.852±0.231雌 对照组 254.5±25.67 3.92±0.161 0.734±0.087 0.402±0.202 -烟草种子油 2.5 g/kg 245.3±34.83 3.88±0.308 0.799±0.079 0.298±0.084 -5 g/kg 248.5±41.13 3.89±0.334 0.756±0.108 0.340±0.109 -10 g/kg 269.6±20.68 3.88±0.291 0.684±0.024 0.345±0.152 -
表6 烟草种子油对大鼠血常规指标的影响

表6 烟草种子油对大鼠血常规指标的影响
性别 组别 血小板 红细胞计数 白细胞计数 血红蛋白雄 对照组 653.8±211.1 8.12±0.47 14.54±6.16 149.8±7.5烟草种子油 2.5 g/kg 730.5±286.3 7.47±0.60 19.40±9.27 142.6±9.4 5 g/kg 872.2±194.5 8.05±0.85 17.09±10.32 143.3±14.4 10 g/kg 778.8±303.5 7.78±0.47 19.09±7.34 145.1±11.4雌 对照组 871.9±166.4 7.24±0.36 15.17±9.92 135.9±7.82烟草种子油 2.5 g/kg 957.9±160.5 7.58±0.66 12.10±6.86 144.0±9.84 5 g/kg 869.4±153.7 7.92±0.74 12.08±2.74 148.1±16.7 10 g/kg 846.1±328.2 7.45±0.47 11.97±4.71 140.7±7.71
表7 烟草种子油对大鼠白细胞分类的影响
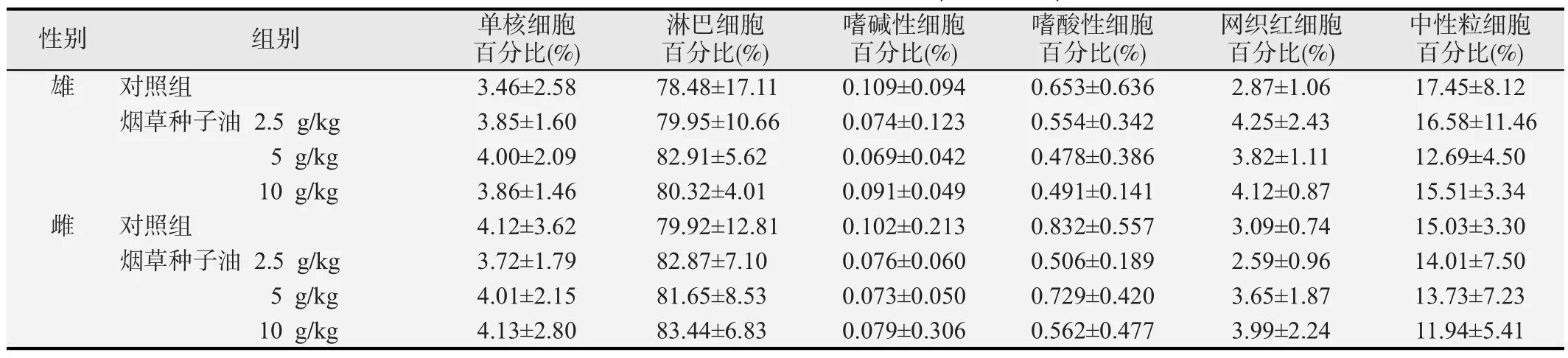
表7 烟草种子油对大鼠白细胞分类的影响
性别 组别 单核细胞百分比(%)淋巴细胞百分比(%)嗜碱性细胞百分比(%)嗜酸性细胞百分比(%)网织红细胞百分比(%)中性粒细胞百分比(%)雄 对照组 3.46±2.58 78.48±17.11 0.109±0.094 0.653±0.636 2.87±1.06 17.45±8.12烟草种子油 2.5 g/kg 3.85±1.60 79.95±10.66 0.074±0.123 0.554±0.342 4.25±2.43 16.58±11.46 5 g/kg 4.00±2.09 82.91±5.62 0.069±0.042 0.478±0.386 3.82±1.11 12.69±4.50 10 g/kg 3.86±1.46 80.32±4.01 0.091±0.049 0.491±0.141 4.12±0.87 15.51±3.34雌 对照组 4.12±3.62 79.92±12.81 0.102±0.213 0.832±0.557 3.09±0.74 15.03±3.30烟草种子油 2.5 g/kg 3.72±1.79 82.87±7.10 0.076±0.060 0.506±0.189 2.59±0.96 14.01±7.50 5 g/kg 4.01±2.15 81.65±8.53 0.073±0.050 0.729±0.420 3.65±1.87 13.73±7.23 10 g/kg 4.13±2.80 83.44±6.83 0.079±0.306 0.562±0.477 3.99±2.24 11.94±5.41
2.3.5 烟草种子油对大鼠生化指标的影响 烟草种子油对大鼠生化指标的影响结果见表8和表9。烟草种子油喂养30 d后,各剂量组雌雄大鼠的总胆固醇、血糖、肌酐及尿素氮均在正常值范围之内,且与对照组相比无显著差异(P>0.05)。
2.3.6 病理学检查 各剂量组大鼠大体解剖肉眼观察各脏器未见明显异常,选择对高剂量组和对照组雌雄大鼠进行组织病理学检查。镜下检查,各剂量组与对照组的肝、肾、脾、胃、肠、卵巢、睾丸等组织结构较完整,细胞形态正常,界限清晰,未见充血及炎性浸润等明显病变,极少数大鼠出现轻微病理改变,但这些病理改变均无组间特异性[5-6],可能为试验动物在试验过程中自发产生或其他非试验因素所致,高剂量组有4只大鼠(雄性3只,雌性1只)肝组织中可见轻度脂肪空泡。结果表明烟草种子油对大鼠肝、肾、脾、胃、肠、卵巢、睾丸等脏器没有明显毒性,可能具有一定的致肝脏脂肪变性作用。
表8 烟草种子油对大鼠生化指标的影响

表8 烟草种子油对大鼠生化指标的影响
性别 组别 甘油三酯 总胆固醇 血糖 肌酐 尿素雄 对照组 0.59±0.19 2.05±0.44 7.21±1.07 40.2±4.87 5.04±1.05烟草种子油 2.5 g/kg 0.30±0.50 1.81±0.30 7.19±2.58 40.6±4.03 5.20±1.29 5 g/kg 0.38±0.10 1.79±0.28 7.34±1.97 40.1±6.89 5.70±1.86 10 g/kg 0.34±0.07 1.85±0.36 6.32±2.19 38.4±4.19 4.81±0.79雌 对照组 0.51±0.50 2.15±0.27 7.32±2.51 36.7±3.16 7.22±1.81烟草种子油 2.5 g/kg 0.44±0.29 1.94±0.36 7.90±1.75 41.7±6.88 6.35±1.48 5 g/kg 0.49±0.40 2.06±0.32 7.74±2.52 41.2±6.78 6.76±1.52 10 g/kg 0.49±0.37 1.99±0.43 7.12±1.89 43.1±9.16 5.71±1.21
表9 烟草种子油对大鼠生化指标的影响

表9 烟草种子油对大鼠生化指标的影响
性别 组别 总蛋白(TP) 白蛋白(ALB) 谷草转氨酶(AST) 谷丙转氨酶(ALT)雄 对照组 61.4±3.17 26.6±1.59 160.3±12.2 73.0±13.4烟草种子油 2.5 g/kg 67.7±5.67 27.6±1.26 154.3±10.8 70.0±10.5 5 g/kg 69.1±8.67 27.7±1.67 138.0±13.8 60.2±10.2 10 g/kg 65.4±4.17 27.0±1.53 128.7±12.1 64.7±17.8雌 对照组 62.5±2.73 38.6±2.82 129.0±14.2 67.1±19.9烟草种子油 2.5 g/kg 64.5±2.41 32.7±10.1 108.2±14.8 53.8±13.6 5 g/kg 63.2±6.91 29.3±2.66 102.7±10.8 59.0±11.7 10 g/kg 65.1±4.02 35.1±11.3 101.5±14.4 54.0±14.6
3 讨 论
随着保健品的开发,油料作物中的不饱和脂肪酸、黄酮等物质越来越受到人们的关注,新型高附加值的产品如“橄榄油胶囊”、“葡萄籽油胶囊”等逐渐被开发,随之而来的安全性问题亦成为产品销售和推广的主要阻碍。文冠果籽含油量为55%~65%,其中油酸30%、亚油酸为42.9%,具有预防和治疗高血压、血管硬化等心血管病的效果,在对文冠果籽油的毒理学评价中明确其无明显毒作用[7-8];辣木籽油含有高达80%以上的不饱和脂肪酸,其中油酸含量在62%~75%[9-10],食用辣木籽油可以护肝[11]、预防肝硬化[12]、抗氧化[13]、抗胃溃疡、降血糖等,段琼芬等[14]在对其进行安全性毒理学评价时指出其是安全无毒的可食用油脂;共轭亚油酸因双键的共轭效应,而具有抗癌、抗动脉粥样硬化、增强机体免疫力等多重生理功能,目前已应用于食品添加剂和医药领域。不少研究在对其进行安全毒理学评价时指出,共轭亚油酸是一种安全的食用油脂,可作为食用级油脂应用在食品、添加剂、医药等行业[15-19]。
本文中烟草种子油成分主要为不饱和脂肪酸,其中亚油酸含量较高,约为71.6%,其可能有不饱和脂肪酸的生物活性。目前国内较烟草种子油的活性研究较少,且在其毒性方面鲜有报道,因此本研究为其实际应用开发提供相关依据。
急性毒性试验通常是指经口一次性给予或24 h内多次给予受试物后,在短时间内动物所产生的毒性反应及死亡情况,是认识和研究药物对机体毒性反应的第一步。本实验采用霍恩氏法,所得LD50>21 500 mg/kg,按急性毒性分级标准[20],烟草种子油属无毒级。这一结果为进一步设计相关毒性试验提供材料,可为研发价值的早期调研提供重要信息。
鼠伤寒沙门氏菌/哺乳动物微粒体酶试验(Ames试验)结果显示,受试样品各剂量组回变菌落数均未超过自发回变菌落数2倍,亦无剂量-效应关系,鼠伤寒沙门氏菌TA97、TA98、TA100、TA102共4株试验菌株,在加与不加S9液时,均未呈现遗传毒性。
小鼠骨髓细胞微核试验及染色体畸变试验,结果雌雄小鼠烟草种子油高、中、低剂量组的微核率均显著低于阳性对照组(P<0.05),阳性对照组微核率明显高于阴性对照组,差异有统计学意义(P<0.05)。小鼠骨髓细胞染色体畸变试验显示,雌雄小鼠烟草种子油高、中、低剂量组的染色体畸变率均低于阳性对照组,差异具有显著性(P<0.05),阳性对照组细胞畸变率明显高于阴性对照组,经统计分析,差异有统计学意义(P< 0.05)。以上结果表明在本实验条件下,烟草种子油对小鼠骨髓细胞无抑制作用和遗传毒性。
30 d喂养试验中,大鼠连续30 d喂饲不同剂量的烟草种子油,各剂量组动物生长、发育状况良好,无中毒及死亡现象;各剂量组雌雄大鼠体质量、增重、食物利用率等均无不良影响,表明烟草种子油对大鼠的正常生长发育和食物吸收代谢等无明显影响。各剂量组的血常规、生化指标及动物脏体比均在正常范围之内,与同性别的对照组相比无显著性差异;各剂量组大鼠主要脏器解剖后除肝脏见少量脂肪空泡外未见明显异常,各组织病理学观察未见非可逆性病理变化。综上所述,烟草种子油30 d喂养试验结果表明其对大鼠生长发育、代谢无不良影响;对大鼠增重、进食量、食物利用率、血常规、血生化、脏体比及主要脏器病理组织学均未见异常。
综上所述,烟草种子油在本实验剂量范围内未见明显的毒副作用,无致突变作用,安全性较高。
参考文献
[1] 李 斌,米树华. n-3和n-6多不饱和脂肪酸对血脂代谢影响及相关机制[J]. 中 国医药,2013,8(5):710-712.
[2] 陈新霞,徐德州,鹿奎奎,等. 大豆卵磷脂的安全性毒理学评价[J]. 江 苏预防医学,2013,24(4):58-60.
[3] 杨 平,姜忠丽,肖志刚,等. 糙米酵素红曲酒的急性和亚急性毒理学评价[J]. 食 品研究与开发,2013,34(20):71-73.
[4] Mota AS,de Lima AB,Albuquerque TLF,et al. Antinociceptive activity and toxicity evaluation of the fatty oil from plukenetia polyadenia Mull. Arg. (Euphorbiaceae)[J]. Molecules,2015,2 0(5):7925-7939.
[5] 冯文娟,许美艳,石 劢,等. 玉米胚芽油食用安全性评价[J]. 食 品与药品,2013,16(3):174-177.
[6] 刘晓风,刘 琳,王晓力,等. 罂粟籽油毒理学研究与安全性评价[J]. 中 国粮油学报,2014,29(5):65-69.
[7] 王力川. 文冠果化学成分·综合利用及栽培技术[J]. 安徽农业科学,2006,34(9):1850-1851.
[8] 范雪层,邓 红,张立云. 冷榨文冠果油食用安全性毒理学评价[J]. 中 国油脂,2009,34(5):32-37.
[9] Manzoor M,Anwar F,Iqbal T,et al. Physicochemical characterization of Moringa concanensis seeds and seed oil[J]. J Am Oil Chem Soc,2007,84(5):413-419.
[10] 段琼芬,刘 飞,罗金岳,等. 辣木籽油的超临界CO2萃取及其化学成分分析[J]. 中 国油脂,2010,35(2):76-79.
[11] AI-Said MS,Mothana RA,AI-Yahya MA,et al.Edible oils for liver protection:hepatoprotective potentiality of Moringa,oleifera seed oil against chemical-induced hepatitis in rats[J]. J Food Sci,2012,77(7):124-130.
[12] Alaaeldin AH.Ameliorative effects of Moringa oleifera Lam seed extract on liver fibrosis in rats[J]. Food Chem Toxicol,2010,48(1):345-355.
[13] Anwar F,Hussain AI,Iqbal S,et a1.Enhancement of the oxidative stability of some vegetable oils by blending with Moringa oleifera oil[J]. Food Chem,2007,103:1181-1191.
[14] 段琼芬,马李一,王有琼,等. 辣木籽油食用安全性毒理学评价[J]. 中 国油脂,2014,39(2):48-52
[15] Achenef MB,Arifah AK. Cytotoxic effects of conjugated linoleic acids on human breast cancer cells (MCF7)[J]. Acad J Cancer Res,2012,5(1):11-16.
[16] Seo JH,Moon HS,Kim IY,et al. PEGylated conjugated linoleic acid stimulation of apoptosis via a p53-mediated signaling pathway in MCF-7 breast cancer cells[J]. Eur J Pharm Biopharm,2008,70(2):621-626.
[17] 吴翼华,裘爱泳. 共轭亚油酸的生理功能(Ⅱ)[J]. 中国油脂,2001,26(6):45-47.
[18] 许浮萍,李燕羽,于殿宇,等. 共轭亚油酸功能油脂安全毒理学评价[J]. 中 国油脂,2013,38(9):36-40.
[19] Ha YL,Storkson JM,Pariza MW.Inhibition of benzo(a) pyrene-induced mouse forestomach neoplasia by conjugated dienoic derivatives of linoleic acid[J]. Cancer Res,1990,50(4):1097-1101.
[20] 中华人民共和国卫生部. 保健食品安全性毒理学评价程序和方法[S]. 北 京:中国标准出版社,2003:167-224.
基金项目:十二五农村领域国家科技计划课题(2012BAD33B01-2)
收稿日期:2015-09-01;
修订日期:2015-12-29
中图分类号:R114
文献标志码:A
文章编号:1004-616X(2016)01-0060-06
doi:1 0.3969/j.issn.1004-616x.2016.01.013

