预扩增qPCR方法检测少量小鼠早期胚胎细胞中DNA甲基化相关基因的表达
程 琳,孙平楠,3,谢庆东,2,周小玲,2,3,*(. 汕 头大学医学院干细胞P2实验室,广东 汕头 5504;2. 汕 头大学医学院生殖医学中心,广东 汕头 5504;3. 广 东省感染病与分子免疫病理重点实验室,广东 汕头 5504)
预扩增qPCR方法检测少量小鼠早期胚胎细胞中DNA甲基化相关基因的表达
程 琳1,2,3,孙平楠1,3,谢庆东1,2,周小玲1,2,3,*
(1. 汕 头大学医学院干细胞P2实验室,广东 汕头 515041;2. 汕 头大学医学院生殖医学中心,广东 汕头 515041;3. 广 东省感染病与分子免疫病理重点实验室,广东 汕头 515041)
【摘要】目的: 比较3种实时定量PCR(qPCR)方法对少量小鼠早期胚胎细胞中甲基化相关基因表达水平的检测效果,以期获得适合日常检测的方法。方法:分别应用常规qPCR方法、基于等温预扩增的qPCR方法、基于PCR预扩增的qPCR方法3种方案对少量小鼠早期胚胎细胞样本中甲基化相关基因TET1、TET2、TET3、DNMT3A的mRNA表达进行检测。结果:3种方法的灵敏度由高到低依次为基于等温预扩增的qPCR方法、基于PCR预扩增qPCR方法、常规qPCR方法。前两种方法均能在合适的循环数下对少量小鼠胚胎细胞中的多个甲基化相关基因表达进行定量。而基于PCR预扩增的qPCR方法比基于等温预扩增的qPCR方法更经济,适合日常检测。因此,我们选择应用基于PCR预扩增的qPCR方法,检测了小鼠卵细胞以及卵细胞受精后22 h甲基化相关基因表达的变化,结果发现该过程中TET1表达量很低,不易检测到;TET2表达呈降低趋势;TET3和DNMT3A表达显著升高(P<0.01),与文献报道基本一致。结论:基于等温预扩增的qPCR方法检测少量细胞样品中甲基化相关基因的表达的灵敏度在3种qPCR方法中最高。而基于PCR预扩增的qPCR方法操作简单、灵敏度较高、成本相对低,适合少量细胞样本中多个相关基因表达的实时定量日常检测。
【关键词】预扩增;实时定量PCR;小鼠;早期胚胎细胞;甲基化相关基因
作者信息: 程 琳,E-mail:470751814@qq.com。*通信作者,周小玲,
Detection of expression of methylation-related genes in mouse early embryonic cells using pre-amplification-based real time quantitative PCR
CHENG Lin1,2,3,SUN Pingnan1,3,XIE Qingdong1,2,ZHOU Xiaoling1,2,3,*
(1. Stem Cell P2 Laboratory, Shantou University Medical College, Shantou 515041; 2. Reproductive Medicine Center, Shantou University Medical College, Shantou 515041; 3. Guangdong Provincial Key Laboratory of Infectious Diseases and Molecular Immunopathology, Shantou 515041, Guangdong, China)
【ABSTRACT】OBJECTIVE: To identify a proper qPCR method for examining expression of methylation-related genes in mouse early embryonic cells. METHEDS:Normal qPCR,isothermal pre-amplification-based qPCR,and PCR pre-amplification-based qPCR methods were applied in quantitative assay of methylation-related genes (TET1,TET2,TET3 and DNMT3A) in mouse early embryonic cells. RESULTS:The sensitivity of these three methods decreased from isothermal pre-amplification-based qPCR method,PCR pre-amplification-based qPCR method to normal qPCR method. The former two methods detected expression of methylation-related genes in a few mouse embryonic cells within a proper PCR cycle number but the PCR pre-amplification-based qPCR method has lower cost than isothermal pre-amplification-based qPCR method. Therefore,we used PCR pre-amplification-based qPCR method to examine methylation-related genes in mouse oocytes and early embryonic cells after 22 h fertilization. The results showed that the expression level of TET1 mRNA was very low and not detectable,the expression of TET2 decreased,and the expression of TET3 and DNMT3A significantly increased (P<0.01) in this process,which was consistent with reported results.
CONCLUSION:The sensitivity of isothermal pre-amplification-based qPCR method was the highest among the three qPCR methods. However,the PCR pre-amplification-based qPCR method is the most suitable one for examining multigene expression in a few cells in daily practice due to the simple procedure, relatively high sensitivity and lowexpenditure.
【KEY W ORDS】pre-amplification;real t ime q uantitative P CR;mouse;early e mbryonic c ell;methylation-related g enes
在哺乳动物合子以及早期胚胎细胞发育过程中,甲基化相关基因和其他早期发育相关的基因起到重要作用,且具有特定的时空表达谱,因此其表达变化情况成为研究中关注的重点[1-3]。行使甲基化功能的甲基转移酶主要包括DNA甲基转移酶1(DNA methyltransferase 1 ,DNMT1)、DNA甲基转移酶3A(DNMT3A)、DNA甲基化转移酶3B(DNMT3B)。DNMT1可催化一条链甲基化的DNA双链中的未甲基化链,使其完全甲基化;而DNMT3A、DNMT3B则催化未甲基化的DNA双链从头甲基化。DNA胞嘧啶甲基化后形成5-甲基胞嘧啶(5-mC)。行使去甲基化功能的酶类有Tet家族成员,包括甲基胞嘧啶双加氧酶-1( ten-eleven translocation methyl cytosine dioxygenase 1,TET1)、甲基胞嘧啶双加氧酶-2(TET2)、甲基胞嘧啶双加氧酶-3(TET3)。TET蛋白主要通过催化5-mC转化为5-羟甲基胞嘧啶(5-hmC),还能进一步氧化5-hmC生成一系列衍生物,最终形成无甲基化修饰的胞嘧啶,是DNA去甲基化过程中的一种重要的酶,对于维持干细胞的多能性有重要作用。
现阶段,由于在研究中获得的哺乳动物胚胎细胞的数量有限,应用常规实时定量PCR(quantitative realtime PCR,qPCR)对少量胚胎细胞中甲基化或发育相关基因表达进行定量检测往往未能检测到信号,或者即使检测到信号,qPCR循环数也过多,从而导致处理组与对照组之间比较时可信度并不高。此外,由于起始细胞量少、所含的总RNA量也少,因此反转录获得的cDNA量不能满足下游检测需要。这种情况下采用常规qPCR往往只能对1~2个基因同时进行检测(每个基因包括内参均还需要有重复组),从而无法同时对5~10个基因甚至更多的基因进行实时定量检测。
近年来,对于少量细胞样本甚至是单细胞样本的RNA深度测序技术有了很大的提高。有研究人员采用PCR预扩增或者基于Phi-29酶的等温预扩增技术从少量样本中预先扩增获得了足量的cDNA来完成后续测序工作[4-5]。PCR预扩增方法主要是在对少量样本进行反转录获得cDNA后进行少量循环(6~12个循环)的PCR预扩增以获得足量的相关基因表达产物进行后续定量检测[5];基于Phi-29酶的等温扩增技术是在对少量样本进行反转录获得cDNA后,对获得的cDNA加接头连接环化后,再用Phi-29酶对其进行等温线型扩增[4]。后者相对前者而言,由于能线性扩增较长片段的cDNA,故能够更加准确真实的反映少量细胞样品中各个基因的表达量[4]。然而,现阶段后者中用到的相关试剂价格较昂贵,这也限制了实际研究中对细胞数目有限的材料中多个目的基因的表达同时进行实时定量日常检测。
因此,我们针对少量哺乳动物早期胚胎细胞样本中与甲基化相关的多个基因(TET1、TET2、TET3、DNMT3A等)的定量检测,比较了常规qPCR方法、基于等温预扩增的qPCR方法和基于PCR预扩增的qPCR方法3种方案的检测结果,为今后相关研究工作的开展提供重要参考。
1 材料与方法
1.1 主要试剂
PMSG和HCG购自宁波三生药业有限公司。反转录试剂盒(ReverTra Ace qPCR RT Kit,FSQ-101)购自Toyobo公司。qPCR试剂盒(Quantifast SYBR Green PCR Kit)和纯化试剂盒(QIAquick PCR purification Kit)均购自Qiagen公司。PCR试剂盒(Premix Taq™ Hot Start Version,R028A)购自Takara公司。
经回顾性分析可知,引发胎儿先天性心脏病的独立危险因素与孕早期感冒、负性生活事件和生殖系统感染存在相关性,同时与居住环境有着直接关系,见表2。
1.2 实验动物
采用汕头大学医学院实验动物研究中心饲养培育的清洁级昆明品系小鼠,雌鼠为8~10周龄,雄鼠10~12周龄。
1.3 体外授精
处死雄鼠,取附睾置于含有0.3% BSA的TYH培养基中,将附睾剪碎,加入1 mL培养基,于37 ℃、CO2体积分数为5%的培养箱中上游5 min。上游后600 g离心5 min,弃上清,加入1.5 mL获能液(3.5% BSA)重悬精子后置于37 ℃、CO2体积分数为5%的培养箱获能1 h。600 g离心5 min,弃去部分培养基,用剩余培养基重悬精子制作精子液滴,按每滴50 μL,覆以甘油,置于37 ℃、CO2体积分数为5%的培养箱中。雌鼠皮下注射10 IU PMSG,48 h后腹腔注射10 IU HCG诱导超排。HCG注射12~16 h后取出输卵管,将输卵管置于含有0.3% BSA的TYH培养基中,镜下刺破壶腹部并挤压,使卵丘细胞浸在培养基中将其转入含有0.1%透明质酸酶的TYH中,洗涤卵细胞2次将卵母细胞移入受精液滴,37 ℃、CO2体积分数为5%的培养箱中培养22 h以获得早期胚胎细胞。
1.4 卵细胞、胚胎细胞的收集
分别收集30个卵细胞或30个早期胚胎细胞,用PBS洗涤2次,把洗涤后的细胞转移至装有20 μL细胞裂 解缓冲液(cells-to-cDNATMⅡ Kit,Ambion)的EP管中,75 ℃ ,5 m in,放置于冰上5 m in,加入1.5 μ L D Nase 1 ,短暂离心后,37 ℃,30 min,置于冰上10 min, 然后75 ℃加热5 min。
1.5 qPCR的3种方案
1.5.1 常规qPCR方法 用反转录试剂盒,将裂解后的产物反转录成cDNA。反应条件为:37 ℃、15 min;98 ℃、5 min。产物稀释10倍后进行qPCR。
1.5.2 基于等温预扩增的qPCR方法 具体步骤见参考文献[4]。简而言之,先将细胞裂解产物去除基因组DNA,反转录成cDNA,再将其进行平端连接,然后用phi-29酶对其进行扩增。最终产物纯化后稀释100倍进行qPCR。
1.5.3 基于PCR预扩增的qPCR方法 步骤见参考文献[5]。用反转录试剂盒,将裂解后的产物反转录成cDNA。反应条件为:37 ℃、15 min;98 ℃、5 min。用PCR试剂盒对反转录产物进行以下处理:Premix 12.5 μL,目的正、反向引物各1 μL,DNA模板10 μL,最后加水至25 μL。PCR反应条件为:98 ℃、5 min;98 ℃、10 s,55 ℃、30 s,72 ℃、1 min,10个循环;72 ℃、7 min扩增。然后用纯化试剂盒对上述RTPCR的产物进行纯化。获得的纯化产物稀释10倍后进行qPCR。
将以上3种不同方案的cDNA产物按照qPCR试剂盒进行反应。反应体系如下:SYBR(2×) 10 μL,目的正、反向引物各1 μL,cDNA模板8 μL,总量20 μL。PCR反应条件:95 ℃、5 min,95 ℃、10 s,60 ℃、30 s,共40个循环。引物序列为:TET1正向引物5´-CCAT TCTCACAAGGACATTCACA-3´,反向引物5´-GCAGG ACGTGGAGTTGTTCA-3´,跨内含子611 bp,扩增产物116 bp;TET2正向引物5´-GCCATTCTCAGGAGTCACT GC-3´,反向引物5´-ACTTCTCGATTGTCTTCTCTATTG AGG-3´,跨内含子1 700 bp,扩增产物120 bp。TET3正向引物5´-GGTCACAGCCTGCATGGACT-3´,反向引物5´-AGCGATTGTCTTCCTTGGTCAG-3´,跨内含子2 474 bp,扩增产物104 bp;DNMT3A正向引物5´-ATGT GGTTCGGAGATGGCAAG-3´,反向引物5´-AGATGGC TTTGCGGTACATGG-3´,跨内含子429 bp,扩增产物124 bp; RSP6(正向引物5´-AGGAGAGAAGGATATTCCTGG AC-3´,反向引物5´-GCTTCCTGACAACATACTG GC-3´)作为内参[6]。目的基因的表达水平与内参相比后采用2-ΔΔCT方法计算。实验进行3次重复。
1.6 琼脂糖凝胶电泳
1%的凝胶,电压至120 V,电泳30 min后,取出凝胶,在数码凝胶成像系统下照相记录电泳图谱。
1.7 统计学方法
小鼠卵细胞和早期胚胎细胞中甲基化相关基因的表达水平差异分析采用t检验进行统计学分析。
2 结 果
2.1 3种qPCR方案扩增的标准曲线图
采用3种qPCR方案分别对30个受精后22 h的小鼠早期胚胎细胞中甲基化和去甲基化相关的基因TET1、TET2、TET3、DNMT3A进行扩增获得扩增曲线(图1)和循环阈值(CT值 )(表1)。从扩增曲线以及CT值 来看,基于PCR预扩增的qPCR方法的扩增效果优于常规qPCR方法,更接近于基于等温预扩增的qPCR方法。

表1 3种qPCR方案扩增小鼠早期胚胎细胞中DNA甲基化相关基因的CT值
2.2 3种方案的扩增产物的琼脂糖凝胶电泳
分别将3种方案扩增的qPCR产物进行琼脂糖凝胶电泳(图2)。各方案的电泳图中扩增产物亮度与各方案在qPCR结果中呈现的灵敏度相一致,常规qPCR方法中TET1基因未扩增出来,TET2、TET3、DNMT3A和RSP6有扩增条带,但是比基于等温预扩增的qPCR方法和基于PCR预扩增的qPCR方法的条带明显要弱。就基因扩增效果而言,基于等温预扩增的qPCR方法>基于PCR预扩增的qPCR方法>常规qPCR方法,而就实验费用而言,基于PCR预扩增的qPCR方法要远低于基于等温预扩增的qPCR方法。因此,我们选择基于PCR预扩增的qPCR方法进行下一步实验。
2.3 基于PCR预扩增的qPCR方法定量检测小鼠卵细胞受精后TET1、TET2、TET3和DNMT3A的基因表达变化
我们采用基于PCR预扩增的qPCR方法对小鼠卵细胞及受精后22 h的早期胚胎中去甲基化基因TET1、TET2和TET3和甲基化基因DNMT3A的表达变化进行了快速定量检测。结果显示小鼠卵细胞中去甲基化基因TET2和TET3和甲基化基因DNMT3A相对于内参RSP6的表达量分别是0.02±0.00、3.30±0.16、0.25±0.02;受精后22 h的早期胚胎细胞中TET2和TET3和甲基化基因DNMT3A相对于内参RSP6的表达量分别是0.01± 0.00、4.30±0.35、1.90±0.23。TET1表达量太低未检测出(图3)。统计分析结果表明,小鼠卵细胞体外受精后22 h的过程中TET2表达水平略下降、TET3和DNMT3A在该过程中表达则显著增加(P<0.05)。获得的结果和变化趋势与Yan等[6]的深度测序结果、Iqbal等[3]以及Wossidlo等[7]报道的qPCR结果基本一致。
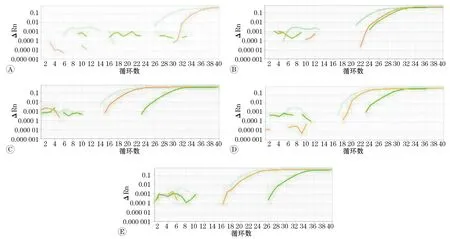
A:TET1的扩增曲线;B:TET2的扩增曲线;C:TET3的扩增曲线;D:DNMT3A的扩增曲线;E:内参RPS6的扩增曲线. 蓝色线代表基于等温预扩增的qPCR方法,橙色线代表基于PCR预扩增的qPCR方法,绿色线代表常规qPCR方法.图1 少量小鼠胚胎细胞样本分别采用3种qPCR方案的基因扩增曲线

M1、M2、M3分别代表常规qPCR方法、基于等温预扩增的qPCR方法和基于PCR预扩增的qPCR方法.图2 3种方案的qPCR扩增产物琼脂糖凝胶电泳图

图3 小鼠卵细胞和早期胚胎细胞TET1、TET2、TET3和DNMT3A的相对表达水平变化
3 讨 论
研究中基于少量细胞样本的基因表达水平检测,往往难以实现同时对多个基因的检测。近年发展起来的基于PCR预扩增或者基于等温预扩增的对少量细胞或单细胞基因表达检测的方法,为该问题的解决提供了有利的工具[4-5]。虽然后者的实验结果更准确,但因为受实验成本较高等因素影响,其在日常检测中的应用受到限制。我们研究发现,基于PCR预扩增的qPCR方法定量检测少量样本细胞中基因表达获得的qPCR扩增曲线与基于等温预扩增的qPCR方法更接近,而采用常规qPCR方法对于少量细胞样本中的基因进行检测获得的CT值 与其他两种方法相比偏高,不利于少量样本的准确定量检测。我们进一步采用建立的基于PCR预扩增的qPCR方法对小鼠卵细胞到卵细胞受精后22 h的早期胚胎过程中重编程相关基因TET1、TET2、TET3和DNMT3A的mRNA表达水平变化情况。结果显示在该过程中TET1表达量很低,不易检测到;TET2表达呈下降趋势;TET3和DNMT3A表达升高,这与文献报道基本一致[3,6-7]。TET1是胚胎发育后期的关键调控因子在合子和二细胞中表达量少,而TET3仅在合子和二细胞胚胎阶段高表达[8]。因此,与常规qPCR流程相比,基于PCR预扩增的qPCR方法更接近基于等温预扩增的qPCR方法,亦即更准确,同样的起始样本量可以同时检测更多的基因;与基于等温预扩增的qPCR方法相比,更易于在日常检测中使用。
参考文献
[1] Kohli RM,Zhang Y. TET enzymes,TDG and the dynamics of DNA demethylation[J]. Nature,2013,502(7472):472-479.
[2] Li E. Chromatin modification and epigenetic reprogramming in mammalian development[J]. Nat Rev Genet,2002,3(9):662-673.
[3] Iqbal K,Jin SG,Pfeifer GP,et al. Reprogramming of the paternal genome upon fertilization involves genome-wide oxidation of 5-methylcytosine[J]. Proc Natl Acad Sci USA,2011,108(9):3642-3647.
[4] Pan X,Durrett RE,Zhu H,et al. Two methods for full-length RNA sequencing for low quantities of cells and single cells[J]. Proc Natl Acad Sci USA,2013,110(2):594-599.
[5] Tang F,Barbacioru C,Nordman E,et al. RNA-Seq analysis to capture the transcriptome landscape of a single cell[J]. Nat Protoc,2010,5(3):516-535.
[6] Yan L,Yang M,Guo H,et al. Single-cell RNA-Seq profiling of human preimplantation embryos and embryonic stem cells[J]. Nat Struct Mol Biol,2013,20(9):1131-1139.
[7] Wossidlo M,Nakamura T,Lepikhov K,et al. 5-Hydroxymethylcytosine in the mammalian zygote is linked with epigenetic reprogramming[J]. Nat Commun,2011,2:241.
[8] Lee K,Hamm J,Whitworth K,et al. Dynamics of TET family expression in porcine preimplantation embryos is related to zygotic genome activation and required for the maintenance of NANOG[J]. Dev Biol,2014,386(1):86-95.
基金项目:国家自然科学基金(81570567,81571994);广东省自然科学基金(2014A030313483,2015A030313447);教育部留学回国人员科研启动基金(第49批);汕头大学医学院李嘉诚基金
收稿日期:2015-05-05;
修订日期:2015-12-24
中图分类号:Q781
文献标志码:A
文章编号:1004-616X(2016)01-0051-05
doi:1 0.3969/j.issn.1004-616x.2016.01.011

