广东潮汕贲门癌组织中GST-π 和P-gp的表达及其临床病理意义
陈广灿,洪良利,黄杰雄,谢澳斯,郭 丹,刘淑慧,*(. 汕 头大学医学院第一附属医院胃肠外科,广东 汕头 5504;.汕头大学医学院第一附属医院病理科,广东 汕头 5504;.汕头大学医学院病理教研室,广东 汕头 5504)
广东潮汕贲门癌组织中GST-π 和P-gp的表达及其临床病理意义
陈广灿1,洪良利2,黄杰雄2,谢澳斯1,郭 丹3,刘淑慧3,*
(1. 汕 头大学医学院第一附属医院胃肠外科,广东 汕头 515041;2.汕头大学医学院第一附属医院病理科,广东 汕头 515041;3.汕头大学医学院病理教研室,广东 汕头 515041)
【摘要】目的: 探讨广东潮汕贲门癌患者癌组织中谷胱甘肽-巯基-转移酶-π(GST-π)和P-糖蛋白(P-gp)的表达情况及二者与临床病理指标的关系。方法:采用免疫组织化学法检测87例贲门癌组织GST-π和P-gp的表达情况。根据表达情况,利用Youden index法绘制患者的年龄和肿瘤最长径ROC曲线,并将患者分成高表达组和低表达组比较其与临床病理指标的关系。结果:贲门癌组织中GST-π和P-gp表达阳性率分别为85.05%和93.1%。根据ROC曲线的结果确定年龄和肿瘤最长径分组的界值。贲门癌GST-π表达与脉管是否浸润有关,有脉管浸润者高表达率明显高于无脉管浸润者(P<0.01);P-gp的表达与年龄和组织学类型相关,患者年龄增大表达率增高(P<0.05),黏液腺癌的高表达率明显高于非黏液腺癌(P<0.05)。贲门癌GST-π的表达与P-gp的表达呈正相关(r=0.828,P<0.01)。结论:GST-π和P-gp在潮汕贲门癌组织中阳性表达率高,两者的表达呈正相关。GST-π高表达与脉管浸润相关,P-gp高表达与高龄患者和贲门黏液腺癌相关。
【关键词】贲门癌;谷胱甘肽-巯基-转移酶-π;P-糖蛋白;免疫组织化学
作者信息: 陈广灿,E-mail:515776718@qq.com。*通信作者,刘淑慧,E-mail:liushuhuistu@126.com
Expression of GST-π and P-gp in gastric cardia cancer and their clinical significance in the Chaoshan high risk area
CHEN Guangcan1,HONG Liangli2,HUANG Jiexiong2,XIE Aosi1,GUO Dan3,LIU Shuhui3,*
(1. Department of Gastrointestinal Surgery, the First Affiliated Hospital of Shantou University Medical College, Shantou 515041; 2. Department of Pathology, the First Affiliated Hospital of Shantou University Medical College, Shantou 515041; 3. Department of Pathology, Shantou University Medical College, Shantou 515041, Guangdong, China)
【ABSTRACT】OBJECTIVE: To study the expression of glutathione-s-transferase-π (GST-π) and P-glycoprotein (P-gp) in gastric cardia the cancer in the Chaoshan high risk area and their relationships with clinical pathological characteristics of gastric cardia cancer. METHODS:Immunohistochemical staining was used to detect the expression of GST-π and P-gp in 87 c ases o f g astric c ardia c ancer. T he c orrelations b etween G ST-π,P-gp e xpression a nd t he c linical c haracteristics o f g astric cardia cancer were analyzed. ROC curves of age and maximum tumor diameter were plotted. RESULTS:The positive expression rate of GST-π and P-gp in gastric cardia cancer were 85.05% and 93.1%,respectively. The cutoff points of grouping f or a ge a nd m aximum t umor d iameter d epended u pon t he r esults o f R OC c urves. T he e xpression o f G ST-π w as r elated to lymph-vascular space invasion. The expression rate of GST-π of patients with lymph-vascular space invasion was significantly higher than that without the invasion(P<0.05). Expression of P-gp was related to the age of patients and the histological type of gastric cardia cancer. Cancer tissues from elder patients and mucinous adenocarcinomas showed significantly higher rate of expression of P-gp (P<0.05). GST-π expression was positively correlated to P-gp expression (P<0.01). CONCLUSION:GST-π and P-gp expression were high in gastric cardia cancer in the Chaoshan area. Their expression was positively correlated. High GST-π expression was associated with lymph-vascular space invasion. High P-gp expression w as a ssociated w ith e lder p atients a nd m ucinous a denocarcinoma t issues.
【KEY WORDS】gastric cardia cancer;glutathione-s-transferase-π;P-glycoprotein;immunohistochemistry
广东潮汕地区是中国南方沿海的食管癌、贲门癌高发区,与远侧胃癌发病率下降不同,近年贲门癌的发病率呈上升趋势,且研究发现贲门癌的临床病理特征不同于远侧胃癌,应作为独立疾病研究[1-2]。潮汕高发区贲门癌患者就诊时多数已处于中晚期,主要治疗手段是手术治疗再辅以化疗和放疗,但是贲门癌化疗的总体效率不高,其中肿瘤细胞对抗肿瘤药物的多药耐药性(multi-drug resistance,MDR)是导致肿瘤化疗失败的重要因素[3]。研究认为多药耐药相关基因谷胱甘肽-巯基-转移酶-π(glutathione S-transferase-π,GST-π) 和P-糖蛋白(P-glucoprotein,P-gp)是介导多种肿瘤多药耐药的重要机制[4]。潮汕高发区贲门癌发病具有明显的家族聚集现象,高发区人群的个体特性可能影响贲门癌的化疗效果。高发区贲门癌多药耐药基因表达情况的相关研究较少,本研究采用免疫组织化学方法检测GST-π和P-gp在贲门癌组织的表达情况,并分析其临床病理意义,为探讨它们在高发区贲门癌化疗耐药中的作用提供依据。
1 资料与方法
1.1 临床资料
选取汕头大学医学院第一附属医院2007年9月-2014年10月收治进行外科手术治疗未曾进行化疗的贲门癌病例87例,将选取固定好的肿瘤标本行10%中性福尔马林液固定,常规脱水、透明、浸蜡、石蜡包埋,制成蜡块,4 μm连续组织切片,采用常规HE染色,组织病理学确诊为贲门癌。建立患者临床病理资料数据库,其中男性70例,女性17例,年龄在50~79岁,平均年龄63.2岁。
1.2 试剂和方法
1.2.1 试剂 GST-π、P-gP鼠抗人单克隆抗体、免疫组化二步法试剂盒和DAB显色剂均购自福州迈新试剂公司。
1.2.2 免疫组化染色 采用EnVision二步法对贲门癌组织切片进行免疫组化染色。微波修复,一抗浓缩液按1∶50稀释成工作液,4 ℃冰箱过夜,滴加辣根过氧化物酶标记的二抗(Ig-HRP),室温孵育30 min,DAB显色。用福州迈新试剂公司提供的阳性对照片作阳性对照;用PBS代替一抗作阴性对照。
1.3 结果判定
显微镜下观察,GST-π阳性表达定位于细胞浆和细胞核,P-gp阳性表达定位于细胞膜和细胞浆,阳性产物均为黄色或棕黄色颗粒。每张切片在200倍显微镜下随机选取10个视野,按阳性细胞所占比例及染色强度进行分级:阳性细胞数<10%、细胞无染色,为阴性(-);阳性细胞数≥10%~25%、细胞染色淡黄色,为弱阳性(+);阳性细胞数≥25%~75%、细胞染色黄色,为阳性(++);阳性细胞数≥75%、细胞染色为棕黄色或褐色,为强阳性(+++)。在统计学分析时,将染色结果分成两组进行统计,分别是低表达组(-和+)以及高表达组(++和+++)。
1.4 统计学方法
采用SPSS 16.0统计软件对所得数据进行分析。GST-π和P-gp表达与临床病理资料之间的关系分析采用χ2检验。GST-π和P-gp表达的相关性采用Spearman等级相关分析。绘制患者的年龄和肿瘤最长径ROC曲线(receiver operating characteristic curve)以确定按年龄和肿瘤最长径进行分组的界值。以α=0.05为检验水准。
2 结 果
2.1 年龄与肿瘤最长径ROC曲线绘制
利用尤登指数(Youden index)法根据患者GST-π和P-gp的表达情况,分别绘制患者的年龄和肿瘤最长径ROC曲线。GST-π的ROC曲线结果显示当患者年龄>66岁、肿瘤最长径>3 cm时,尤登指数分别是0.14和0.16为最大值;P-gp的ROC曲线结果显示当患者年龄>63岁、肿瘤最长径>4.5 cm时,尤登指数分别是0.22和0.14为最大值。利用这4个切点值分组进行年龄和肿瘤最长径的卡方检验。
2.2 GST-π和P-gp在贲门癌组织中的表达及与临床病理指标的相关性分析
GST-π和P-gp在贲门癌组织中分级+以上的标本分别为85.05%和93.1%,分级++以上的(高表达)分别为52.87%(46/87)和62.01%(54/87)。图1示贲门癌组织GST-π细胞浆核染色情况,图2示贲门癌组织P-gp细胞浆膜染色情况。贲门癌GST-π表达与脉管是否浸润有关,有脉管浸润者GST-π的高表达率明显高于无脉管浸润者(P=0.002),而与其他临床病理指标无显著相关关系(P>0.05)。P-gp的表达与年龄和组织学类型相关,随着患者年龄增大高表达率增加(P=0.049),黏液腺癌的高表达率明显高于非黏液腺癌(P=0.025),而与其他临床病理指标无显著相关 ( P>0.05),相关分析结果见表1~3。
2.3 贲门癌GST-π和P-gp表达的相关性分析
贲门癌组织中GST-π和P-gp均高表达的病例有32例,GST-π和P-gp均低表达的病例有19例,GST-π高表达P-gp低表达的病例有14例,GST-π低表达P-gp高表达的病例有22例。Spearman等级相关分析示GST-π 和P-gp表达具有相关性(r=0.828,P=0.000)。

A:阴性表达(-);B:弱阳性表达(+);C:阳性表达(++);D:强阳性表达(+++).图1 贲门癌组织中GST-π的表达(×400)

A:阴性表达(-);B:弱阳性表达(+);C:阳性表达(++);D:强阳性表达(+++).图2 贲门癌组织中P-gp的表达(×400)
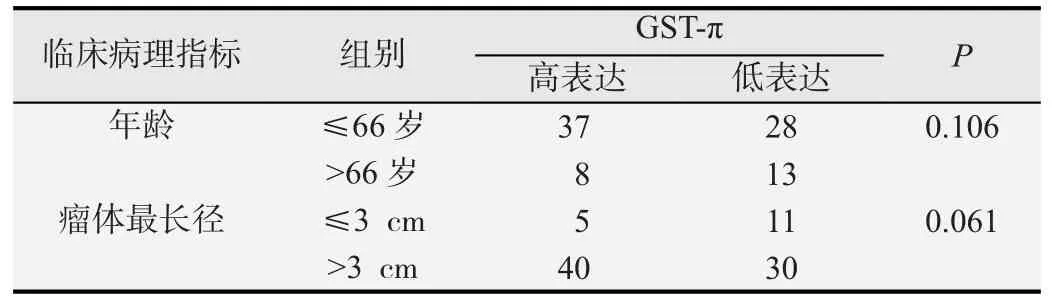
表1 年龄和肿瘤最长径与GST-π表达的关系

表2 年龄和肿瘤最长径与P-gp表达的关系
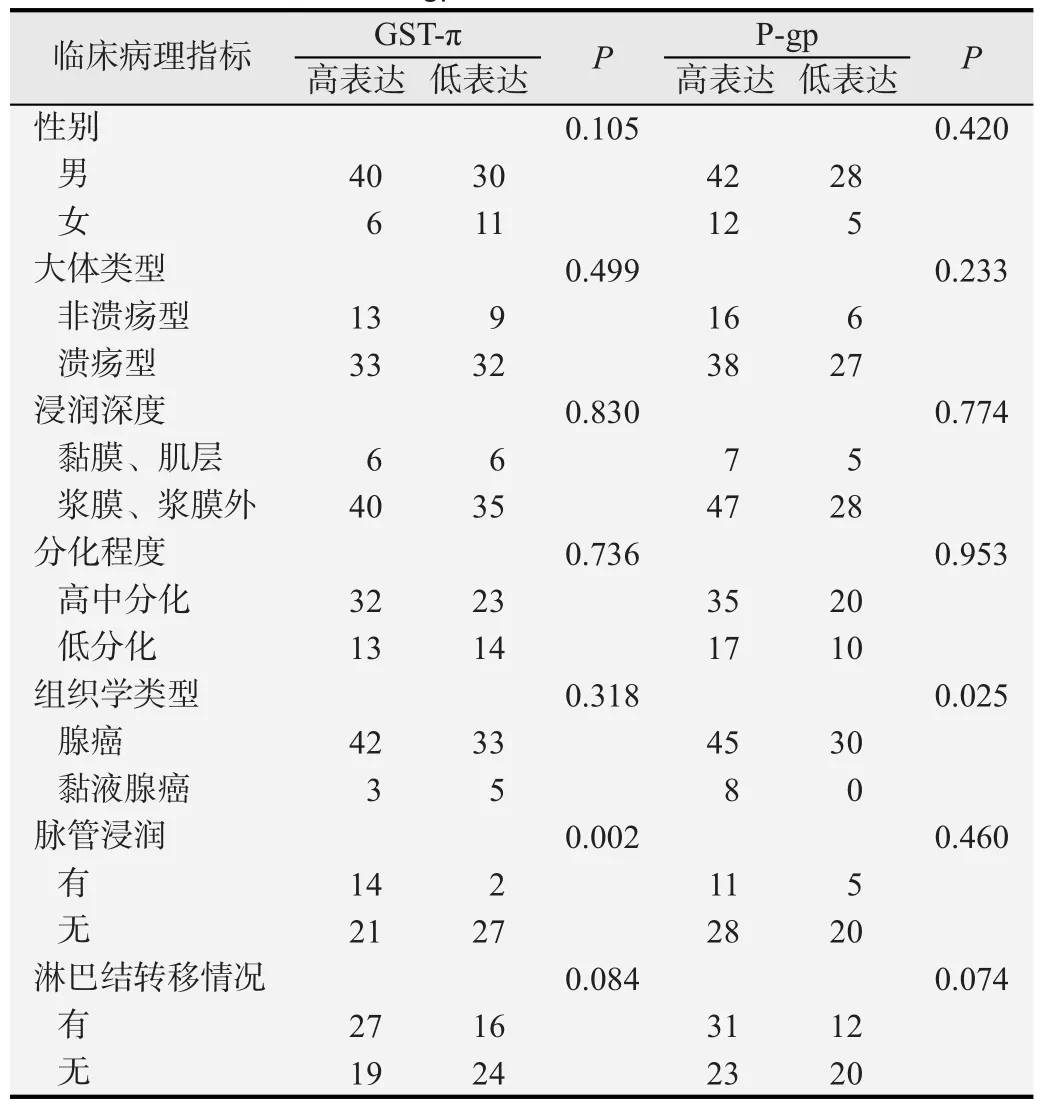
表3 GST-π和P-gp的表达与临床病理指标的关系
3 讨 论
贲门癌患者就诊时多数伴有浸润、转移等临床特征,因此在手术治疗的同时,进行有全身治疗作用的化学治疗也非常重要。但有相当一部分患者对化疗药物不敏感,研究认为90%的化疗失败和肿瘤的多药耐药有关[5]。肿瘤的多药耐药是指肿瘤细胞可耐受结构、功能和杀伤机制不同的多种药物的致死剂量[3]。研究发现 GST-π、P-gp在多种恶性肿瘤的耐药性上起重要作用。
GST-π是一种多功能的二聚体蛋白,与机体的解毒作用相关,通过促进药物与谷胱甘肽结合,增加药物的水溶性使其易于从细胞内排出,从而降低抗肿瘤药物对肿瘤细胞的杀伤作用,导致肿瘤细胞耐药[6-7]。GST-π阳性表达的肿瘤,其耐药的主要药物有顺铂、阿霉素、氟尿嘧啶、丝裂霉素等[3]。瘤细胞GST-π的含量可作为耐药性产生的一个检测指标。P-gp是最先被发现的与肿瘤多药耐药相关的三磷酸腺苷结合跨膜转运蛋白超家族成员[6]。P-gp是一种能量依赖性的跨膜药物输出泵,既可与抗肿瘤药物结合又可以与ATP结合,依赖ATP提供的能量将药物从胞内泵出胞外,降低化疗药物在细胞内的浓度,导致肿瘤细胞出现耐药[8]。 研究表明,P-gp阳性表达的肿瘤耐药的主要药物是长春花碱、长春新碱、蒽环类药物和紫杉类药物[7]。
研究表明肿瘤组织中P-gp与GST-π表达越高,患者化疗效果越差。关于P-gp和GST-π表达与贲门癌化疗效果关系的研究较少。为了研究P-gp和GST-π与贲门癌患者化疗效果的关系,并最终用于指导贲门癌患者的化疗方案的制订,有必要充分研究它们与贲门癌临床病理特征的关系,但是目前相关研究较少,且尚未有关于潮汕高发区贲门癌的研究报道。本研究结果显示贲门癌组织中GST-π和P-gp表达阳性率分别为85.05%和93.1%。较以往在贲门癌、胃癌组织中检测到的结果稍高[6,9-10]。Ye等[11-12]研究认为贲门癌GST-π的阳性表达率要高于其他部位的胃癌。本结果提示未经化学治疗的贲门癌组织中已存在GST-π和P-gp的高表达,与大多数癌组织的研究结果一致,但是癌组织高表达GST-π和P-gp的机制尚不清楚。本研究发现,GST-π的表达与脉管是否浸润有关,P-gp的表达与贲门癌患者的年龄和病理类型有关,与贲门癌其他病理学特征未发现相关性(P>0.05)。关于GST-π和P-gp与肿瘤临床病理特征的关系还存在争议。史宏灿等[13]认为贲门癌分化程度越低、临床分期越晚则GST-π表达愈强,伴淋巴结转移者P-gp阳性表达率明显高于无淋巴结转移者,认为P-gp表达不但反映出贲门癌的多药耐药状况,还可作为一种预测肿瘤生物学行为和评价肿瘤患者预后的指标。戴建华等[14]则认为GST-π、P-gp的阳性表达与贲门癌的临床病理特征无关。我们的结果提示GST-π和P-gp高表达的贲门癌组织更具有侵袭性、分化更差。本研究中相关分析结果显示,贲门癌中GST-π和P-gp的表达呈正相关,两者的表达具有较强的一致性,提示二者在贲门癌细胞的表达可能存在共同的调节机制,这一结果与其他报道基本一致[7-8,15]。研究认为肿瘤组织异常表达癌基因和抑癌基因如c-erbB-2,neu,P53,ras,INT2,HSTF1,bcl-2,c-fos和c-jun等可能参与促进P-gp和GST-π基因扩增,导致肿瘤组织同时高表达GST-π和P-gp[16]。
综上所述,GST-π和 P-gp在潮汕高发区贲门癌组织中呈高表达,且两者的表达具有相关性,GST-π高表达脉管浸润率高,P-gp高表达患者年龄较大,且P-gp在黏液腺癌表达更明显。今后可进一步研究GST-π 和P-gp表达与贲门癌患者耐药的关系。
参考文献
[1] 彭侠彪,陈万青,陈志峰,等. 中国贲门癌流行概况[J],中华普通外科学文献:电子版,2014,8(2):156-159.
[2] Ye YW,Fu H,Zhou Y,et al. Study on the different expression of molecular markers between cardiac cancer anddistalgastriccancer and their correlations with clinicopathological features[J]. Dig Surg,2009,26(5):384-391.
[3] 李 明,张成辉,张永喜. PgP、TP、GST-π、MRP在食管癌组织中的表达及与化疗的关系[J]. 世界华人消化杂志,2012,20(19):1768-1772.
[4] 张 超,单保恩. 子宫内膜癌多药耐药的研究现状[J]. 癌变·畸变·突变,2012,24(2):154-156.
[5] Loe DW,Deeley RG,Cole SP. Biology of the multidrug resistance-associated protein,MRP[J]. Eur J Cancer 1996,32A:945-957.
[6] Wang K,Li J,Zhen C,et al. Enhanced invasive and metastatic potential induced by transforming growth factor-beta1 might be correlated with glutathione-S-transferase-pi,cofilin and heat shock protein 27 in SGC-7901 gastric cancer cells[J]. Acta Biochim Biophys,2007,39(7):520-526.
[7] 凌斌勋,陈环球,徐新宇,等. GST-π和P-gp在胃癌中的表达及其临床意义[J]. 临床肿瘤学杂志,2010,15(6):523-525.
[8] 孔 易,郑纪宁. GST-π和P-gp在大肠癌中的表达及意义[J].承德医学院学报,2013,30(6):453-455.
[9] Shi H,Lu D,Shu Y,et al. Expression of multidrugresistance-relatedproteins P-glycoprotein,glutathione-S-transferases, topoisomerase-II and lungresistanceprotein in primary gastric cardiac adenocarcinoma[J]. Cancer Invest,2008,2 6(4):344-351.
[10] Oliver I,Lacueva J,Barber V,et al. p53 genetic abnormalities and P- glycoprotein expression in stump and primary gastric carcinomas[J]. Hepatogastroenterology, 2007,54(74):377- 381.
[11] 叶延伟,师英强,王春萌,等. 贲门癌与胃窦部癌的临床病理指标及免疫组化指标差异性分析[J]. 中华医学杂志,2009,89(14):962-966.
[12] Ye YW,Fu H,Zhou Y,et al. Study on the different expression of molecular markers between cardiac cancer and distal gastric cancer and their correlations with clinicopathological features[J]. Dig Surg,2009,26(5):384-391.
[13] 史宏灿,石维平,束余声,等. 多药耐药基因蛋白在贲门癌组织中的表达及其临床价值[J]. 世界华人消化杂志,2006,14(16):1587-1591.
[14] 戴建华,李国仁,刘晓峰,等. 食管贲门癌组织相关耐药基因表达水平及其临床意义[J]. 医学理论与实践,2005,2(2):137-139.
[15] 邱前程,黄杰雄,洪良利,等. 胃癌组织中GST-π、P-gP及癌基因C-erbB-2的表达及意义[J]. 汕头大学医学院学报,2007,20(1):42-44.
[16] Ma QJ,Zhang YC, Shi JS,et al. Clinical significance of P-glycoprotein and glutathione S-transferase π expression in gallbladder carcinoma[J]. Exp Ther Med,2014,7(3):635-639.
基金项目:广东省自然科学基金资助(2014A030310139)
收稿日期:2015-09-01;
修订日期:2015-12-21
中图分类号:R730.2
文献标志码:A
文章编号:1004-616X(2016)01-0036-05
doi:1 0.3969/j.issn.1004-616x.2016.01.008

