基于PBPK模型的大鼠体内镉分布的比较:联合暴露及单独暴露
蒋艳雪,贾宜静,晁思宏,曹红斌,*
1. 北京师范大学 中药资源保护与利用北京市重点实验室,北京 100082 2. 北京师范大学 地理科学学部,北京 100875
基于PBPK模型的大鼠体内镉分布的比较:联合暴露及单独暴露
蒋艳雪1,2,贾宜静1,2,晁思宏1,2,曹红斌1,2,*
1. 北京师范大学 中药资源保护与利用北京市重点实验室,北京 100082 2. 北京师范大学 地理科学学部,北京 100875
环境中同时存在着多种重金属元素,联合暴露与单独暴露时,重金属在体内的蓄积分布情况也可能有所差异。为探究重金属元素(汞、铬、砷、铅)对镉(Cd)在体内分布的影响,建立了大鼠在Cd暴露下的药代动力学(PBPK)模型,并进行了包括Cd在内5种重金属的联合毒性实验,比较了Cd单独给药与重金属混合物给药2种方式下大鼠肝脏、肾脏中的Cd浓度水平。结果表明,联合暴露高(HgCl23.67 mg·kg-1,NaAsO23.67 mg·kg-1,CdCl210.55 mg·kg-1,K2Cr2O76.40 mg·kg-1,Pb(OOCCH3)2·3H2O 133.33 mg·kg-1)、中(HgCl20.367 mg·kg-1,NaAsO20.367 mg·kg-1,CdCl21.055 mg·kg-1,K2Cr2O70.640 mg·kg-1,Pb(OOCCH3)2·3H2O 13.333 mg·kg-1)、低(HgCl20.0367 mg·kg-1,NaAsO20.0367 mg·kg-1,CdCl20.1055 mg·kg-1,K2Cr2O70.0640 mg·kg-1,Pb(OOCCH3)2·3H2O 1.3333 mg·kg-1)剂量组大鼠肝脏中Cd浓度分别为13.37、0.78和0.06 μg·g-1;肾脏中Cd浓度分别为14.41、1.64和0.15 μg·g-1。与对照组相比,暴露组中Cd浓度有显著升高,且不同剂量组之间均有显著性差异。同剂量Cd单独暴露的PBPK模拟结果显示,肝脏及肾脏中的Cd浓度水平落在联合毒性实验结果的浓度范围内,初步推断其他4种重金属的联合暴露并没有影响Cd在大鼠肾脏和肝脏中的浓度分布。
镉;重金属混合物;PBPK模型;联合毒性;体内分布
生理药物代谢动力学模型(Physiologically Based Pharmacokinetic Model, PBPK模型,在毒理学中一般称之为Physiologically Based Toxicokinetic Model, PBTK模型)是一种通过模拟药物或毒物在人类或其他动物体内的动力学过程、代谢过程,预测其在目标靶点有效浓度的工具[1-3]。PBPK模型可以用于描述单一或混合物质的药代/毒代动力学过程[4-5],目前被广泛应用于药物开发、有毒有害物质管理等[6-7]。混合物质的PBPK模型的研究对象多为有机物[8-11]。
有毒物质与疾病登记处联合机构(ATSDR)基于二元的证据权重方法,研究了铅(Pb)、镉(Cd)、铬(Cr)和砷(As)之间的两两交互作用[12]。但是,3种以上重金属复合暴露的毒性实验数据和流行病学调查数据则十分有限,且不同重金属在生物体内的半衰期相差太大,模型的基本形式和数学结构也不同,因此重金属类混合物质的PBPK模型尚未建立。
重金属混合物除了在毒性作用模式(mode of action)方面会相互影响外,在吸收、代谢、分布及排泄过程中也会相互影响。如,Yáez等[13]在Cd和As同时暴露的急性毒性试验中发现,As的存在会降低肝脏中Cd的浓度。Garcia等[14]发现,与Pb(300 mg·L-1)单独存在时相比,Cd(10 mg·L-1)的存在会减少血液中Pb的含量。在一项研究Pb、Cd对肾脏中金属硫蛋白表达影响的实验中发现,Pb和Cd在肾脏中的浓度不受彼此的影响,在血清中的浓度也不受彼此影响[15]。
本文针对重金属单独暴露与复合暴露产生的内暴露剂量存在差异的状况,建立重金属Cd在大鼠体内吸收、分布、代谢、排泄(absorption, distribution, metabolism and excretion, ADME)的PBPK模型(Cd-PBPK model),模拟Cd在大鼠不同器官中的分布。同时,进行含Cd重金属混合物的联合毒性实验,将实验大鼠肝脏、肾脏中Cd浓度与模型模拟结果比较,分析Cd及其他重金属在ADME过程中的相互影响。
1 材料与方法(Materials and methods)
1.1 PBPK模型建立方法
利用Matlab/Simulink建立生理药代动力学模型,并进行调试,用于模拟Cd在大鼠体内的代谢、分布过程。在利用一套实验数据进行参数优化之后,将另一组毒性实验数据输入已建立的模型进行验证。
1.1.1 模型结构
假设Cd及其代谢产物在大鼠体内的分布转运是血流限速过程,建立血流限速型PBPK模型。该模型满足以下假设:
1)Cd的透膜速度极快,其在各个器官的分布由血液进入该器官的血流速率决定,即镉进入到组织细胞中的速率远大于其在血管中的运输速率;
2)从各个器官中流出的血液中的Cd及其代谢产物的浓度已经与该器官组织细胞内液中的浓度达到了平衡。
整体模型和血流循环过程如图1所示。模型纳入了主要的靶器官——肝脏和肾脏,一共包括6个器官(组织)房室和2个血液室。
按照物质平衡原理,图1中肺和其他组织是非消除器官,镉在非消除器官中含量的变化速率可用微分方程式(1)表示:
(1)
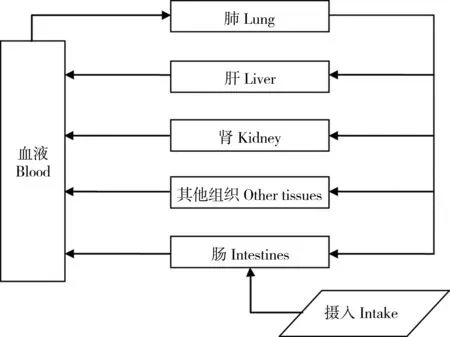
图1 生理药物代谢动力学模型(PBPK模型)模拟的镉的血流循环Fig. 1 Blood circulation of Cd simulated by Physiologically Based Pharmacokinetic Model (PBPK model)
其中,下标i指不同器官;V为器官体积(L);C为器官或组织中的Cd浓度(μmolL-1);t为模拟时间;Q为器官的血流量(L);CA为动脉血中镉浓度(μmolL-1);P为镉在器官i中的组织-血液分配系数。
图1中肝和肾是消除器官,镉在消除器官中含量的变化速率可用微分方程式(2)表示:
(2)
其中,Kout为排泄系数。
在血液室中,根据镉在血浆和血红细胞中的转移,列为2个微分方程,如式(3)和式(4)所示。
血浆:
(3)
血红细胞:
(4)
其中,下标plas和rbc分别指血浆和血红细胞;Qc为肺血流量(L);Ppr为镉从血浆进入血红细胞的渗透系数;Prp为镉从血红细胞进入血浆的渗透系数。
1.1.2 模型参数
模型中各器官的生理参数在表1中列出。大鼠的基本身体参数,如器官体积、心输出量、各器官血流分数等都来自文献[16]。Cd在各个组织器官中的分配系数来自参数优化,基于Cha等[17]的实验数据,使模型模拟结果最大限度地逼近实验结果,以确定参数最优取值。
由于Cd在体内的半衰期较长,达数年甚至数十年。因此,在模型模拟时,时间步长按照天来计算。
1.1.3 整体仿真模型建立
在Simulink仿真环境下,根据各个器官房室的微分方程,设计各个器官的子模型,且将其封装成为整体模型中的子模块。将各个基本模块根据整体模型和血流循环规律进行连接,并且配以产生并且存储系统时间的模块,使之成为完整的实时仿真模型。Simulink环境下建立的整体模型结构如图2所示。
1.2 实验方法与材料
1.2.1 实验方法
8周龄SD大鼠80只,雌、雄各半,购回后驯养一周使其适应实验室环境,平均体重为(127.8±2.2) g。根据实验设计随机分为4组,分别为:对照组(A),高剂量组(B),中剂量组(C),低剂量组(D)。每个剂量组共20只大鼠,雌、雄各10只,每5只饲养于一只笼中。将5种重金属药品混合,溶于经蒸汽灭菌的水中,配制后供不同实验组自由饮用,对照组饮用未添加重金属的灭菌水。由于实验规模所限,在进行实验动物的分组给药时,没有分出单独给药的组,即没有单一重金属的对照组。各组大鼠均自由摄取食物,室温为(25±1) ℃,室内湿度50%±10% RH。

图2 大鼠体内Cd的PBPK模型整体结构Fig. 2 Whole structure of Cd-PBPK model in rats
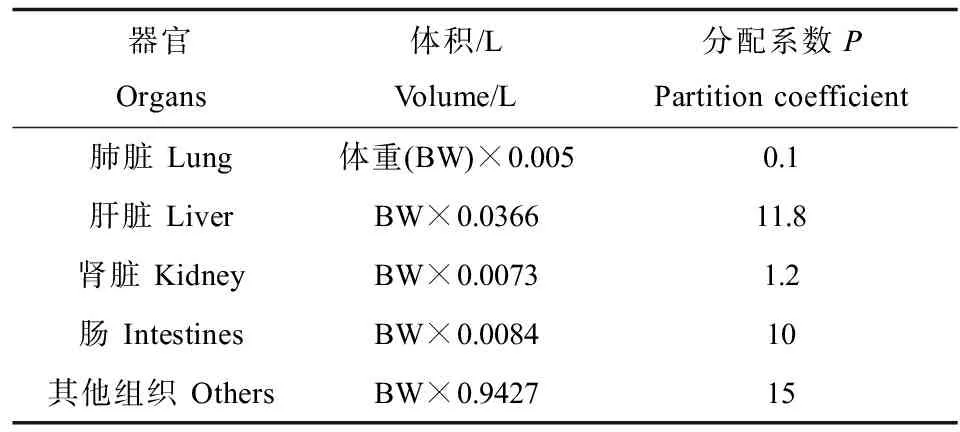
表1 大鼠体内镉PBPK模型的参数取值Table 1 Parameters values in Cd-PBPK model in rats
每天记录饮水量,每周称量体重一次,根据体重变化调整给药量,连续暴露3个月。
1.2.2 实验试剂及剂量
依据SD大鼠急性毒性实验结果,取HgCl2(Amresco公司,分析纯)、Cr2K2O7(Sigma公司,分析纯)、CdCl2(Alfa Aesar公司,分析纯)、NaAsO2(阿拉丁公司,分析纯)以及Pb(OOCCH3)2·3H2O(Alfa Aesar公司,分析纯)5种药品对大鼠半数致死剂量(LD50)的1/15,分别为HgCl23.67 mg·kg-1,NaAsO23.67 mg·kg-1,CdCl210.55 mg·kg-1,K2Cr2O76.40 mg·kg-1,以及Pb(OOCCH3)2·3H2O 133.33 mg·kg-1作为高剂量,充分混合后稀释10倍和100倍分别作为中剂量和低剂量,即各组间距为10倍。
1.2.3 器官重金属含量测定
大鼠处死后,将组织器官称重,立刻保存在-20 ℃冰箱,检测肝脏、肾脏中重金属含量(由天津海世达检测技术有限公司测定)。采用电感耦合等离子体质谱仪(ICP-MS)(安捷伦7500a,美国)检测。所用标准物质为冻干人尿铅标准物质(GBW09105e,中国疾病预防控制中心职业卫生与中毒控制所),冻干牛血铅、镉成份分析标准物质(GBW09140g,中国疾病预防控制中心职业卫生与中毒控制所)和质量控制物质冻干牛血汞(ZK021-2,中国疾病预防控制中心职业卫生与中毒控制所),国家标准物质猪肉(GBW08552,中国科学院上海原子核研究所),猪肝(GBW10015,中国地质科学院地球物理地球化学勘查研究所),牛肝(GBW(E)080193,解放军总医院临床基础学研究所)。
1.3 数据统计与分析
采用SPSS 22.0软件(IBM SPSS Inc.)进行方差齐性检验和单因素方差分析(One Way ANOVA)。若方差齐性,采用SNK检验(Student-Newman-Keuls法);若方差不齐,采用Dunnett’s T3检验。P < 0.05、P < 0.01表示差异显著。
2 结果(Results)
2.1 模型验证
根据建立的生理药代动力学模型,以Asagba等[18]的毒性实验为基础数据,进行模型的验证,结果如图3所示。
图3表明,在暴露1个月和暴露3个月时,肝脏和肾脏中Cd的模拟浓度与实验测得的浓度一致,模拟精度较好。上述建立的模型可用于模拟镉单独暴露时在大鼠体内的吸收、分布、代谢、排泄过程。
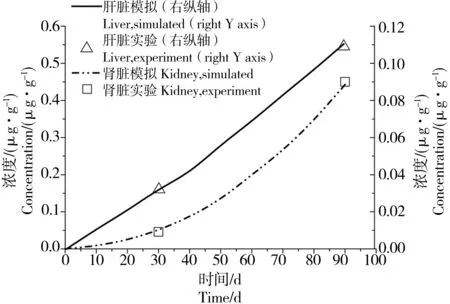
图3 单一Cd暴露的大鼠肝、肾Cd浓度PBPK模型模拟值与文献实验值的比较Fig. 3 Comparison between PBPK simulated and reported measured concentrations of Cd in liver and kidney of rat exposed to single Cd
2.2 5种重金属联合暴露时大鼠体内Cd的分布
重金属联合暴露毒性实验中,暴露3个月后,各个剂量组肾脏、肝脏中Cd的浓度结果如表2所示。可以看出,雌、雄大鼠肝脏及肾脏中Cd的浓度均随给药浓度的增加而增加。在肝脏和肾脏中Cd浓度均为雌性大鼠>雄性大鼠。对于雌、雄大鼠肝脏及肾脏中的Cd浓度,各剂量组与对照组间,以及各剂量组之间均有显著差异(P<0.01)。
2.3 PBPK模型模拟结果与毒性实验结果的比较
将重金属联合暴露实验结果(肝脏、肾脏中Cd的浓度)与利用Cd的PBPK模型模拟得到的Cd在不同器官中的浓度进行比较,分析在有其他重金属存在的情况下,Cd在不同器官中的分布是否会受到影响。结果表明,高、中、低剂量组的肝脏和肾脏中Cd浓度的模拟结果基本落在重金属联合暴露毒性实验样本点的浓度范围之内(图4)。
3 讨论(Discussion)
目前,大部分对重金属联合暴露的体内分布实验研究多为2~3种重金属,4种及以上的研究较少。Cobbina等[19]分析了4种重金属(NaAsO20.003 mg·kg-1,CdCl20.68 mg·kg-1,Pb(OOCCH3)20.34 mg·kg-1,HgCl21.01 mg·kg-1)连续暴露120 d的ICR小鼠的大脑、肝脏和肾脏中的重金属含量。结果表明,与Cd单独暴露相比,多种重金属联合暴露(Pb+Cd、Pb+Hg+Cd、Pb+Cd+As+Hg)并没有使大脑、肝脏和肾脏中的Cd浓度升高。Rai等[20]研究了As(NaAsO2,3.80 mg·kg-1)、Cd(CdCl2,0.98 mg·kg-1)、Pb(Pb(OOCCH3)2,2.22 mg·kg-1)对大鼠从孕期到产后大脑发育的联合毒性。结果表明,在As、Cd、Pb联合暴露与Cd单独暴露情境下,大脑皮层中Cd含量无显著差异。其研究所用的As、Cd、Pb剂量分别与本实验的高剂量组(3.67 mg·kg-1)、中剂量组(1.06 mg·kg-1)、低剂量组(1.33 mg·kg-1)接近。
Pandya等[21]在Cd和Pb联合毒性实验中发现,Pb、Cd联合暴露时大鼠体内肝的Cd含量较Cd单独暴露时显著下降,其实验剂量远低于本实验的低剂量组,暴露方式也不同,为腹腔注射方法;但Massó等[22]研究了饮水途径Cd和Pb联合暴露对围产期大鼠肝脏氧化损伤的影响,所用Cd、Pb剂量分别约为本实验中剂量组的2倍和6倍,结果表明肝脏中Cd含量在联合暴露时并无显著变化;Shukla和Chandra[23]研究了Cd、Pb复合暴露情境下大鼠体内各器官中重金属分布情况,Cd通过腹腔注射CdCl2
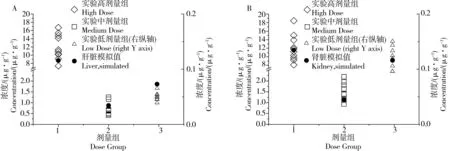
图4 雄性大鼠肝、肾Cd浓度的单一Cd暴露PBPK模拟值与重金属联合暴露实验值的比较(A肝脏,B肾脏)Fig. 4 Comparison of Cd concentration in liver (A) or kidney (B) of male rats between PBPK simulation of single Cd exposure and toxicity experiment of metal mixtures
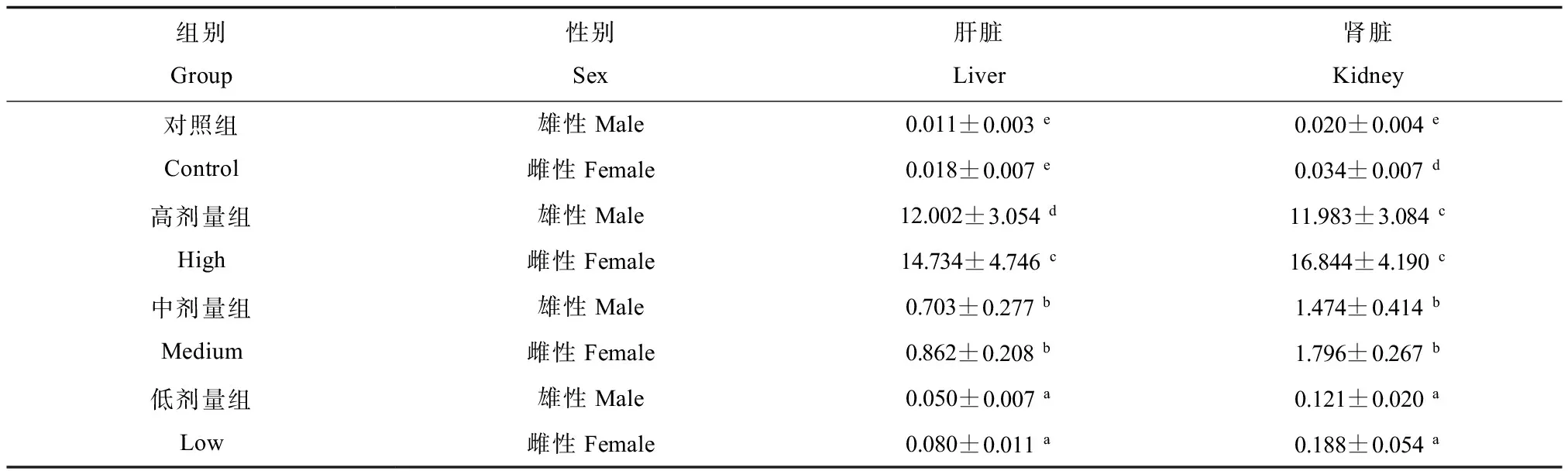
表2 重金属联合暴露后大鼠肝脏及肾脏中Cd的浓度(μg·g-1)Table 2 Concentrations of Cd in liver and kidney of rats exposed to metal mixtures (μg·g-1)
注:平均值±标准偏差(mean±SD);采用Dunnett’ s T3方法进行多重比较,a, b, c, d, e上标字母相同时表示在1%水平上差异无统计学意义。高剂量为HgCl23.67 mg·kg-1,NaAsO23.67 mg·kg-1,CdCl210.55 mg·kg-1,K2Cr2O76.40 mg·kg-1,Pb(OOCCH3)2·3H2O 133.33 mg·kg-1;中剂量为HgCl20.367 mg·kg-1,NaAsO20.367 mg·kg-1,CdCl21.055 mg·kg-1,K2Cr2O70.640 mg·kg-1,Pb(OOCCH3)2·3H2O 13.333 mg·kg-1;低剂量为HgCl20.0367 mg·kg-1,NaAsO20.0367 mg·kg-1,CdCl20.1055 mg·kg-1,K2Cr2O70.0640 mg·kg-1,Pb(OOCCH3)2·3H2O 1.3333 mg·kg-1。
Note: values were shown as mean±standard deviation. The Dunnett’s T3 method was used for multiple comparisons. Within the same columns, values with different superscripts letters (a, b, c, d, e) were significantly different (P < 0.01). High dose, HgCl23.67 mg·kg-1, NaAsO23.67 mg·kg-1, CdCl210.55 mg·kg-1, K2Cr2O76.40 mg·kg-1, Pb(OOCCH3)2·3H2O 133.33 mg·kg-1; medium dose, HgCl20.367 mg·kg-1, NaAsO20.367 mg·kg-1, CdCl21.055 mg·kg-1, K2Cr2O70.640 mg·kg-1, Pb(OOCCH3)2·3H2O 13.333 mg·kg-1; low dose, HgCl20.0367 mg·kg-1, NaAsO20.0367 mg·kg-1, CdCl20.1055 mg·kg-1, K2Cr2O70.0640 mg·kg-1, Pb(OOCCH3)2·3H2O 1.3333 mg·kg-1.
给药,两组剂量分别与本实验中低剂量组接近,Pb通过饮水添加Pb(OOCCH3)2给药,剂量与本实验低剂量相当,结果也表明Cd在肝脏中的含量未受到Pb的影响。
Shukla和Chandra[23]还发现与Cd单一暴露组相比,Pb+Cd显著增加了肾脏中的Cd含量。而Wang等[15]使用与本实验高剂量组接近的剂量,使大鼠通过自由饮水进行复合暴露,发现在血清和肾皮质中Cd浓度在Pb+Cd组与Cd组间无显著差异,Cd主要富集在肾脏中,而Pb主要分布在血液中。
根据本研究结果,结合已有的文献报道,仅做出初步推断,即在肝脏和肾脏中,其他4种重金属的共同作用未对Cd在大鼠肝脏和肾脏中的浓度分布产生影响。
[1] Barton H A, Chiu W A, Setzer R W, et al. Characterizing uncertainty and variability in physiologically based pharmacokinetic models: State of the science and needs for research and implementation [J]. Toxicological Sciences, 2007, 99(2): 395-402
[2] Bouvier D M, Prieto P, Blaauboer B J, et al. Physiologically-based Kinetic Modelling (PBK Modelling): Meeting the 3Rs agenda. The report and recommendations of ECVAM Workshop 63. [J]. Alternatives to Laboratory Animals: ATLA, 2008, 35(6): 661-671
[3] Loizou G, Spendiff M, Barton H A, et al. Development of good modelling practice for physiologically based pharmacokinetic models for use in risk assessment: The first steps [J]. Regulatory Toxicology and Pharmacology, 2008, 50(3): 400-411
[4] Haddad S, Béliveau M, Tardif R, et al. A PBPK modeling-based approach to account for interactions in the health risk assessment of chemical mixtures [J]. Toxicological Sciences, 2001, 63(1): 125-131
[5] Yang R S, El-Masri H A, Thomas R S, et al. Chemical mixture toxicology: From descriptive to mechanistic, and going on to in silico toxicology [J]. Environmental Toxicology and Pharmacology, 2004, 18(2): 65-81
[6] Zhao P, Zhang L, Grillo J A, et al. Applications of physiologically based pharmacokinetic (PBPK) modeling and simulation during regulatory review [J]. Clinical Pharmacology and Therapeutics, 2011, 89(2): 259-267
[7] Edginton A N, Theil F, Schmitt W, et al. Whole body physiologically-based pharmacokinetic models: Their use in clinical drug development [J]. Expert Opinion on Drug Metabolism and Toxicology, 2008, 4(9): 1143-1152
[8] Jasper M N, Martin S A, Oshiro W M, et al. Application of biologically based lumping to investigate the toxicokinetic interactions of a complex gasoline mixture [J]. Environmental Science and Technology, 2016, 50(6): 3231-3238
[9] Olie J D N, Bessems J G, Clewell H J, et al. Evaluation of semi-generic PBTK modeling for emergency risk assessment after acute inhalation exposure to volatile hazardous chemicals [J]. Chemosphere, 2015, 132: 47-55
[10] LeFew W, El-Masri H. Computational estimation of errors generated by lumping of physiologically-based pharmacokinetic (PBPK) interaction models of inhaled complex chemical mixtures [J]. Inhalation Toxicology, 2012, 24(1): 36-46
[11] Knaak J B, Dary C C, Okino M S, et al. Parameters for Carbamate Pesticide QSAR and PBPK/PD Models for Human Risk Assessment in Reviews of Environmental Contamination and Toxicology [M]. Springer, 2008: 53-212
[12] ATSDR. Interaction profile for arsenic, cadmium, chromium and lead [R]. Atlanta, GA: U.S. Department of Health and Human Services, Public Health Service, 2004
[14] Garcia T A, Corredor L. Biochemical changes in the kidneys after perinatal intoxication with lead and/or cadmium and their antagonistic effects when coadministered [J]. Ecotoxicology and Environmental Safety, 2004, 57(2): 184-189
[15] Wang L, Chen D, Wang H, et al. Effects of lead and/or cadmium on the expression of metallothionein in the kidney of rats [J]. Biological Trace Element Research, 2009, 129(1): 190-199
[16] Brown R P, Delp M D, Lindstedt S L, et al. Physiological parameter values for physiologically based pharmacokinetic models [J]. Toxicology and Industrial Health, 1997, 13(4): 407-484
[17] Cha C W. A study on the effect of garlic to the heavy metal poisoning of rat [J]. Journal of Korean Medical Science, 1987, 2(4): 213-224
[18] Asagba S. Comparative effect of water and food-chain mediated cadmium exposure in rats [J]. BioMetals, 2010, 23(6): 961-971
[19] Cobbina S J, Chen Y, Zhou Z, et al. Low concentration toxic metal mixture interactions: Effects on essential and non-essential metals in brain, liver, and kidneys of mice on sub-chronic exposure [J]. Chemosphere, 2015, 132: 79-86
[20] Rai A, Maurya S K, Khare P, et al. Characterization of developmental neurotoxicity of As, Cd, and Pb mixture: Synergistic action of metal mixture in glial and neuronal functions [J]. Toxicological Sciences, 2010, 118(2): 586-601
[21] Pandya C D, Pillai P P, Gupta S S. Lead and cadmium co-exposure mediated toxic insults on hepatic steroid metabolism and antioxidant system of adult male rats [J]. Biological Trace Element Research, 2010, 134(3): 307-317
[22] Massó E L, Corredor L, Antonio M T. Oxidative damage in liver after perinatal intoxication with lead and/or cadmium [J]. Journal of Trace Elements in Medicine and Biology, 2007, 21(3): 210-216
[23] Shukla G S, Chandra S V. Concurrent exposure to lead, manganese, and cadmium and their distribution to various brain regions, liver, kidney, and testis of growing rats [J]. Archives of Environmental Contamination and Toxicology, 1987, 16(3): 303-310
◆
Comparison of Cadmium Distribution in Rats between Exposed to Individual Cadmium and Heavy Metals Mixture Based on PBPK Model
Jiang Yanxue1,2, Jia Yijing1,2, Chao Sihong1,2, Cao Hongbin1,2,*
1. Beijing Area Major Laboratory of Protection and Utilization of Traditional Chinese Medicine, Beijing Normal University, Beijing 100082, China 2. Falculty of Geographical Science, Beijing Normal University, Beijing 100875, China
Received 4 May 2016 accepted 29 June 2016
The distribution in vivo of metals mixture might be different from that of individual metals. In order to explore the influence of four metals (mercury, chromium, arsenic and lead) on the distribution of cadmium (Cd) in vivo, a physiologically based pharmacokinetic model (PBPK) was constructed to simulate the absorption, distribution, metabolism and excretion (ADME) of Cd in rats exposed to individual Cd. The levels of Cd in liver and kidney exposed to metals mixture were obtained from a joint toxicity experiment. The experiment results showed that the concentrations of Cd in liver in high (HgCl23.67 mg·kg-1, NaAsO23.67 mg·kg-1, CdCl210.55 mg·kg-1, K2Cr2O76.40 mg·kg-1, Pb(OOCCH3)2·3H2O 133.33 mg·kg-1), medium (HgCl20.367 mg·kg-1, NaAsO20.367 mg·kg-1, CdCl21.055 mg·kg-1, K2Cr2O70.640 mg·kg-1, Pb(OOCCH3)2·3H2O 13.333 mg·kg-1) and low (HgCl20.0367 mg·kg-1, NaAsO20.0367 mg·kg-1, CdCl20.1055 mg·kg-1, K2Cr2O70.0640 mg·kg-1, Pb(OOCCH3)2·3H2O 1.3333 mg·kg-1) dose groups were 13.37, 0.78 and 0.06 μg·g-1, respectively; and those in kidney were 14.41, 1.64 and 0.15 μg·g-1, respectively. There were significant differences between the control group and exposure groups. The simulated concentrations of Cd in liver and kidney were in the range of the corresponding experimental concentrations. It is preliminarily inferred that the co-exposure with other four heavy metals had no obvious influence on Cd distribution in liver and kidney of rats.
cadmium; metals mixture; PBPK model; joint toxicity; distribution in vivo
国家科技支撑计划“村镇环境评价与预警平台建设”基金资助项目(2012BAJ24B04)
蒋艳雪(1992-),女,博士研究生,研究方向为环境健康,E-mail: 201431190020@mail.bnu.edu.cn;
*通讯作者(Corresponding author), E-mail: caohongbin@bnu.edu.cn
10.7524/AJE.1673-5897.20160504001
2016-05-04 录用日期:2016-06-29
1673-5897(2016)6-121-07
X171.5
A
曹红斌(1966—),女,工学博士,教授,主要研究方向为环境风险评价与管理、天然药物安全性评价。
蒋艳雪, 贾宜静, 晁思宏, 等. 基于PBPK模型的大鼠体内镉分布的比较:联合暴露及单独暴露[J]. 生态毒理学报,2016, 11(6): 121-127
Jiang Y X, Jia Y J, Chao S H, et al. Comparison of cadmium distribution in rats between exposed to individual cadmium and heavy metals mixture based on PBPK model [J]. Asian Journal of Ecotoxicology, 2016, 11(6): 121-127 (in Chinese)

