镉胁迫下黑点青鳉(Oryziasmelastigma)肝脏金属硫蛋白mRNA性别差异性表达研究
谢晴,薄军,郑榕辉,洪幅坤,张玉生
国家海洋局第三海洋研究所,厦门 361005
镉胁迫下黑点青鳉(Oryziasmelastigma)肝脏金属硫蛋白mRNA性别差异性表达研究
谢晴,薄军,郑榕辉,洪幅坤,张玉生*
国家海洋局第三海洋研究所,厦门 361005
鱼类金属硫蛋白(metallothionein, MT)mRNA作为生物标志物已越来越多地应用到水环境重金属污染的监测中,然而重金属胁迫下鱼类MT mRNA表达是否具有性别差异性特征目前尚无相关报道。以海洋模式鱼类—黑点青鳉(Oryzias melastigma)为实验鱼类,首次克隆了其MT基因全长cDNA序列,分析了黑点青鳉MT基因和氨基酸序列特征,然后进一步研究了水体中镉暴露后雌、雄性黑点青鳉肝脏中MT mRNA表达的差异性。结果显示,黑点青鳉MT基因cDNA全长为385 bp,编码60个氨基酸,预测编码的多肽分子量为5 990 Da,含有脊椎动物MT基因特征性序列结构cys-x-cys、cys-x-x-cys和cys-x-cys-cys。镉胁迫下雌、雄性黑点青鳉肝脏MT mRNA表达结果显示,在0.8,4.0和8.0 μg·L-1环境浓度的镉暴露1~7 d条件下,与对照组相比,雄性黑点青鳉在所有的不同暴露浓度和不同暴露时间的实验组中肝脏MT mRNA几乎均被显著性诱导表达;而雌性黑点青鳉只在较高暴露浓度和较长暴露时间的实验组中才被显著性诱导表达,并且MT mRNA的表达水平比雄性低得多。上述研究结果表明,在相同的镉胁迫条件下,雄性黑点青鳉肝脏MT mRNA的表达比雌性更敏感;以黑点青鳉MT mRNA作为生物标志物监测海洋环境重金属污染生物效应状况时,应选择更敏感的雄性黑点青鳉作为监测鱼类。利用生物标志物监测水环境污染物生物效应时,监测动物的性别差异是一个应当考虑的重要因素。
镉;黑点青鳉;金属硫蛋白mRNA;性别差异
近年来,我国海洋生态环境状况总体较好,但近岸局部海域海水环境污染依然严重,其中重金属污染是我国海洋污染的主要类型之一。我国每年产生400亿t左右的工业废水,其中重金属废水约占60%[1]。《2014年中国海洋环境状况公报》显示[2],我国河流排海污染物总量依然居高不下,陆源入海排污口达标率仅为52%,重点监测的72条河流入海的重金属污染物总量2.1万t,其中镉为120 t。重金属对生物的危害主要通过3种途径产生:直接生物毒性效应、在微生物作用下转化为毒性更强的重金属化合物以及生物富集作用。重金属镉的生物学毒性主要包括早期发育阶段毒性、遗传毒性和蛋白毒性[3-4]等。20世纪30至70年代在日本发生的“骨痛病”就是镉污染物通过食物链传递危害人体健康的典型例证。因此镉的生物效应及其危害至今仍然受到国际社会广泛关注,也是目前海洋生态毒理学领域的研究热点之一。
金属硫蛋白(metallothionein, MT)是一类普遍存在于生物体内、富含半胱氨酸、具有结合金属能力和高诱导特性的低分子量蛋白质。Margoshes和Vallee[5]在1957年从马的肾脏外皮细胞中首次分离获得了MT,并发现该蛋白可能与镉的生物代谢过程有关。早在20世纪70年代末,Bayne[6]就提出水生生物MT可作为一种生物标志物指示水环境重金属污染状况;随后MT逐渐成为监测环境重金属污染最重要的生物标志物之一[7-8]。Bebianno和Langston[9]研究发现,双壳类贻贝的鳃和消化腺等器官中的镉浓度与MT诱导水平相关,贻贝MT作为响应重金属污染的一种早期生物标志物已得到广泛应用。许多野外研究也发现,在野生鱼类体内MT的表达水平与水环境中重金属含量,尤其是与镉、锌和铜3种重金属污染程度呈现较好的相关性[10-12],我国很多学者也进行了重金属诱导鱼类或贝类MT mRNA表达的相关研究[13-15]。联合国环境规划署于1999年开展的“地中海行动计划”中,把MT作为海洋环境监测的生物标志物之一[16],欧盟及其他相关国际组织也把MT作为水生环境重金属污染状况评估的生物标志物,并将MT作为关键性生物标志物列入欧洲监测计划生物效应质量保证(Biological Effects Quality Assurance in Monitoring Programmes, BEQUALM)中[17]。目前,海洋动物MT含量已被认为是海洋环境中重金属污染监测、暴露风险和健康评价的重要指标,并受到广泛重视[18-19]。然而,由于MT分子量比较小和极少含有芳香族氨基酸等特点,其提取和检测方法比较复杂,使MT生物标志物的推广和应用受到了一定的影响。重金属对MT的诱导作用首先发生在转录水平,因此可以直接把MT mRNA作为生物标志物应用于监测环境中重金属的污染状况[20-21]。由于检测MT mRNA的方法比检测MT蛋白的方法简便可行,因此前者已经被广泛应用。目前用于检测MT mRNA表达方法主要有核酸印迹法(Northern blot)、半定量聚合酶链式反应(semi-quantitative polymerase chain reaction)和实时定量PCR(real-time quantitative PCR, qPCR),其中qPCR被公认为是一种最灵敏又可靠的分析方法[15]。鱼类MT mRNA作为生物标志物已经越来越多地应用于水环境中重金属污染效应状况的监测[22-23]。然而重金属胁迫下鱼肝脏MT mRNA表达是否具有性别差异性特征,目前尚无相关的报道。
黑点青鳉(Oryzias melastigma)是海洋生态毒理学研究中理想的模式鱼类[24-26],具有如下优点:温度和盐度适应范围广;体型小,世代周期短,雌雄个体形态上差异明显等,易于水族厅繁殖、饲养和试验。近年来,黑点青鳉在生态毒理学等研究中的应用越来越多[27-28]。
本研究首先克隆了黑点青鳉MT cDNA全长序列,然后以环境浓度的镉分别对雌、雄性黑点青鳉进行水体暴露实验,旨在比较不同性别的黑点青鳉肝脏MT mRNA表达差异性,为应用黑点青鳉肝脏MT mRNA作为生物标志物监测海洋环境重金属污染生物效应状况提供科学依据。
1 材料与方法(Materials and methods)
1.1 实验材料
1.1.1 黑点青鳉
黑点青鳉最初受赠于香港城市大学生化系Dr. Doris W T Au,已经在我国家海洋局第三海洋研究所海洋生物与生态研究室青鳉养殖中心稳定繁殖6代以上。养殖过程严格按照黑点青鳉养殖标准操作流程:室温控制在(28±1)℃;光照周期为光∶暗=14 h∶10 h,光照强度100~500 lux;溶氧量DO≥6 mg·L-1;养殖用的海水为人工配制,盐度为30‰;配备一套水质在线实时监测系统,监测水中溶氧量、pH和电导等参数;每天2次固定时间分别投喂新孵化的活体丰年虫,投饵量约为鱼体重2%。
本研究中所用到的雌、雄性黑点青鳉来自国家海洋局第三海洋研究所青鳉养殖中心人工孵化的同一批鱼卵,实验时年龄为8个月,雄鱼平均体长(3.00±0.18) cm,平均体重(0.27±0.04) g;雌鱼平均体长(2.76±0.22) cm,平均体重(0.22±0.04) g。
1.1.2 CdCl2母液配制
CdCl2(AR)购自美国Sigma-Aldrich公司。实验前用Milli-Q水配制为一系列浓度梯度的CdCl2母液备用。
1.2 实验方法
1.2.1 黑点青鳉MT cDNA全长序列克隆与生物信息学分析
使用TRIzol法提取黑点青鳉肝脏总RNA,根据已报道的黑点青鳉MT基因部分核苷酸序列(GenBank:HM137170)设计引物进行MT cDNA全长扩增。3'-RACE和5'-RACE的引物分别为:5'-CTGCGACTGCTCCAAAACTG-3'和5'-TGTCGCAGGTCTTCCCTTTG-3',利用SMARTTMRACE cDNA Amplification Kit (TaKaRa)进行MT基因cDNA第一链合成、5'-RACE和3'-RACE扩增;然后将目的条带切胶回收,与pMD19-T载体链接,转化DH5α感受态细胞,经平板培养和菌落PCR鉴定后进行测序。
利用NCBI(http://www.ncbi.nlm.nih.gov)同源序列相似性在线搜索比对工具BLAST进行黑点青鳉MT基因序列相似性搜索比对分析;使用GeneTool 1.0 Lite拼接基因序列;使用DNAssist 2.0软件预测开放阅读框(ORF),翻译编码的氨基酸序列,预测蛋白质分子量以及计算理论等电点;使用Clustalx 1.83软件进行各物种间氨基酸序列比对;利用MEGA 4.0软件,构建黑点青鳉MT基因的系统进化树。
1.2.2 镉水体暴露实验
参考现行的“GB3097—1997中华人民共和国海水水质标准”(一类海水镉≤ 1 μg·L-1,二类海水镉≤ 5 μg·L-1,三、四类海水镉≤ 10 μg·L-1)[29],在剂量效应实验中,镉水体暴露浓度设计为0.8、4.0和8.0 μg·L-1共3个浓度组,同时设置一个空白对照组。各浓度设置2个平行组,每个平行组暴露体积10 L,随机放入黑点青鳉成鱼18条,每天更换一次含有相应镉浓度的海水。雄性和雌性黑点青鳉暴露实验分别同时进行,尽量保证整个实验过程条件完全一致。暴露后的1、3、5和7 d这4个时间点分别取样,每次取样时从各浓度组的2个平行组分别随机取4条,即每个浓度取8条鱼(n=8),解剖获得的肝脏样品立即放入液氮中速冻,然后转移至-80 ℃超低温冰箱中保存,用于后续的分析。
采用无火焰原子吸收分光光度法[29],使用德国耶拿Zeenit 600原子吸收分光光度计测定空白对照组和3个不同镉浓度暴露组海水镉离子的实际浓度。
1.2.3 黑点青鳉MT mRNA表达定量分析
黑点青鳉肝脏MT mRNA表达水平利用qPCR方法进行检测,该基因扩增引物序列同上述RACE实验所用的引物一致;内参基因为18S,qPCR实验步骤同文献[26]中的方法。所用仪器为Rotor-Gene Q(德国Qiagen),MT mRNA相对表达量分析方法基于2-ΔΔCT原理[30]进行。
1.2.4 数据处理
所有数据均以平均值±标准误差(M±S.E.)表示,应用IBM SPSS 19.0软件中的单因素方差分析进行统计学分析。结果中“*”表示统计学上具有显著性差异(P < 0.05)。各个时间点处理组MT mRNA表达数据均与其相应的对照组进行统计学分析。
2 结果(Results)
2.1 黑点青鳉MT cDNA序列分析
测序拼接后黑点青鳉MT cDNA全长及推导的氨基酸序列如图1所示:全长385 bp,开放阅读框为180 bp,起始密码子为ATG,终止密码子为TGA,编码60个氨基酸,预测编码多肽的分子量为5 990 Da,理论pI为8.38;含有典型的多腺苷酸化信号序列(AATAAA)。BLAST在线比对结果显示,该基因编码的氨基酸序列与已经报道的其他鱼类MT基因的氨基酸序列一致性范围为82%~98%,确认该序列为黑点青鳉MT基因。

图1 黑点青鳉MT全长cDNA序列及推导的氨基酸序列注:图中灰色部分为预测编码的氨基酸序列;终止密码子用“*”表示。Fig. 1 Complementary DNA and predicted amino acid sequences of MT from O. melastigmaNote: The grey part indicates the predicted code of MT from O. melastigma. The stop code is indicated with an asterisk ‘*’.
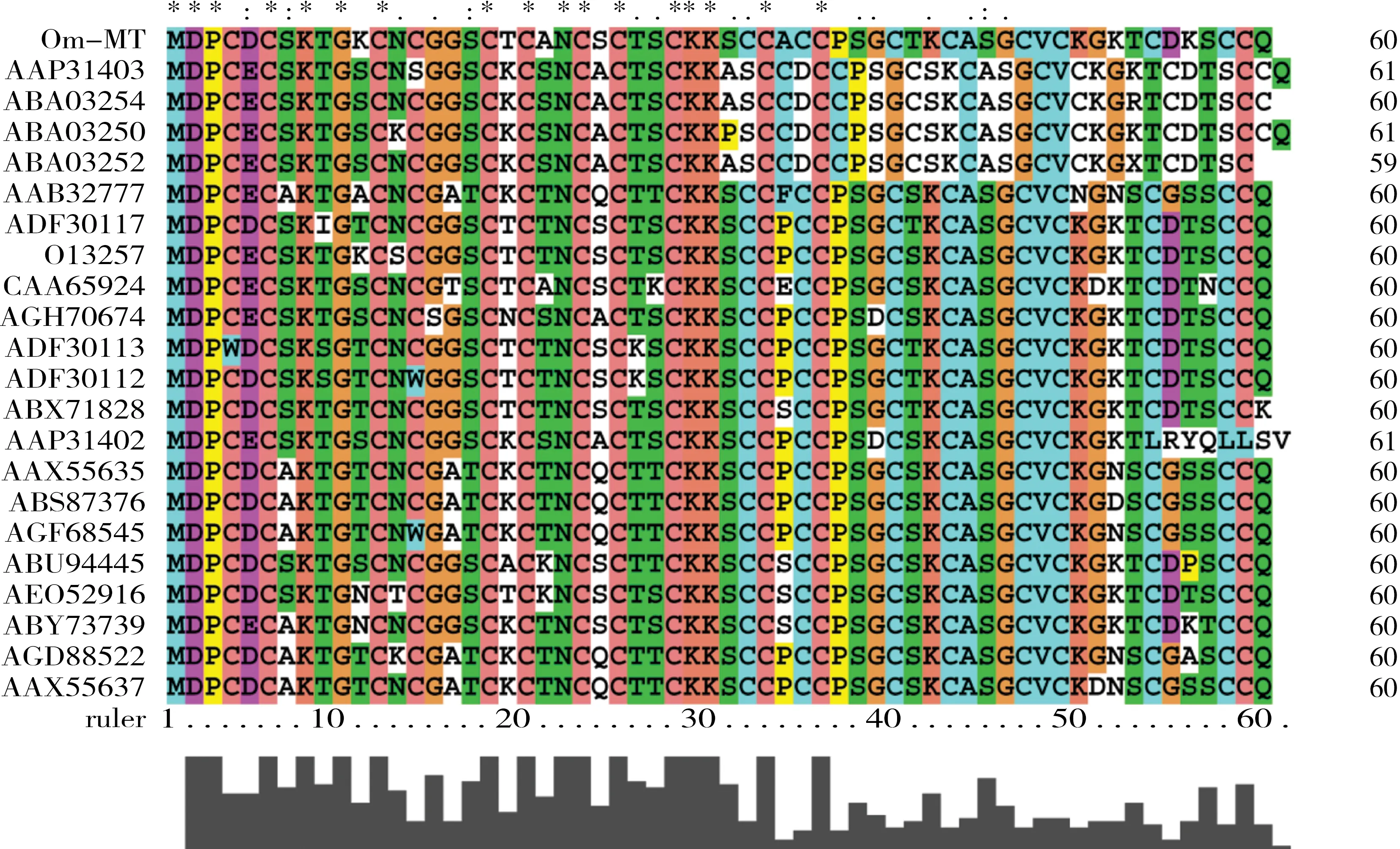
图2 黑点青鳉MT基因与其他鱼类相同基因氨基酸序列比对注:‘*’表示具有完全一致的氨基酸的位置;‘:’和‘.’表示具有相似性质的氨基酸的位置。Fig. 2 Multiple sequence alignment of MT among O. melastigma and other fish speciesNote:‘*’ indicates positions which have a single, fully conserved residue; ‘:’ indicates that one of the strong groups is fully conserved; ‘.’ indicates that one of the weaker groups is fully conserved.

图3 黑点青鳉MT基因与其他鱼类相同基因氨基酸序列系统进化树分析Fig. 3 Phylogenetic analysis of deduced amino acid sequences of MT cDNA from O. melastigma and other fish species
黑点青鳉MT基因编码的氨基酸与其他鱼类相同基因氨基酸序列比对结果如图2所示。推导的黑点青鳉MT含20个半胱氨酸(Cys)残基,占总氨基酸数目的三分之一,它们与邻近的氨基酸组成了MT的保守性结构,具有MT特征性序列结构cys-x-cys、cys-x-x-cys和cys-x-cys-cys,与其他鱼类的MT在Cys的排列方式上显示出高度的保守性。黑点青鳉MT基因与其他鱼类相同基因氨基酸序列系统进化树分析结果如图3所示:黑点青鳉与鳜鱼(Siniperca chuatsi)和吻鳞肩孔南极鱼(Trematomus lepidorhinus)在进化上距离较近,而与鲑科如大马哈鱼(Oncorhynchus keta)、银鲑(Oncorhynchus kisutch)和北极红点鲑(Salvelinus alpinus)等距离较远,分属于两个不同分支。
2.2 海水镉离子浓度测定
测定结果显示,空白对照组海水镉离子浓度为0.196 μg·L-1,3个暴露组(0.8、4.0和8.0 μg·L-1)海水镉离子实际浓度分别为0.965、4.182和8.194 μg·L-1。
2.3 水体镉暴露对雄性黑点青鳉肝脏MT mRNA表达的影响
雄性黑点青鳉经镉暴露不同时间,肝脏中MT mRNA表达结果如图4所示。暴露1 d后,0.8、4.0和8.0 μg·L-1浓度组MT mRNA相对表达量与对照组相比均显示出快速且显著性的升高,各浓度组表达水平为对照组的3.5~4.1倍。暴露3 d后,3个浓度组鱼肝脏MT mRNA均被显著性诱导,分别为对照组的9.6、9.0和7.5倍。暴露5 d后,0.8 μg·L-1和4.0 μg·L-1浓度组鱼肝脏MT mRNA相对表达水平开始下降,但与对照组相比仍具有显著性差异;而最高浓度的8.0 μg·L-1组MT mRNA表达水平仍不断升高,达到对照组的10.6倍。暴露7 d后,各组的表达量水平总体上继续呈下降趋势,0.8、4.0和8.0 μg·L-1浓度组分别为对照组的1.5、3.3和5.3倍。除最低剂量组之外,4.0和8.0 μg·L-1浓度组MT mRNA表达量与对照组相比仍然具有显著性差异。
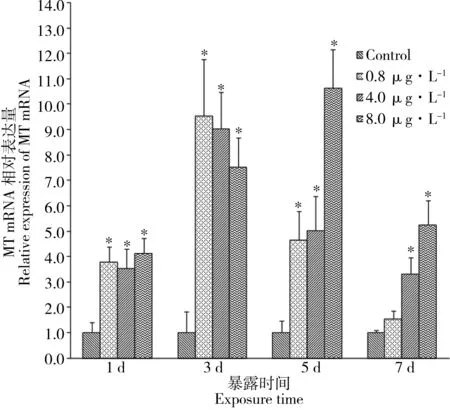
图4 水体镉暴露对雄性黑点青鳉肝脏MT mRNA表达的影响Fig. 4 Hepatic MT mRNA expression pattern of male O. melastigma exposed to Cd
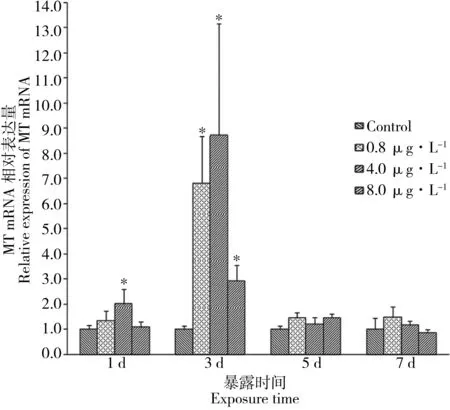
图5 水体镉暴露对雌性黑点青鳉肝脏MT mRNA表达的影响Fig. 5 Hepatic MT mRNA expression pattern of female O. melastigma exposed to Cd
2.4 水体镉暴露对雌性黑点青鳉MT mRNA表达的影响
雌性黑点青鳉经不同剂量和不同时间的镉暴露后,肝脏MT mRNA表达结果如图5所示。暴露1 d后,只有4.0 μg·L-1浓度组MT mRNA被显著性诱导表达;暴露3 d后,各浓度组(0.8、4.0 和8.0 μg·L-1)的表达量呈现升高的趋势,均达到最大值,分别为对照组的6.8、8.7和2.9倍。然而,随着暴露时间延长到5~7 d后,MT mRNA表达量均下降到本底水平。
3 讨论(Discussion)
鱼类的肝脏是解除重金属毒性的主要器官,在重金属离子胁迫下,鱼类肝脏中金属硫蛋白及其mRNA表达通常呈现一种典型的“先诱导后抑制”模式。在一定浓度的环境重金属诱导下,MT表达量先随着暴露时间延长不断升高;随后当MT含量达到阈值时又会对自身的转录机制产生负反馈调节,抑制其表达;同时MT也会由于相关酶的作用而被降解[31-33]。以鱼类肝脏MT和MT mRNA为生物标志物的实验结果大多数符合这种诱导模式[34-36]。Zhang等[37]将鲶鱼(Ictalurus punctatus)暴露于100.0 μg·L-1的CdCl2中1~4 d,鱼肝脏MT mRNA表达水平在1 d时呈上升趋势,2 d时达到最高,并呈现显著性差异,随后降低到对照组水平。Choi等[38]对金鱼(Carassius auratus)进行0.1 μg·g-1CdCl2体内注射,实验开始6 h后肝脏MT mRNA相对表达量已经显著升高,12 h后达到最高值,约为对照组的6倍,之后开始降低。在本研究中,镉的时间效应实验结果表明,暴露1~3 d期间,雌、雄性黑点青鳉肝脏MT mRNA表达均呈现上升趋势,并且在3 d时达到最高水平;暴露5~7 d后,总体上表现出下降趋势,而且雄性的表达更加显著,这与上述报道的其他鱼类重金属暴露后MT mRNA表达呈现先诱导后抑制的结果相一致。
重金属暴露后机体相关组织细胞中MT被诱导表达是生物重要防护机制之一。生物体内具有一种或多种金属效应转录因子,能够与相应的金属离子结合发生结构的转化,进而与金属效应元件(metal response elements, MREs)结合,调控效应基因,启动MT基因转录。Cd2+可使转录因子从非活性状态(非DNA结合型)转化为活性状态(DNA结合型),在Cd2+作用下,DNA结合型金属调控蛋白识别MREs,成为正调控因子,促进MT基因转录,这可能是经过镉暴露后肝脏MT mRNA显著升高的主要原因[39-40]。生物体中MT的诱导表达参与了体内金属的内稳和脱毒过程,利用人类胚胎肾细胞系进行研究发现,蛋白磷酸酶2A通过金属转录因子-1(metal transcription factor-1, MTF-1)的去磷酸化而调控MT的表达[41]。然而,在鱼类中MT的调控机制是否和哺乳动物中一致,目前尚不清楚。
Smaoui-Damak等[42]通过研究沟纹蛤仔(Ruditapes decussatus)不同季节消化腺和鳃中MT含量与性别的关系发现,MT含量的性别差异与蛤仔的生殖周期有关。Hamza-Chaffai等[43]的研究结果显示,另一种蛤类(Ruditapes decussates)消化腺中MT含量在雌性体内更高。除贝类外,钩虾(Gammarus locusta)的研究结果同样显示,MT含量与性别具有相关性[44]。在本实验中,黑点青鳉肝脏MT mRNA的表达同样具有明显的性别差异性。因此,推测MT mRNA性别差异性表达特征可能在不同水生动物中具有普遍性。在一些免疫刺激物或环境污染物胁迫下,黑点青鳉相关分子在转录水平的性别差异性表达已有报道。脂多糖刺激后,黑点青鳉抗菌肽hepcidin基因在肝和脾中雄性比雌性诱导水平更高[26];经多溴联苯醚-47暴露后,黑点青鳉转录组表达谱和补体系统重要基因表现出雄性比雌性更敏感的性别差异特征[45-46]。本实验中,暴露1~7 d期间,雄性黑点青鳉肝脏MT mRNA,除了暴露7 d时的最低剂量组外,其余各剂量组均被显著性诱导;而雌性暴露组,只有暴露3 d时,各剂量组均呈现显著性升高,其余各组MT mRNA表达水平与对照组比较,总体上无显著性差异。此外,与雌性比较,在整个暴露期间,雄性肝脏MT mRNA受镉的诱导一直处于较高水平。由此可见,镉暴露后,雄性黑点青鳉肝脏MT mRNA表现出诱导持续时间比较长和诱导倍数比较高的特征。因此,在海洋环境重金属污染效应研究与监测中,选择比较敏感的雄性黑点青鳉肝脏MT mRNA表达为指标更合适。
综上,本文首次克隆了黑点青鳉MT基因全长cDNA序列,在环境浓度镉暴露条件下,雄性黑点青鳉肝脏MT mRNA的表达比雌性更敏感。以黑点青鳉肝脏MT mRNA作为生物标志物监测海洋环境重金属镉的污染是可行的,但应充分考虑不同性别对重金属胁迫响应的差异性。我们的研究结果提示,利用生物标志物监测水环境污染物生物效应时,监测动物的性别差异是一个应当考虑的重要因素。
[1] 周晓勇, 田亚运, 李辉宇, 等. 重金属废水处理方法研究进展[J]. 河南化工, 2014, 31(4): 21-27
Zhou X Y, Tian Y Y, Li H Y, et al. Research progress of the treatment of heavy metal wastewater [J]. Henan Chemical Industry, 2014, 31(4): 21-27 (in Chinese)
[2] 国家海洋局. 2014年中国海洋环境状况公报[EB/OL]. (2015-03-16) [2015-08-02]. http://www.coi.gov.cn/gongbao/huanjing/201503/t20150316_32222.html
[3] Cao L, Huang W, Shan X, et al. Cadmium toxicity to embryonic-larval development and survival in red sea bream Pagrus major [J]. Ecotoxicology and Environmental Safety, 2009, 72(7): 1966-1974
[4] Cavas T, Garanko N, Arkhipchuk V. Induction of micronuclei and binuclei in blood, gill and liver cells of fishes subchronically exposed to cadmium chloride and copper sulphate [J]. Food and Chemical Toxicology, 2005, 43(4): 569-574
[5] Margoshes M, Vallee B L. A cadmium protein from equine kidney cortex [J]. Journal of the American Chemical Society, 1957, 79: 4813-4814
[6] Bayne B L. Physiological measurements of stress [J]. Rapports et Procès-verbaux desRéunions, 1979, 179: 56-61
[7] Chan K. Metallothionein: Potential biomarker for monitoring heavy metal pollution in fish around Hong Kong [J]. Marine Pollution Bulletin, 1995, 31: 411-415
[8] Linde A R, Sánchez-Galán S, Vallés-Mota P, et al. Metallothionein as bioindicator of freshwater metal pollution: European eel and brown trout [J]. Ecotoxicology and Environmental Safety, 2001, 49: 60-63
[9] Bebianno M J, Langston W J. Cadmium induction of metallothionein synthesis in Mytilus galloprovincialis [J]. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 1992, 103(1): 79-85
[10] Hamza-Chaffai A, Amiard J C, Pellerin J, et al. The potential use of metallothionein in the clam Ruditapes decussatus as a biomarker of in situ metal exposure [J]. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 2000, 127: 185-197
[11] Roch M, McCarter J A, Matheson M, et al. Hepatic metallothionein in rainbow trout (Salmo gairdneri) as an indicator of metal pollution in the Campbell river system [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1982, 39: 1596-1601
[12] Wong C K, Yeung H Y, Cheung R Y, et al. Ecotoxicological assessment of persistent organic and heavy metal contamination in Hong Kong coastal sediment [J]. Archives of Environmental Contamination and Toxicology, 2000, 38: 486-493
[13] 周妍英, 李瑞金, 任国锐, 等. 镉对长江华溪蟹金属硫蛋白mRNA表达的诱导及低分子量壳聚糖的联合作用[J]. 环境科学学报, 2011, 31(9): 2028-2032
Zhou Y Y, Li R J, Ren G R, et al. Effects of cadmium and the combination of cadmium with low molecular weight chitosan on the mRNA expression of metallothionein in the freshwater crab Sinopotamon yangtsekiense [J]. Acta Scientiae Circumstantiae, 2011, 31(9): 2028-2032 (in Chinese)
[14] 周彦锋, 吴伟, 胡庚东, 等. 镉锌联合诱导金属硫蛋白在鲫鱼肝脏和肾脏中的表达[J]. 生态环境学报, 2009, 18(3): 811-816
Zhou Y F, Wu W, Hu G D, et al. Metallothionein in liver and kidney of Carassius auratus exposing to cadmium and zinc [J]. Ecology and Environmental Sciences, 2009, 18(3): 811-816 (in Chinese)
[15] 安立会, 郑丙辉, 付青. 以梭鱼金属硫蛋白基因表达监测海洋重金属污染[J]. 中国环境科学, 2011, 31(8): 1383-1389
An L H, Zheng B H, Fu Q. Metallothionein mRNA expression in wild redeye mullet (Liza haematocheila) for monitoring marine heavy metal pollution [J]. China Environmental Science, 2011, 31(8): 1383-1389 (in Chinese)
[16] UNEP/RAMOGE. Manual on the biomarkers recommended for the MED POL biomonitoring programme [R]. Athens: UNEP, 1999: 92
[17] Mathiessen P. Biological effects quality assurance in monitoring programs (BELQUALM) [R]. Remenbrance Avenue, Burham-on-Crouch: Centre for Environment, Fisheries and Aquaculture Science (CEFAS), 2000: 24
[18] Bebianno M J, Santos C, Canário J, et al. Hg and metallothionein-like proteins in the black scabbardfish Aphanopus carbo [J]. Food and Chemical Toxicology, 2007, 45(8): 1443-1452
[19] 叶属峰, 陆健健. 无脊椎动物MT(MTs)多样性及其生态服务功能[J]. 生物多样性, 2000, 8(3): 317-324
Ye S F, Lu J J. Metallothionein diversity and its ecological service functions of invertebrates: An overview [J]. Chinese Biodiversity, 2000, 8(3): 317-324 (in Chinese)
[20] Cheung A P, Lam T H, Chan K M. Regulation of tilapiametallothionein gene expression by heavy metal ions [J]. Marine Environment Research, 2004, 58: 389-394
[21] Long A, Wang W X. Assimilation and bioconcentration of Ag and Cd by the marine black bream after waterborne and dietary metal exposure [J]. Environmental Toxicology and Chemistry, 2005, 24: 709-716
[22] Lee S, Kim C, Kim J, et al. Cloning metallothionein gene in Zacco platypus and its potential as an exposure biomarker against cadmium [J]. Environmental Monitoring and Assessment, 2015, 187: 447
[23] Lange A, Ausseil O, Segner H. Alterations of tissue glutathione levels and metallothionein mRNA in rainbow trout during single and combined exposure to cadmium and zinc [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2002, 131: 231-243
[24] Kasahara M, Naruse K, Sasaki S, et al. The medaka draft genome and insights into vertebrate genome evolution [J]. Nature, 2007, 447(7145): 714-719
[25] Kong R Y C, Giesy J P, Wu R S S, et al. Development of a marine fish model for studying in vivo molecular responses in ecotoxicology [J]. Aquatic Toxicology, 2008, 86(2): 131-141
[26] Bo J, Cai L, Xu J H, et al. The marine medaka Oryzias melastigma—A potential marine fish model for innate immune study [J]. Marine Pollution Bulletin, 2011, 63: 267-276
[27] 伍辛泷, 黄乾生, 方超, 等. 新兴海洋生态毒理学模式生物—海洋青鳉鱼(Oryzias melastigma) [J]. 生态毒理学报, 2012, 7(4): 145-153
Wu X L, Huang Q S, Fang C, et al. Oryzias melastigma: A new promising model organism for marine ecotoxicology [J]. Asian Journal of Ecotoxicology, 2012, 7(4): 145-153 (in Chinese)
[28] van de Merwe J P, Chan A K Y, Lei E N Y, et al. Bioaccumulation and maternal transfer of PBDE 47 in the marine medaka (Oryzias melastigma) following dietary exposure [J]. Aquatic Toxicology, 2011, 103(3-4): 199-204
[29] 国家环境保护局和国家海洋局. GB 3097—1997 海水水质标准[S]. 北京: 中国环境科学出版社, 1997
[30] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod [J]. Methods, 2001, 25(4): 402-408
[31] Escobedo-Fregoso C, Mendez-Rodriguez L C, Monsalvo-Spencer P, et al. Assessment of metallothioneins in tissues of the clam Megapitaria squalida as biomarkers for environmental cadmium pollution from areas enriched in phosphorite [J]. Archives of Environmental Contamination and Toxicology, 2010, 59(2): 255-263
[32] Boutet I, Tanguy A, Auffret M, et al. Immunochemical quantification of metallothioneins in marine mollusks: Characterization of a metal exposure bioindicator [J]. Environmental Toxicology and Chemistry, 2002, 21: 1009-1014
[33] Bebianno M J, Langston W J. Metallothionein induction in Mytilus edulis exposed to cadmium [J]. Marine Biology, 1991, 108: 91-96
[34] Hermesz E,brahám M, Nemcsók J. Tissue-specific expression of two metallothionein genes in common carp during cadmium exposure and temperature shock [J]. Comparative Biochemistry and Physiology-Part C: Pharmacology, Toxicology & Endocrinology, 2001, 128: 457-465
[35] Chan P, Shiu C, Wong F, et al. Common carp metallothionein gene: cDNA cloning, gene structure and expression studies [J]. Biochimica et Biophysica Acta, 2004, 1676: 162-171
[36] Wu S M, Jong K J, Lee Y J. Relationships among metallothionein, cadmium accumulation, and cadmium tolerance in three species of fish [J]. Bulletin of Environmental Contamination and Toxicology, 2006, 76: 595-600
[37] Zhang Y S, Schlenk D. Induction and characterization of hepatic metallothionein expression from cadmium-induced channel catfish (Ictalurus punctatus) [J]. Environmental Toxicology and Chemistry, 1995, 14(8): 1425-1431
[38] Choi C Y, An K W, Nelson E R, et al. Cadmium affects the expression of metallothionein (MT) and glutathione peroxidase (GPX) mRNA in goldfish, Carassius auratus [J]. Comparative Biochemistry and Physiology, Part C, 2007, 145: 595-600
[39] 谢红. 重金属在金属硫蛋白基因表达中的调控作用[J]. 国外医学卫生学分册, 1999, 26(3): 151-155 (in Chinese)
[40] 王诵涛, 谢鹏, 张敏红, 等. 金属离子对细胞内金属硫蛋白基因调控的影响[J]. 中国畜牧兽医, 2010, 37(9): 67-69
Wang S T, Xie P, Zhang M H, et al. Regulation of intracellular metallothionein gene expression by metal ions [J]. China Animal Husbandry & Veterinary Medicine, 2010, 37(9): 67-69 (in Chinese)
[41] Chen L P, Ma L, Bai Q, et al. Heavy metal-induced metallothionein expression is regulated by specific protein phosphatase 2A complexes [J]. Journal of Biological Chemistry, 2014, 289(32): 22413-22426
[42] Smaoui-Damak W, Berthet B, Hamza-Chaffai A. In situ potential use of metallothionein as a biomarker of cadmium contamination in Ruditapes decussates [J]. Ecotoxicology and Environmental Safety, 2009, 72: 1489-1498
[43] Hamza-Chaffai A, Amiard J C, Cosson R P. Relationship between metallothionein and metals in a natural population of the clam Ruditapes decussates from Sfax coast: A non linear model using Box-Cox transformation [J]. Comparative Biochemistry and Physiology C, 1999, 123: 153-163
[44] Correia A D, Sousa A, Costa M H, et al. Quantification of metallothionein in whole body Gammarus locusta (Crustacea: amphipoda) using differential pulse polarography [J]. Toxicological and Environmental Chemistry, 2004, 86(1-4): 23-36
[45] Ye R R, Lei E N Y, Lam M H W, et al. Gender-specific modulation of immune system complement gene expression in marine medaka Oryzias melastigma following dietary exposure of BDE-47 [J]. Environmental Science and Pollution Research, 2011, 19(7): 2477-2487
[46] Yu W K, Shi Y F, Fong C C, et al. Gender-specific transcriptional profiling of marine medaka (Oryzias melastigma) liver upon BDE-47 exposure [J]. Comparative Biochemistry and Physiology - Part D: Genomics and Proteomics, 2013, 8(3): 255-262
◆
Study on Gender Difference of Hepatic Metallothionein mRNA Expression ofOryziasmelastigmaExposed to Cadmium
Xie Qing, Bo Jun, Zheng Ronghui, Hong Fukun, Zhang Yusheng*
Third Institute of Oceanography, State Oceanic Administration, Xiamen 361005, China
Received 28 February 2016 accepted 21 April 2016
Although fish metallothionein (MT) mRNA as a biomarker has been widely used for monitoring heavy metal pollution in aquatic environment, there were no reports on the gender difference from fish hepatic MT mRNA expression under heavy metal exposure. In present study the full-length cDNA sequence of MT gene was isolated for the first time from medaka (Oryzias melastigma), a marine model fish, and MT gene and amino acid sequences were characterized. Then the gender difference of hepatic MT mRNA expression was studied between male and female medaka after exposure to environmentally relevant concentrations of Cd (0.8, 4.0 and 8.0 μg·L-1). The results indicate that hepatic MT cDNA of the medaka contains 385 bp, coding 60 amino acids with a predicted molecular weight 5 990 Da and containing the specific sequences of MT gene in vertebrates such as cys-x-cys, cys-x-x-cys and cys-x-cys-cys. After exposure to different concentrations of Cd for 1-7 d, hepatic MT mRNA expressions of all male medaka were almost significantly increased when compared with the control group, while the hepatic MT mRNA expressions of female medaka were significantly induced only by higher Cd concentrations with longer exposure time, and the induced levels were much lower than that of the male. By comparison of the gender difference of hepatic MT mRNA expression in the present study it is clear that male medaka is much more sensitive than the female, thus it is better to select the male medaka as a sentinel fish. The results indicate that gender difference is an important factor to be considered when using biomarkers for monitoring the biological effects of aquatic pollutants.
cadmium; Oryzias melastigma; metallothionein (MT) mRNA; gender difference
海洋公益性行业科研专项经费资助项目(201005016);国家海洋局第三海洋研究所基本科研业务费资助项目(海三科2012019);国家海洋局近岸海域生态环境重点实验室开放基金(201204)
谢晴(1991-),男,在读硕士研究生,研究方向为海洋生态毒理学,E-mail: xieqing@tio.org.cn;
*通讯作者(Corresponding author), E-mail: zhangyusheng@tio.org.cn
10.7524/AJE.1673-5897.20160228001谢晴, 薄军, 郑榕辉, 等. 镉胁迫下黑点青鳉(Oryzias melastigma)肝脏金属硫蛋白mRNA性别差异性表达研究[J]. 生态毒理学报,2016, 11(6): 93-101
2016-02-28 录用日期:2016-04-21
1673-5897(2016)6-093-09
X171.5
A
张玉生(1956-),男,二级研究员,主要研究方向为海洋污染生物效应及其生物标志物监测技术。
Xie Q, Bo J, Zheng R H, et al. Study on gender difference of hepatic metallothionein mRNA expression of Oryzias melastigma exposed to cadmium [J]. Asian Journal of Ecotoxicology, 2016, 11(6): 93-101 (in Chinese)

