中心组合效应面设计优化盐酸小檗碱包合物的制备
徐 霞,李 收
药学
中心组合效应面设计优化盐酸小檗碱包合物的制备
徐 霞,李 收
目的 探讨中心组合效应面设计在优化盐酸小檗碱-β-环糊精包合物过程中的应用。方法以盐酸小檗碱为模型药物,应用中心点效应面实验设计(central composite design,CCD),采用饱和水溶液法制备盐酸小檗碱-β-环糊精包合物,通过相溶解度图法,溶出速度及饱和溶解度的测定对所制备的包合物进行验证。结果通过CCD设计建立二项式数学模型所优化包合物的处方为药物与包合材料的比例为1∶2.03,包合时间为2.29 h。包合常数为263.01 L/mol。与盐酸小檗碱相比较,溶解度可以提高2.98倍。结论CDD设计可认为是寻求盐酸小檗碱-β-环糊精包合物的最佳制备工艺,形成包合物后可显著提高药物的溶解度。
盐酸小檗碱;β-环糊精;包合物;中心组合效应面设计
小檗碱(Berberine)为从黄连、黄柏等中药中分离的喹啉类生物碱,以盐酸盐的形式用药,主要治疗肠道感染、菌痢等疾病。但盐酸小檗碱味道极苦、水溶性差导致生物利用度低的特点,限制了其在临床中的应用[1,2]。因而有必要通过制剂方法掩盖药物的苦味以增加其顺应性,同时改善或提高药物的溶解度和生物利用度。文献报道采用将盐酸小檗碱与β-环糊精或羟丙基-β-环糊精饱和水溶液法制备成的包合物的方法可以实现上述目的[3,4]。
中心组合设计(central composite design,CCD)是国内外近年来应用较多的一种实验优化方法,为制剂制备工艺建立设计空间,通过非线性数学模型进行拟合,评价产品质量的输入变量和工艺参数之间的多维组合与相互作用,具有实验次数少、精度高、预测性好等优点[5]。故本次实验采用中心组合设计优化盐酸小檗碱包合物的制备工艺。
1 仪器与试剂
磁力搅拌器 (上海司乐仪器有限公司);UV-2550紫外分光光度计(日本岛津);电子天平(上海精科天平);盐酸小檗碱(东北制药厂,纯度:98.7%,批号20141218);β-环糊精 (安徽山河药用辅料有限公司);其余试剂均为分析纯。
2 方法与结果
2.1 盐酸小檗碱β-环糊精包合物的制备 将β-环糊精加热溶解在适量水中,将溶解在少量无水乙醇中的盐酸小檗碱缓缓滴入冷却至40℃的β-环糊精水溶液中,在400 r/min磁力搅拌不同时间后,冷却至室温,置冰箱中冷藏12 h,减压滤过,分别用蒸馏水和丙酮洗涤,将滤渣30℃真空干燥,得到固体包合物。
采用紫外分光光度法测定包合物中盐酸小檗碱的含量。精密称取盐酸小檗碱对照品14.3mg,用70%的乙醇为溶剂配制成系列浓度的溶液,以70%的乙醇作为空白对照,在200~700 nm波长范围内进行紫外扫描,结果表明盐酸小檗碱在230 nm,266 nm及342 nm处有最大吸收值,而环糊精在该波长范围内无吸收,考虑近紫外区的末端吸收影响,故选择342 nm作为检测波长。以吸光度(A)为纵坐标,浓度(C)为横坐标进行线性回归,得标准曲线方程为C=0.0709A-0.006,r=0.9998,表明盐酸小檗碱在2.86~14.30 μg/ml范围内线性关系良好,精密度、回收率等符合方法学考察要求。精密称取干燥后的包合物0.05 g,加70%乙醇超声溶解后按紫外分光光度法测定盐酸小檗碱含量,采用下列公式计算包封率和载药量。

2.2 处方优化设计 在单因素考察实验的基础上,选择对包合物制备工艺影响显著的两个因素,即药物与β-环糊精/比例(m/m)(X1)、包合时间(X2)为因素,以所制备包合物的包合率(Y1)和载药量(Y2)为指标,分别采用CCD设计安排实验[6]。见表1、2。

表1 CCD实验设计因素水平安排表
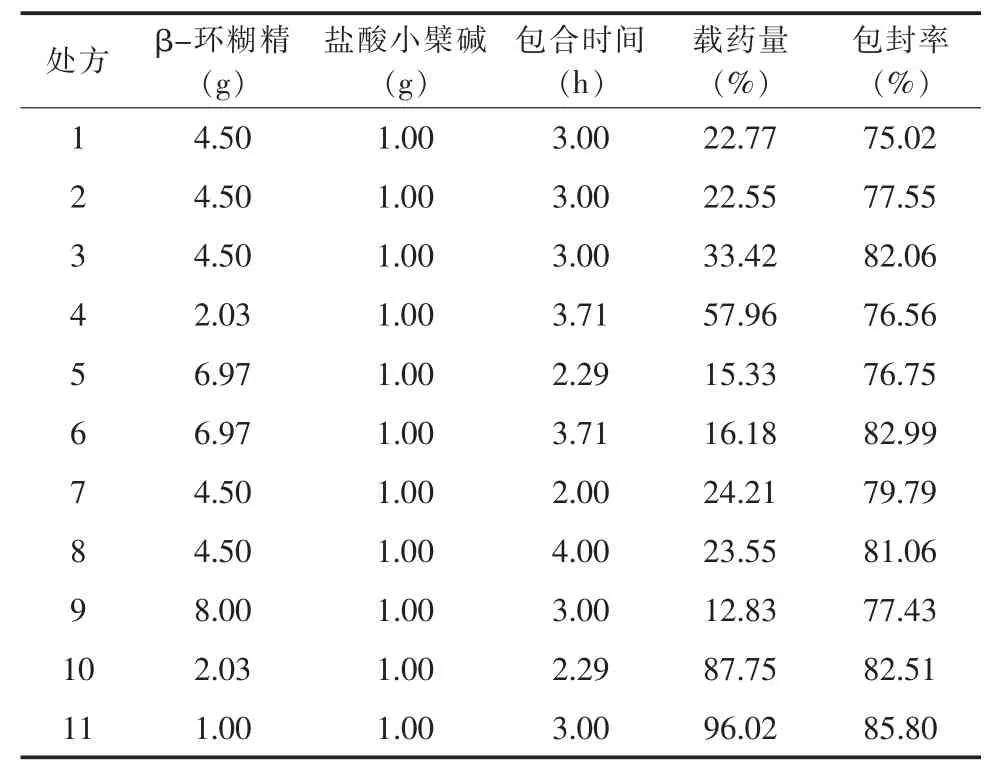
表2 CCD设计实验结果表(n=3)
按照CCD实验设计统计学要求,将因素与响应值进行方程拟合,并以置信度(P)作为模型判定标准。实验模型拟合二次多项式方程表达式为:
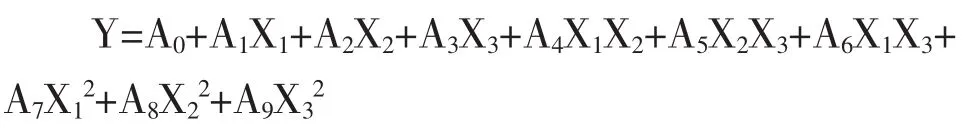
其中Y为响应值(包封率、载药率),A为方程系数,X为各自变量编码值。
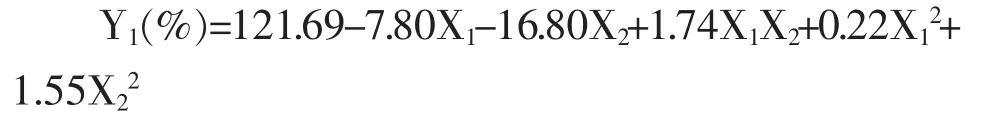
经F值检验显示方程显著(P=0.0006<0.05),表明该回归模型的拟合情况良好,能准确预测实际包封率。
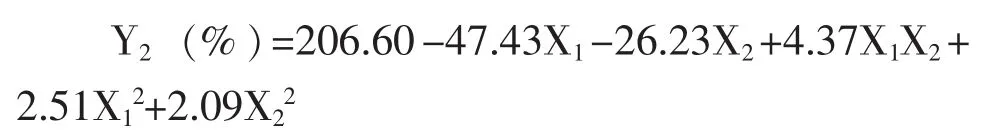
经F值检验显示方程显著 (P=0.01937<0.05),表明该回归模型的拟合情况良好,能准确预测实际载药量。

图1 不同因素对响应值影响的效应曲面图
从效应曲面图中可以看出,随药物与β-环糊精用量比例增加时,包封率呈先增加后降低趋势,意味着在包合盐酸小檗碱的过程中,所选择的药物与环糊精比例存在一个极值,通过对效应面的分析能判断各因素对响应值的影响。随包合时间的延长,包封率呈现降低趋势,另从包封率的回归方程来看,经F值检验显示方程显著,说明所选择的两个因素的不同水平在该范围内对包合率影响有显著性影响。从载药量的回归方程来看,经F值检验显示方程显著,表明该回归模型的拟合情况良好,代表性较好,能准确地预测实际情况。随药物与β-环糊精用量比例增加时,载药量呈降低趋势且变化趋势较大;在包合时间对载药量的影响过程中,载药量也呈减少趋势,提示在最佳处方附近,效应与因素之间的关系变得非常敏感,实验条件的微小变化会造成指标的较大改变,效应和因素在此区域内的关系一般表现为非线性,因此可通过预先设定目标对处方进行优化。
在包合物制备过程中,希望所制备包合物的包封率和载药量值越大越好,即希望两者存在着极大值;采用Design Expert 8.06软件对处方进行优化,得出最优处方为盐酸小檗碱∶β-CD用量比例为1∶2.03,包合时间为2.29小时为最佳制备工艺。
2.3 包合物的验证
2.3.1 相溶解度图法 精密称取β-环糊精0.75 g置于50 ml容量瓶中,加蒸馏水溶解并稀释至刻度。然后将β-环糊精溶液以蒸馏水稀释成浓度分别为1.5×10-3、3.0×10-3、4.5×10-3、6.0×10-3、7.5×10-3mol/L的溶液。取上述β-环糊精溶液各4.0 ml分别置具塞玻璃管中,均加入过量小檗碱,在25℃下振摇72h,8000 r/min离心10 min,用0.22 μm的微孔滤膜过滤,紫外分光光度法测定盐酸小檗碱的浓度。以β-环糊精溶液的浓度为横坐标,小檗碱的浓度为纵标做相溶解度图,并求出回归方程。根据回归方程,计算包合常数K,计算公式为其中b为回归方程的斜率,S0为截距。结果见图2。

图2 盐酸小檗碱在β-环糊精溶液中的相溶解度图
结果表明在0~7.5×10-3mol/L浓度范围内,随着β-环糊精溶液浓度的增加,小檗碱的浓度也相应增大,两者呈线性关系,回归方程为Y=0.3698X+0.0022(r2=0.9998)的AL型,并且曲线的斜率b= 0.3698,b值<1,说明有药物与环糊精之间按1∶1摩尔的结合比形成[7]。计算所得到的包合常数K值为263.01 L/mol。
2.3.2 溶出速率法 称取制得的包合物、物理混合物、小檗碱原料适量(相当于小檗碱100 mg)置于溶出杯中,以900 ml蒸馏水作为溶出介质,设定温度为37℃,搅拌转速为100 r/min,分别于2、5、10、15、20、30、45 min定时取样5 ml,同时补充同温同体积的蒸馏水。取出的液体用0.22 μm微孔滤膜滤过,滤液在342 nm的波长处测定吸光度,根据标准曲线回归方程,计算累积溶出度[3]。以时间为横坐标,累积溶出度为纵坐标,绘制药物累计释放曲线,结果见图3。包合物的累积溶出度明显高于混合物和盐酸小檗碱,并在短时间内达到平衡,混合物的累积溶出度稍高于小檗碱,说明包合物的制备能够提高药物的溶出度。
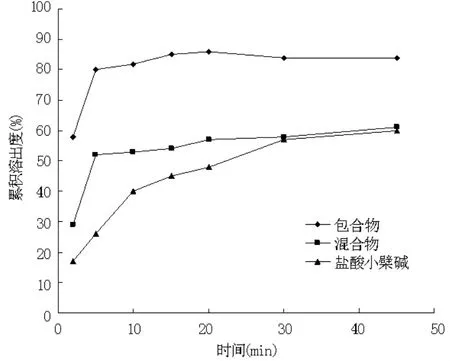
图3 盐酸小檗碱包合物、物理混合物及原料药的溶出度测定结果
2.3.3 饱和溶解度测定 分别称取盐酸小檗碱、包合物、物理混合物适量置10 ml容量瓶中,加蒸馏水制成饱和溶液,然后置于25℃恒温振荡器中振荡72 h。将溶液在10000 r/min离心,取上清液用0.22 μm的微孔滤膜滤过,弃去初滤液,续滤液以紫外分光光度法测定吸光度,根据标准曲线计算饱和溶解度,结果见表3。
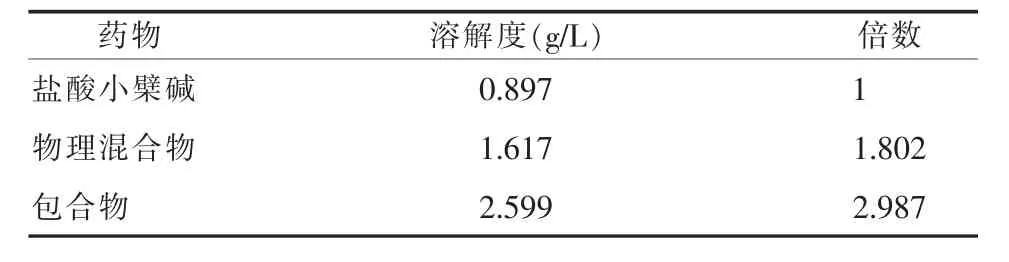
表3 盐酸小檗碱饱和溶解度测定结果
由表3可知,盐酸小檗碱形成包合物后其饱和溶解度可提高2.98倍。说明通过β-环糊精的包合作用,小檗碱的亲水性显著提高。而饱和溶解度的增加不仅仅是由于环糊精的加入引起,与物理混合物相比,形成包合物后的溶解可以提高1.6倍。
3 讨论
药物与载体的投料比直接影响药物的包合率及载体材料的利用率。主、客分子之间的比例大,会造成载药量小,药物的有效浓度低;主、客分子之间的比例小,会使药物未能全部被包合,游离药物多,造成包合率较低。因而本试验中采用CCD效应曲面模型进行分析,基于非线性模式进行设计,将复杂的未知的函数关系在小区域内用二次多项式模型来拟合,以优化最佳处方。
该实验采用饱和水溶液法制备小檗碱-β-环糊精包合物,并采用CCD设计对处方进行了优化,通过相溶解图、药物溶出速率及饱和溶解度的测定对是否形成包合物进行了验证。通过制备成包合物,能显著提高药物的溶解度和溶出速度。因此在此基础上,可将包合物作为中间体,进一步制备成其他制剂,扩大盐酸小檗碱的应用范围。关于掩盖味道方面,由于缺少相应的合理的检测方法,需在以后的工作中进一步完善。
[1]马素英,张疆莉,尚校军,等.小檗碱β-环糊精包合物研究[J].中国新药与临床杂志,2010,29(10):754-757.
[2]杨 波,赵榆林,辛小燕,等.盐酸小檗碱-环糊精在二元包合体系中的相互作用[J].化学世界,2004,45(6):292-294.
[3]赵榆林,杨 波,杨明惠.盐酸小檗碱-环糊精包合物的体外溶出度研究[J].云南化工,2003,30(2):1-3.
[4]张 锴,陈小慧,杨 群.盐酸小檗碱-羟丙基-β-环糊精包合物的制备、表征及溶出度研究[J].中国药房,2014,25(25):2349-2351.
[5]刘艳杰,项荣武.星点设计效应面法在药学试验设计中的应用[J].中国现代应用药学杂志,2007,24(6):455-457.
[6]吴大章,吴品江,杨 明.设计-效应面法优化紫苏叶挥发油-β-环糊精包合物制备工艺[J].成都中医药大学学报,2009,32(1):81-87.
[7]Gundogdu E,Koksal C,Karasulu E.Comparison of cefpodoxime proxetil release and antimicrobial activity from tablet formulations:Complexation with hydroxypropyl-β-cyclodextrin in the presence of water soluble polymer[J].Drug Development and Industrial Pharmacy,2012,38(6):689-696.
[2016-02-19收稿,2016-03-13修回] [本文编辑:刘一洋]
Optimization of berberine and β-cyclodextrin inclusion compound preparation by central composite design
XV Xia①,LI Shou.①Dept.of Pharmacy,No.401 Hospital of Jinan Military Command of Chinese PLA,Qingdao,Shandong 266071,China
Objective To investigate application of central composite design(CCD)to optimize berberineβ-cyclodextrin inclusion compound.MethodsCCD optimization method was performed during the preparation of berberine-β-cyclodextrin inclusion compound.The inclusion compound was tailored according to saturated aqueous solution method.The product was validated via phase solubility diagram,dissolution rate and saturated solubility. The binding constant at 25℃ was calculated.ResultsThe optimal conclusion can be inferred from CCD. Multivariate quadratic equations were used to analyze interaction effects between the multivariate factors.The ratio of drug∶β-cyclodextrin served as 1∶2.03,and the including period was 2.29 h,respectively. The binding constant was 263.01 L/mol at 25℃.The solubility of inclusion compound was 2.98 times compared with raw berberine.ConclusionCCD was suitable to optimize the formulation of preparation of inclusion compound.The berberineβ-cyclodextrin inclusion compound exerts superior performance in improving dissolution properties.
Berberine;β-cyclodextrin;Inclusion compound;Central composite design
R918
A
10.14172/j.issn1671-4008.2016.09.025
266071山东青岛,解放军401医院药剂科 (徐霞);277500山东枣庄,山东枣庄科技职业学院(李收)

