藏红花愈伤组织的诱导
陈明亮, 张丽丽,秦路平, 周志疆*
(1.江苏丰收大地种业发展有限公司,江苏盐城 224100;2.第二军医大学,上海 200433)
藏红花愈伤组织的诱导
陈明亮1, 张丽丽1,秦路平2, 周志疆1*
(1.江苏丰收大地种业发展有限公司,江苏盐城 224100;2.第二军医大学,上海 200433)
摘要[目的]建立藏红花愈伤组织诱导方法。[方法]以藏红花愈伤组织诱导率、诱导时间、外观形态作为评价参数,研究了外植体、激素种类及配比、外源添加物椰乳和活性炭浓度对藏红花愈伤组织诱导的影响。[结果]适宜的外植体是藏红花种球,适宜的激素种类及配比是MS+ KT 0.5 mg/L+NAA 2.0 mg/L,适宜的椰乳浓度是100 mL/L,活性炭浓度是3 g/L。[结论]建立的藏红花愈伤组织诱导体系稳定性好,增殖速度较快,为工厂化生产奠定基础。
关键词藏红花; 愈伤组织 ;植物激素; 椰乳
Callus Induction ofCrocussativusL.
CHEN Ming-liang1,ZHANG Li-li1,QIN Lu-ping2, ZHOU Zhi-jiang1*(1.Jiangsu Fengshou Seed Industry Development Co.,Ltd.,Yancheng,Juangsu 224100; 2.The Second Military Medical University,Shanghai 200433)
Abstract[Objective] To establish a callus induction method forCrocussativusL.[Method] The explant,hormone type and combination,additives (coconut milk and active carbon) concentration were optimized.The appearance,callus induction rate and induction time were taken as the evaluation parameters.[Result] The proper explant wasC.sativusseedball; proper hormone type and combination was MS + 0.5 mg/L KT + 2.0 mg/L NAA.The suitable concentrations of coconut milk and active carbon in culture medium were 100 mL/L and 3 g/L,respectively.[Conclusion] This callus induction system forC.sativushas good stability and rapid multiplication rate,which lays foundation for the industrialized production.
Key wordsCrocussativusL.; Callus; Plant hormones; Coconut milk
藏红花(CrocussativusL.),又名番红花、西红花,为鸢尾科番红花属球根类多年生草本植物,原产西班牙、南欧各国及伊朗等地[1],后经印度传入西藏。在《本草纲目》中,以番红花为其正名,被列入卷十五草部鸢草类[2]。
藏红花在染料、香料、功能性食品及保健品开发,妇科用药及抗癌抗肿瘤制药方面广泛应用。藏红花柱头入药,其有效成分如藏红花苷、藏红花苦苷、藏红花酸和藏红花醛,具有明显的抗癌作用,是新型抗癌药物的研究热点。但藏红花种质资源严重缺乏,价格昂贵,一直被誉为“植物黄金”[3]。
在传统栽培条件下,藏红花无法进行有性繁殖,只能通过球茎繁殖,而且栽培过程中球茎退化现象严重[4]。组织培养技术不但可以快速、大量地生产藏红花种苗或微型种球,用于快速繁殖,有效地解决藏红花资源短缺的问题。另外藏红花组织培养还可以获得大量的细胞,从细胞中直接提取有效活性物质,不受环境的限制。目前,国内外对于藏红花愈伤组织诱导的研究较多[5-10],但研究结果差异较大,所得愈伤组织很不稳定,不利于工厂化大规模生产。笔者研究藏红花愈伤组织的诱导条件,旨在为藏红花组织培养的工厂化生产提供参考。
1材料与方法
1.1试验材料藏红花种球由盐城市近海生物研发中心提供,幼叶采自种球种植后的新叶。
1.2试验方法
1.2.1外植体消毒。藏红花种球:洗掉种球表面的泥沙,切除病斑部分,用自来水冲洗1 h,蒸馏水清洗2次;然后在超净工作台中将种球放入75%乙醇中振荡浸泡30 s,用无菌蒸馏水清洗2次,再放入0.1% HgCl2溶液中振荡浸泡10 min,用无菌蒸馏水清洗6~8次。
幼叶:藏红花叶片每天喷施0.05%多菌灵,3 d后摘取幼叶用蒸馏水清洗后,在超净工作台中将幼叶浸泡于75%乙醇中10 s,无菌蒸馏水清洗2次,再将叶片浸泡于0.1% HgCl2溶液中3 min,用无菌蒸馏水清洗6~8次。
1.2.2接种。将消毒后的藏红花种球切成1 cm3大小,幼叶切成0.5~1.0 cm大小,接种于预先配制好的培养基上(以MS为基本培养基),用于愈伤组织的诱导。培养条件:温度(20±1)℃,暗培养。愈伤组织诱导率=愈伤组织数/外植体总数×100%。
2结果与分析
2.1不同外植体对藏红花愈伤组织诱导的影响由表1可知,以藏红花种球和幼叶为外植体,在MS加植物激素的培养基中均能诱导出愈伤组织,但在诱导率上具有显著性差异(P<0.05)。以种球为外植体愈伤组织诱导率高于幼叶,且愈伤组织较为致密,更有利于后期分化出种苗(图1)。因此在藏红花组织培养中愈伤组织诱导适宜的外植体是种球,但在培养时间上幼叶更早诱导出愈伤组织。
2.2不同激素种类及配比对藏红花愈伤组织诱导的影响以藏红花种球为外植体,考察了3种植物激素6-BA、KT、NAA及不同浓度配比对藏红花愈伤组织诱导的影响,结果见表2。由表2可知,当激素配比KT 0.5 mg/L+NAA 2.0 mg/L时,愈伤组织的诱导率最高达68%,且愈伤组织浅黄色,较致密,表面光滑,继代后保持旺盛生长;在愈伤组织诱导时间上该激素配比愈伤组织出现时间为7~10 d,少于其他激素配比时间。KT和NAA的组合在诱导率和诱导时间上整体优于6-BA和NAA的组合,因此前者的组合更适宜藏红花愈伤组织的诱导,即最佳诱导激素配比是MS+ KT 0.5 mg/L+NAA 2.0 mg/L。

表1 不同外植体诱导愈伤组织情况

注:A.种球,B.幼叶。Note:A.Seedball; B.Young leaves图1 不同外植体愈伤组织诱导情况Fig.1 Situation of callus induction of different explants
2.3不同添加物对藏红花愈伤组织诱导的影响
2.3.1不同浓度椰乳对愈伤组织诱导的影响。以藏红花种球为外植体,在MS加激素的培养基中添加椰乳浓度分别为0、50、100、150 mL/L,每组接种外植体100个。由图2可知,愈伤组织的诱导率为100 mL/L>50 mL/L>150 mL/L>0。在椰乳浓度10 mL/L时愈伤组织诱导率达到77%,而不添加椰乳的愈伤组织诱导率仅为47%,说明椰乳对藏红花愈伤组织的诱导起到明显的促进作用。
观察发现,添加椰乳的培养基诱导的愈伤组织浅黄色,较致密,比不添加椰乳的愈伤组织生长更旺盛,继代后也能旺盛生长;而且在诱导时间上添加椰乳的时间也较短。
2.3.2不同浓度活性炭对愈伤组织诱导的影响。以藏红花种球为外植体,在MS加激素的培养基中添加活性炭的浓度分别为0、1、3、5 g/L,每组接种外植体100个。由图3可知,当培养基中活性炭的浓度为3 g/L时藏红花愈伤组织的诱导率最高达75%,其次是5 g/L,不添加活性炭的诱导率最低。
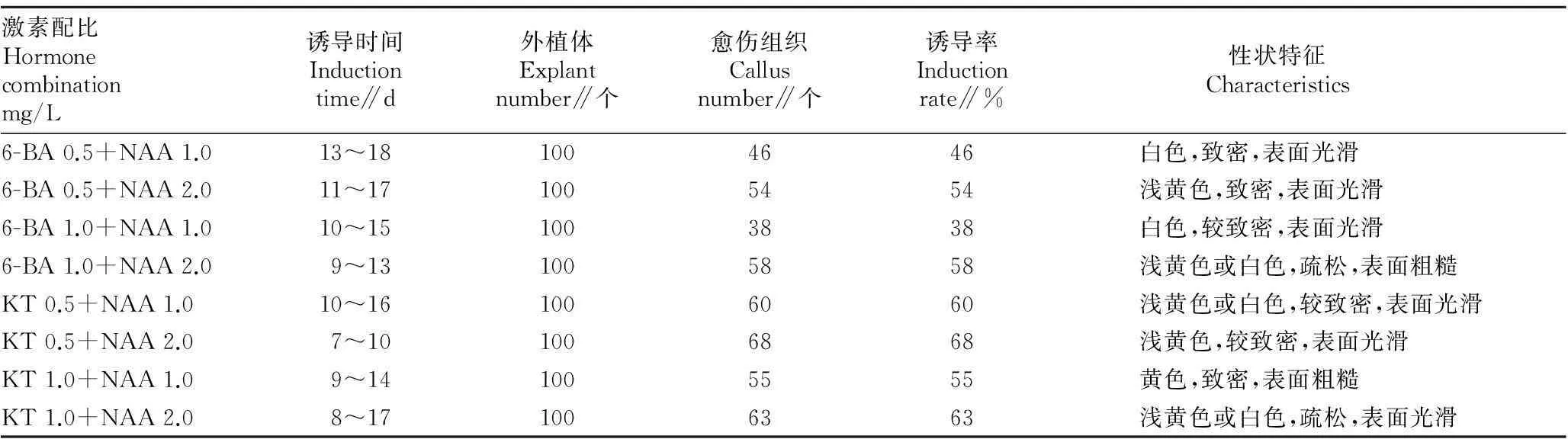
表2 不同植物激素种类及配比诱导愈伤组织情况
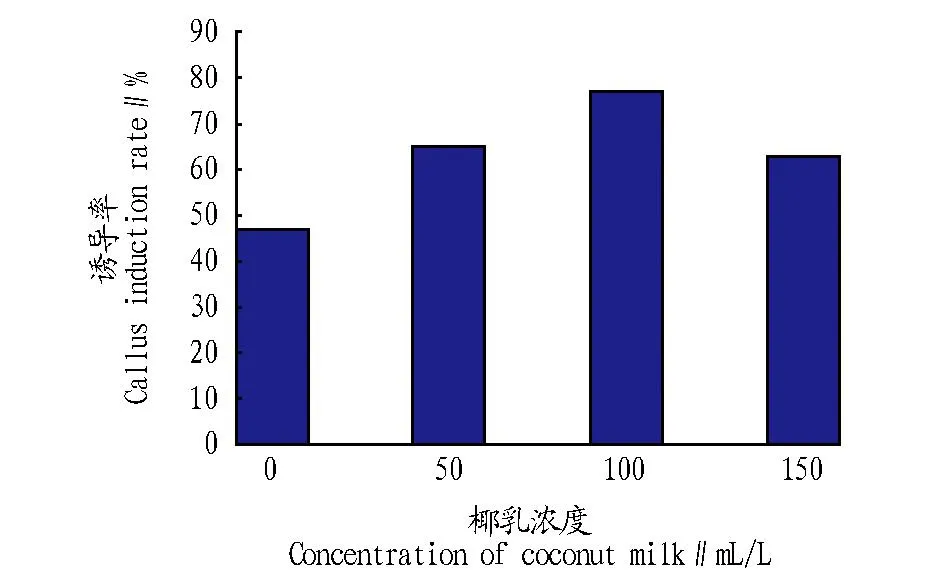
图2 不同浓度椰乳对藏红花愈伤组织诱导的影响Fig.2 Effects of coconut milk concentration on callus induction rate of Crocus sativus L.

图3 不同浓度活性炭对藏红花愈伤组织诱导的影响Fig.3 Effects of activated carbon concentration on callus induction rate of Crocus sativus L.
观察发现,添加活性炭能有效地抑制褐化现象,藏红花愈伤组织生长旺盛;而无活性炭的培养基上藏红花愈伤组织出现明显的褐化现象甚至死亡(图4)。
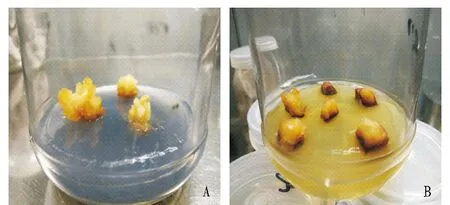
注:A.活性炭浓度为3 g/L;B.0.Note:A.Concentration of activated carbon was 3 g/L; B.Concentration of activated carbon was 0.图4 不同活性炭浓度下愈伤组织诱导情况Fig.4 Callus induction under different concentrations of activated carbon
3结论与讨论
该试验对影响藏红花愈伤组织诱导的3个主要因素进行研究,结果表明,最适宜的外植体是藏红花种球,因为种球上分布了多个芽点,生长活性最高。袁丽红等[6]、王寿芹等[7]、汪洋等[8]均使用藏红花球茎为外植体进行愈伤组织的诱导,取得了较好的效果。该研究得出的最适宜的培养基是MS+ KT 0.5 mg/L+NAA 2.0 mg/L,这与一些报道有一定的差异,如张洁等[9]诱导愈伤组织使用的培养基是MS与6-BA和2,4-D的组合,陈书安等[10]使用的是MS与6-BA和NAA的组合,说明藏红花愈伤组织的诱导激素组合并不是唯一的,扩展到整个组织培养也是如此。最适宜的培养基外源添加物椰乳浓度是100 mL/L,活性炭浓度是3 g/L,椰乳可能在愈伤组织诱导中增加天然组分营养,与合成成分相比具有保护愈伤组织的作用,王寿芹等[7]也使用了椰乳。在藏红花组织培养中,外植体褐化是最常见的问题之一,如果褐化严重会造成愈伤组织的部分死亡,所以如何抑制褐化是藏红花组织培养中的一个关键问题。活性炭具有吸附有害物质的能力,张洁等[9]、陈书安等[10]均使用活性炭来抑制或减缓褐化,取得了较好的效果。该试验获得了较为稳定的藏红花愈伤组织诱导方法,为工厂化快速繁殖藏红花或提取有效活性物质奠定基础。
参考文献
[1] 陈文浩,欧元,赵兵,等.番花球茎的快速高频诱导[J].过程工程学报,2007(1):129-130.
[2] 李琳琳.藏红花的研究概述[J].中山大学研究生学刊,2008,29(2):46-52.
[3] 李军,王晖,朱志明,等.我国藏红花离体快繁技术研究进展[J].中国园艺文摘,2012(10):187-189.
[4] HYOUTA H,MATSUSHIMA H,SANO K.Scanning electron microscopic study on the in vitro organogenesis of saffron stigma and style-like structures[J].Plant Sci,1998,58:93-102.
[5] ZEYBEK E,ONDE S,KAYA Z.Improved in vitro micropropagation method with adventitious corms and roots for endangered saffron[J].Centrai European journal of blology,2012,7(1):138-145.
[6] 袁丽红,陆玉婷,黄晶.藏红花愈伤组织诱导和褐化抑制[J].南京工业大学学报,2009,31(6):21-26.
[7] 王寿芹,赵永钦,刘莉莎,等.藏红花愈伤组织的诱导及植株再生[J].西南农业学报,2011,24(1):369-372.
[8] 汪洋,韩婷,朱昱,等.番红花组织培养及快速繁殖研究[J].中草药,2009,4(5):807-809.
[9] 张洁,林春来,王力超,等.西红花球茎组织培养的研究[J].西南师范大学学报,2007,32(1):68-72.
[10] 陈书安,王晓东,赵兵,等.藏红花球茎愈伤组织快速诱导的研究[J].中国药学杂志,2003,38(4):254-256.
收稿日期2015-12-28
作者简介陈明亮(1984- ),男,安徽六安人,从事植物组织培养研究。*通讯作者,研究员,硕士,从事遗传育种研究。
基金项目江苏省科学技术厅2014年度苏北科技专项资金项目(BN2014057)。
中图分类号S 503.53;R 282.2
文献标识码A
文章编号0517-6611(2016)03-123-03

