盐酸罗匹尼罗渗透泵型控释片的药代动力学研究
张婉直,王秀华,惠民权,吉红梅,窦建卫(1.西安交通大学药学院,西安 710061;.西安力邦肇新生物科技有限公司,西安 710075)
·药剂·
盐酸罗匹尼罗渗透泵型控释片的药代动力学研究
张婉直1,2,王秀华1,2,惠民权2,吉红梅2,窦建卫1*(1.西安交通大学药学院,西安710061;2.西安力邦肇新生物科技有限公司,西安710075)
摘要:目的建立一种测定动物血浆中盐酸罗匹尼罗的方法,并进行盐酸罗匹尼罗渗透泵型控释片的药物动力学研究,并计算与参比制剂(Requip XLimg)的相对生物利用度。方法6只Beagle犬分别单次口服盐酸罗匹尼罗渗透泵片(受试制剂)和Requip XLimg(参比制剂)1片,用LC-MS法测定血浆中的药物浓度,计算药物动力学参数和相对生物利用度。结果参比制剂和受试制剂的主要药代动力学参数tmax分别为(2.92 ± 0.49)和(3.58 ± 0.49)h,Cmax分别为(2.60 ± 0.41)和(2.35 ± 0.39 )ng·mL-1,MRT分别为(7.76 ± 0.89)和(8.48 ± 0.59) h,t1/2(Ke)分别为(4.70 ± 0.67)和(5.94 ± 1.19) h,AUC(0~)分别为(16.06 ± 5.55和(17.90 ± 2.75) ng·mL-1·h,AUC(0~∞)分别为(16.71 ± 5.87 )和(19.03 ± 3.08) ng·mL-1·h,受试制剂相对于参比制剂的相对生物利用度Fr为111.48 %。结论统计结果显示,各主要药动学参数均无显著性差异。本方法能测定口服盐酸罗匹尼罗渗透泵的血药浓度,进行动物药物动力学和相对生物利用度研究。
关键词:盐酸罗匹尼罗;渗透泵型控释片;药代动力学;相对生物利用度;LC-MS
盐酸罗匹尼罗(ropinirole)是一种选择性非麦角林多巴胺受体激动剂,能有效地、有选择性地激动脑内黑质-纹状体多巴胺D2受体,临床上用于治疗帕金森氏症和中度、重度多动腿综合征。盐酸罗匹尼罗缓释片(商品名:Requip XL)是由GSK开发的,2008年在美国获得批准上市,用于治疗先天性帕金森病[1],2014年在CFDA批准GSK的罗匹尼罗缓释片在中国进口上市。本品口服效果好,绝对生物利用度为45%~
55%,在临床上为帕金森患者提供了一种安全、有效的治疗药物。本研究建立了一种LC-MS法测定血浆中的药物浓度的方法,计算药物动力学参数及与受试制剂的相对生物利用度。
1仪器与试药
1.1仪器Agilent 1100-6460型高效液相色谱-串联质谱联用仪(安捷伦科技公司);离心机(上海安亭仪器公司);分析天平(Sartorius,BP211D 电子天平,德国);离心浓缩仪(Labconco,美国);超声波仪(KS-120D,新芝仪器厂);旋涡仪(XW-80A,上海精科实业有限公司)。
1.2试药罗匹尼罗对照品(美国USP,批号F0J036);盐酸罗匹尼罗渗透泵型控释片(军事医学科学院毒物药物研究所,批号20130417,规格2 mg);罗匹尼罗缓释片(骨架型)(葛兰素史克制药有限公司,批号1ZP9727,规格2 mg);苯海拉明对照品(中国药品生物制品检定所,批号100066-200807);甲醇、乙腈(色谱纯,J. T. Baker,USA);其他试剂均为分析纯;蒸馏水为自制重蒸馏水。
2实验方法
2.1血药质量浓度测定
2.1.1色谱条件色谱柱:艾杰尔Venusil XBP C18柱(50 mm×2.1 mm, 5 μm);流动相:乙腈∶3 mL·L-1的甲酸溶液=70∶30;流速:0.25 mL·min-1;进样量:5 μL;柱温:35 ℃;内标:苯海拉明。离子极性:正离子;离子化方式:气动辅助电喷雾离子化(ESI);离子检测方式:多反应监测(MRM);检测对象:罗匹尼罗(m/z261→114,裂碎电压:110 V,碰撞能量:18 eV,加速电压:4 eV);苯海拉明(m/z256→167,裂碎电压:75 V,碰撞能量:19 eV,加速电压:4 eV);毛细管电压:4 000 V;干燥气流速:11 L·min-1;雾化室压力:35 psi;干燥气温度:300 ℃。见图1。
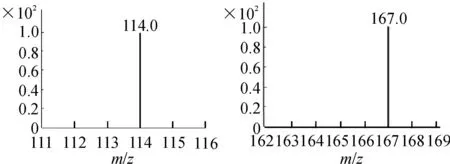
图1罗匹尼罗和苯海拉明(内标溶液)的质谱图
a.罗匹尼罗;B.苯海拉明
Fig.1 Mass spectrograms of ropinirole and diphenhydramine(Internal standard solution)
a.ropinirole;B.diphenhydramine
2.1.2色谱行为空白血浆样品、空白血浆加入对照品和内标溶液及给药后的动物血浆样品色谱图见图2。由图2可见,在选定的色谱条件下,血浆中的内源性物质对测定无干扰。
2.1.3血浆的预处理在1.5 mL EP管中加入10 μL内标溶液(40 ng·mL-1的苯海拉明甲醇溶液),静置挥干溶剂。精密量取Beagle犬含药血浆100 μL加入试管中,置于涡旋仪上涡旋30 s。加入二氯甲烷1 mL,涡旋3 min,以13 000 r·min-1离心5 min;取有机层约0.9 mL,置于1.5 mL洁净EP管中,在离心浓缩仪上30 ℃、28 min挥干溶剂。残渣用100 μL流动相涡旋1 min溶解,4 ℃下以14 000 r·min-1离心10 min,取上清液进行LC-MS分析。

图2典型LC-MS图
a.空白血浆;B.空白血浆+对照品+内标;C.给药后的动物血浆样品;1.罗匹尼罗;2.苯海拉明
Fig.2 Typical LC-MS chromatograms
a.blank plasma;B.blank plasma with reference substance and internal standard;C.animal plasma samples after the administration;1. ropinirole;2.diphenhydramine
2.1.4标准曲线的制备及定量下限在1.5 mL EP管中加入10 μL不同质量浓度的罗匹尼罗标准溶液和10 μL内标溶液,静置挥干溶剂。精密量取Beagle犬血浆100 μL加入试管中,置于涡旋仪上涡旋30 s。其余按照2.1.3项下处理方法操作,制成的血浆药物质量浓度分别为0.05,0.10,0.20,0.50,1.00,2.00,5.00和10.00 ng·mL-1,结果表明,血浆中罗匹尼罗质量浓度在0.05~10.00 ng·mL-1范围内,质量浓度与峰面积有良好的线性关系,回归方程:f=0.720 1C+0.071 59(r=0.997 5),定量下限为0.05 ng·mL-1。
2.1.5方法学验证
2.1.5.1血浆样品的基质效应在1.5 mL EP管中加入10 μL质量浓度分别为1.00,10.00和100.00 ng·mL-1的罗匹尼罗标准溶液和10 μL内标溶液,每组平行5个样品,静置挥干溶剂;残渣用100 μL流动相溶解,配成药物质量浓度分别为0.10,1.00和10.00 ng·mL-1的标准液。进样分析,记录样品与内标峰面积的比值fs(fs=As/Ai)。另精密量取比格犬血浆100 μL加入EP管中,加入二氯甲烷1 mL,涡旋3 min,以13 000 r·min-1离心5 min;取有机层0.9 mL置于1.5 mL洁净EP管中,精密加入质量浓度分别为0.10,1.00和10.00 ng·mL-1的罗匹尼罗标准溶液10 μL和内标溶液10 μL,于离心浓缩仪上30 ℃、28 min挥干溶剂。残渣用100 μL流动相溶解,进样分析,记录样品与内标峰面积的比值fx。
罗匹尼罗的基质效应按下式计算,基质效应(%)=fx/fs×100%,结果见表1。结果说明,该方法在低、中、高浓度的基质效应分别为106.68%,105.88%
和99.99%,血浆的基质效应不影响对药物和内标的检测。
表1基质效应测定结果
Tab.1Results of matrix effect
±s)
2.1.5.2精密度在1.5 mL EP管中加入10 μL质量浓度分别为1.0,10.0和100.0 ng·mL-1的罗匹尼罗标准溶液,按照2.1.3项下处理方法操作。血浆药物质量浓度分别为0.10,1.00和10.00 ng·mL-1,在日内和日间对每种质量浓度平行配制5份样品。记录色谱图,计算罗匹尼罗峰面积As和内标峰面积Ai的比值f。1 d内连续重复5次,为日内精密度;不同日期重复,每天测定1次,共测定3次,为日间精密度,结果详见表2。
精密度实验结果表明,各质量浓度水平下,日内及日间精密度符合规定。
表2方法的精密度
Tab.2The precision of the method
±s)
2.1.5.3提取回收率在1.5 mL EP管中加入10 μL不同质量浓度的罗匹尼罗标准溶液和10 μL内标溶液,配成药物质量浓度分别为0.10,1.00和10.00 ng·mL-1的标准液,静置挥干溶剂。残渣用100 μL流动相溶解,进样分析,记录样品与内标峰面积的比值fs(fs=As/Ai)。另取EP管15支,精密加入不同质量浓度的罗匹尼罗标准溶液10 μL,静置挥干溶剂。精密量取Beagle犬血浆100 μL加入EP管中,置于涡旋仪上涡旋30 s。配制成血浆药物质量浓度分别为0.10,1.00和10.00 ng·mL-1的含药血浆。按照2.1.3项下的处理方法操作,记录样品与内标峰面积的比值fx。
提取回收率按下式计算,回收率(%)=fx/fs×100%,结果见表3。
表3提取回收率测定结果
Tab.3 Recovery experiment results
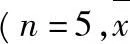
±s)
2.1.5.4准确度在1.5 mL EP管中加入10 μL质量浓度分别为1.0,10.0和100.0 ng·mL-1的罗匹尼罗标准溶液和10 μL内标溶液(40 ng·mL-1),静置挥干溶剂。精密量取比格犬空白血浆100 μL加入EP管中,置于涡旋仪上涡旋30 s。加入二氯甲烷1 mL,涡旋3 min,以13 000 r·min-1离心5 min;取有机层约0.9 mL,置于1.5 mL洁净EP管中,置于离心浓缩仪上30 ℃、28 min挥干溶剂。残渣用100 μL流动相涡旋1 min溶解,在4 ℃下以14 000 r·min-1离心10 min,取上清液至自动进样器样品管中,进样分析。血浆药物质量浓度分别为0.10,1.00和10.00 ng·mL-1,每一质量浓度平行配制6份,记录色谱图,计算罗匹尼罗峰面积As和内标峰面积Ai的比值f。将测得的比值f代入随行标准曲线,以测得量与加入量之比计算方法准确度,结果见表4。结果表明,在低、中、高质量浓度下该方法的准确度符合要求。
表4准确度测定结果
Tab.4 Results of the accuracy test
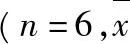
±s)
2.1.5.5血浆样品室温的稳定性在1.5 mL EP管中精密加入质量浓度分别为1.0,10.0和100.0 ng·mL-1的罗匹尼罗标准溶液10 μL内标溶液,静置挥干溶剂。精密量取Beagle犬血浆0.1 mL加入试管中,置于涡旋仪上涡旋30 s。配制成血浆药物质量浓度分别为0.10,1.00和10.00 ng·mL-1的含药血浆。每一质量浓度平行配制5份,在室温环境下放置24 h,考察血浆样品的稳定性,见表5。结果表明,血浆样品在室温放置24 h稳定。
表5血浆样品室温放置的稳定性
Tab.5 Stability of plasma samples placed at room temperature

±s)
2.2体内药物动力学研究
2.2.1实验动物实验用6只Beagle犬,平均体质量10.0±1.0 kg,雄性(由军事医学科学院实验动物中心提供)。
2.2.2实验方案6只Beagle犬给药前禁食12 h;次日清晨分别单次口服受试制剂盐酸罗匹尼罗渗透泵型控释片2 mg(1片)或参比制剂罗匹尼罗缓释片(骨架型)2 mg(1片)。服药8 h后喂食。
2.2.3血样采集分别于给药前和给药后0.5,1,1.5,2,2.5,3,3.5,4,5,6,8,10,12,16,24和36 h于犬后肢小腿外侧静脉取血2 mL,置于含肝素的离心管中。采集的血样立即离心分离,以3 500 r·min-1离心8 min;分离上层血浆,血样放置-80 ℃超低温冰箱中保存,备用。
3结果
6只Beagle犬口服盐酸罗匹尼罗渗透泵型控释片2 mg(1片)或参比制剂罗匹尼罗缓释片(骨架型)2 mg(1片)的药-时数据见图3~4,用3p97药物动力学计算程序,以AIC最小为原则结合相关系数等指标,计算各药动学参数和相对生物利用度。见表6~7。
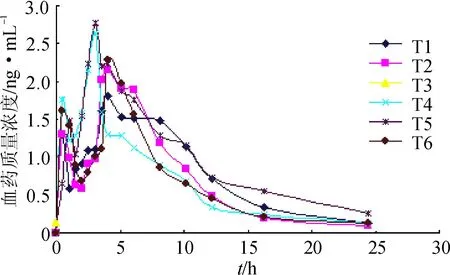
图36只Beagle犬口服受试制剂(2 mg)的药-时曲线
Fig.3 Concentration-time curves of oral test preparation (2 mg)in 6 dogs
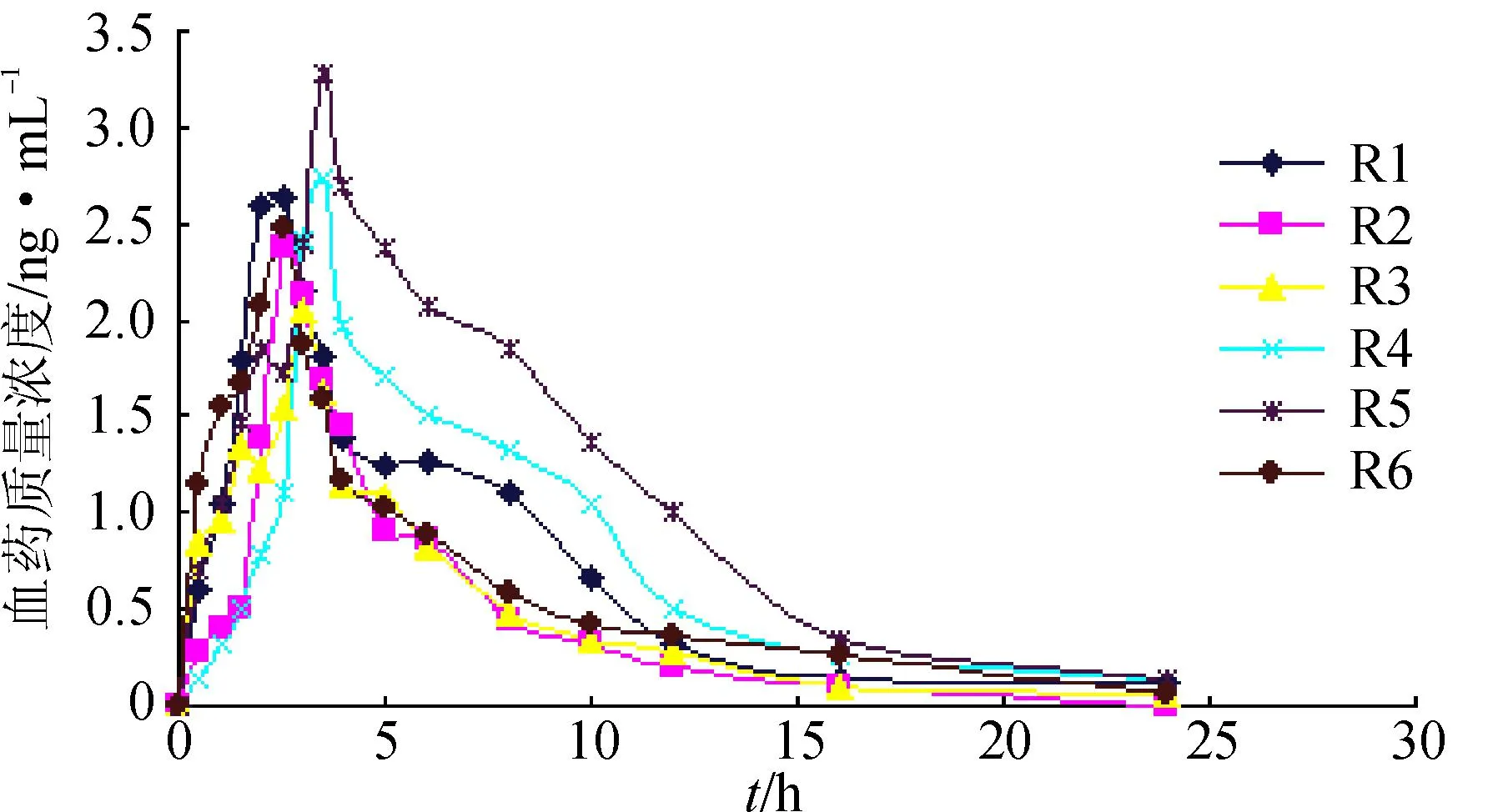
图46只Beagle犬口服参比制剂(2 mg)的药-时曲线
Fig.4 Concentration-time curves of oral reference preparation(2 mg)in 6 dogs
表6Beagle犬口服受试制剂和参比制剂的药代动力学参数(2 mg)
Tab.6 Pharmacokinetic parameters(2 mg) of oral test preparation and reference preparation
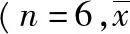
±s)
2种制剂的AUC(0~t)之间无显著差异,将计算的血药质量浓度时间曲线下面积AUC(0~t)数据代入Equ.2,计算受试制剂相对于相同剂量的参比制剂的相对生物利用度Fr为111.48%。
表7AUC(0-t)测定结果与相对生物利用度
Tab.7 Results of AUC(0~t)and relative bioavailability

Beagle犬受试制剂AUC(0~t)参比制剂AUC(0~t)Fr/%118.3816.38112.19216.8810.57159.68317.3611.36152.76315.9117.8689.09523.1425.8489.57615.7114.32109.75均值17.9016.06111.48
4讨论
本实验所研究的盐酸罗匹尼罗渗透泵型控释片(2 mg)与参比制剂罗匹尼罗缓释片(2 mg)(Requip XL)相比,2种制剂在Beagle犬体内的tmax、Cmax、MRT以及AUC(0~∞)等药代动力学参数无显著差异,相对生物利用度Fr为111.48%。
目前报道的测定动物血浆或组织中罗匹尼罗药物浓度的方法有:14C放射性同位素标记法[2]、放射性同位素标识的免疫检定法[3]、高效液相色谱法[4]及高效液相色谱-串联质谱(LC-MS/MS)联用[5-7]等。由于前2种方法在实验室无法实现,而HPLC法要求药物的质量浓度较大,本研究中2 mg的给药剂量无法测定,因此,本研究采用LC-MS测定动物血浆中的药物质量浓度,该方法专属性强、灵敏度高、准确度高,可满足动物血浆中药物质量浓度的检测。
目前治疗帕金森的药物中,拟多巴胺药物最常用的是左旋多巴,可与盐酸罗匹尼罗合用,有文献报道将其制成微囊[8]或胃漂浮片[9],可为帕金森患者提供更多的选择。
参考文献:
[1]美国食品和药物管理局.FDA批准罗匹尼罗缓释片Requip XL[J].世界临床药物,2008, 29 (8):449.
[2]Bloomer J C,Clarke S E,Chenzry R J.Invitroidentificaton of the P450 enzymes for the metabolism of ropinirole[J]. Drug Metab Dispos, 1997,25(7):840-844.
[3]Smithkline French Laboratories Limited.Ropinirole and domperidone of use in the manufacture of a medicament for the treatment of Parkinson′s disease[P].World′s Patent, WO92/00735,PCT/GB91/01121,1992-01-23.
[4]Ramji J V,Keogh J P,Blake T J,et al.Disposition or ropinirole in animals and man[J]. Xenobiotica,1999,29(3):311-325.
[5]丁莉坤,杨林,王茂湖,等. LC-MS/ MS 法测定人血浆中罗匹尼罗及联合多巴丝肼片后的药动学[J]. 中国新药与临床杂志,2013,32(3):240-244.
[6]文慧英,钟晓东,易中宏,等. 高效液相色谱-串联质谱法测定动物血浆中罗匹尼罗的浓度[J]. 光谱实验室,2010,27(6):2139-2145.
[7]文爱东,陈苏宁,杨志福,等. 盐酸罗匹尼罗片的人体药动学[J]. 中国医院药学杂志,2007,27(6):729-731.
[8]李文英,马桂芝,滕亮.左旋多巴微囊制备工艺的研究[J].西北药学杂志,2011,26(6):442-445.
[9]蔡婷婷,侯冬枝,朱超,等.左旋多巴胃漂浮片的制备[J].西北药学杂志,2011,26(1):49-51.
Pharmacokinetic study of controlled release Ropinirole Hydrochloride Osmotic Pump Tablets
ZHANG Wanzhi1,2,WANG Xiuhua1,2,HUI Minquan2,JI Hongmei2,DOU Jianwei1*(1.School of Pharmacy,Xi′an Jiaotong University,Xi′an 710061,China;2.Xi′an Libang Zhaoxin Biological Technology Limited Company,Xi′an 710075,China)
Abstract:ObjectiveTo establish a determination method of ropinirole hydrochloride in animal plasma to evaluate the pharmacokinetics of controlled release Ropinirole Hydrochloride Osmotic Pump Tablets, and to provide the relative bioavailability compared with reference formulation (Requip XLimg) MethodsA single oral dose of controlled release Ropinirole Hydrochloride Osmotic Pump Tablets (test formulation) and Requip XLimg(reference formulation) were administered to six Beagle dogs respectively. The concentration of ropinirole hydrochloride in Beagle dog plasma was analyzed by LC-MS. The pharmacokinetic parameters and relative bioavailability were calculated. ResultsThe main pharmacokinetic parameters of reference formulation and tested formulation were as follows: tmaxwere (2.92±0.49) and (3.58±0.49) h,respectively;Cmaxwere (2.60±0.41) and (2.35±0.39) ng·mL-1,respectively; MRT were (7.76±0.89) and (8.48±0.59) h,respectively; t1/2(Ke) were (4.70±0.67) and (5.94±1.19) h, respectively; AUC(0-) were (16.06±5.55and (17.90±2.75) ng·mL-1·h,respectively; AUC(0-∞)were (16.71±5.87) and (19.03±3.08) ng·mL-1·h,respectively. The relative bioavailability of the test formulation and reference formulation was 111.48%. ConclusionThe results suggested that the main pharmacokinetic parameters have no significant difference. The method established can be used to determine the concentration of ropinirole hydrochloride in plasma and to evaluate the pharmacokinetics and relative bioavailability in animal studies.
Key words:ropinirole hydrochloride;controlled release osmotic pump tablets;pharmacokinetics;relative bioavailability;LC-MS
(收稿日期:2015-08-22)
*通信作者:窦建卫,男,博士,副教授,硕士研究生导师
作者简介:张婉直,女,在读硕士研究生,工程师
基金项目:陕西省社会发展科技攻关项目 (编号:2015SF082)
中图分类号:R945
文献标志码:A
文章编号:1004-2407(2016)02-0172-05
doi:10.3969/j.issn.1004-2407.2016.02.018

