刺糖多糖免疫活性的初步研究
赵 津,常军民,郑 杰,程煜凤,李改茹(新疆医科大学药学院,乌鲁木齐 830054)
·药理·
刺糖多糖免疫活性的初步研究
赵津,常军民,郑杰,程煜凤,李改茹*(新疆医科大学药学院,乌鲁木齐830054)
摘要:目的研究刺糖多糖对免疫抑制小鼠的免疫调节作用。方法采用水提醇沉法得刺糖多糖。建立免疫抑制小鼠动物模型,小鼠灌胃刺糖多糖,利用碳粒廓清实验测定非特异性免疫功能;血清溶血素实验反映抗体生成水平;测定血清中细胞因子的生成水平来评价刺糖多糖的免疫活性。结果刺糖多糖可以增强免疫抑制小鼠的碳粒廓清能力和血清溶血素水平,能够提升由环磷酰胺造成的免疫抑制小鼠血清中IL-2、IL-10的含量。结论刺糖多糖对免疫抑制小鼠免疫功能有促进作用。
关键词:刺糖多糖;水提醇沉;免疫活性
刺糖(Saccharumalhagi)是豆科植物蝶形花亚科骆驼刺属,由骆驼刺叶子中的分泌液凝结成的糖粒,黄白色,一般呈圆形或椭圆形,气微,味甜,它的主要成分是糖类物质。一般生长于荒漠、半荒漠区,在我国主要分布在新疆、甘肃、宁夏及内蒙古地区。具有滋补强壮、益精壮阳、祛痰止咳、消肿止痛等功效,维吾尔医常用之与其他药材配伍使用,治疗痢疾、腹泻、胃胀等疾病[1]。
多糖(polysaccharides)是天然大分子化合物,糖类在人体内的主要作用是提供能量资源,维持生命活动的正常运转。研究发现,植物多糖具有免疫调节作用,可作为广谱免疫促进剂,激活巨噬细胞、淋巴细胞等多种免疫细胞,增强其分泌细胞因子的能力,从而提高细胞的活性,进一步加强免疫作用;还具有抗肿瘤、抗病毒、抗感染、降血脂、促进蛋白质生物合成的作用,同时多糖作为药物具有天然无毒性的功效,因此广泛受研究专家的重视[2-4]。本文研究了刺糖多糖对免疫低下型小鼠的影响,希望为刺糖的进一步研究和开发奠定基础。
1仪器与材料
1.1仪器AB135-S型分析天平(北京赛多利斯天平有限公司);Multifuge X3R型离心机(赛默飞世尔科技有限公司);Szz PC型紫外分光光度计(上海棱光技术有限公司);Model 680型酶标仪(伯乐生命医学产品有限公司)。
1.2试药刺糖(购于新疆民族医院);注射用环磷酰胺(江苏恒瑞医药股份有限公司,批号14022525);盐酸左旋咪唑片(山东仁和堂药业有限公司,批号130105);墨汁稀释液:临用前,将墨汁用生理盐水稀释4倍,即得;鸡红细胞悬液(CRBC):鸡血约10 mL,用肝素抗凝,再加入等体积9 g·L-1的氯化钠注射液,混匀并多次洗涤,以3 000 r·min-1离心15 min,弃上清液,继续洗涤2~3次,取离心后的红细胞4 mL,加入9 g·L-1氯化钠注射液16 mL,现配现用;豚鼠血清稀释液:豚鼠3只,取血,离心,冷藏保存,临用前加生理盐水稀释10倍,即得。
1.3动物清洁级昆明种小鼠,体质量18±2 g,雌雄各半,由新疆医科大学实验动物中心提供,动物合格证号:SYXK(新)2011-0001,室温环境下饲养,自由饮食、进水。
2实验方法
2.1水提醇沉法提取分离刺糖多糖将药材置于圆底烧瓶中,加入石油醚,60 ℃恒温水浴回流2 h,脱脂,将滤渣加入乙醇,80 ℃恒温水浴中回流2 h, 除去小分子醇溶物,挥干溶剂,将滤渣加蒸馏水回流提取,浓缩滤液,800 g·L-1乙醇醇沉,干燥,得粗多糖[1]。
2.2动物分组及给药方法取实验小鼠,随机分成6组,模型组、空白对照组、阳性对照组及刺糖多糖高(800 mg·kg-1)、中(400 mg·kg-1)、低剂量(200 mg·kg-1)治疗组,每组8只。空白对照组给予生理盐水,阳性对照组给予左旋咪唑(50 mg·kg-1),治疗组分别给予不同浓度刺糖多糖提取物,每天灌胃给药1次,连续12 d。给药当天起,模型组、阳性对照组和治疗组同时腹腔注射CTX(50 mg·kg-1),而空白对照组用相同方法注射生理盐水,连续3 d。
2.3对碳粒廓清功能的影响小鼠在第12天给药后禁食不禁水12 h,分别称定小鼠质量,并在每只鼠的尾静脉注射0.2 mL墨汁稀释液。分别在注射后2和10 min,用提前经肝素处理的定量毛细管从小鼠眼眶取血40 μL,溶于4 mL 1 g·L-1的碳酸钠溶液,将溶液与所取血液混匀。在680 nm 处用紫外分光光度计测定吸光度Al和A2,以碳酸钠溶液为空白对照。脱臼处死小鼠,摘取胸腺、脾脏,称定小鼠质量,根据公式计算脏器指数,并用吞噬指数表示小鼠碳粒廓清能力[5-7]。
脏器指数=脏器质量(mg)/小鼠体质量(g);碳粒廓清率K=(lgA1-lgA2)/ (T2-T1);吞噬指数=K1/3×体质量/(肝质量+脾质量)。
2.4对血清溶血素含量的影响在给药第5天时,各组小鼠每只均腹腔注射鸡红细胞悬液0.2 mL。第12天给药后禁食不禁水12 h,摘眼球取血,并离心收集血清,加生理盐水稀释100倍,取经生理盐水稀释的血清l mL,与鸡红细胞悬液、豚鼠血清稀释液各0.5 mL混合,在37 ℃恒温箱中孵育30 min后,放入0 ℃冰箱终止反应。然后离心,吸取上清液,在540 nm 处比色,将不加小鼠血清的空白对照管调零,测定吸光度,以吸光度读数作为判定血清溶血素的指标,比较各组的差异[8-10]。
2.5指标检测小鼠在末次给药后禁食不禁水12 h,分别称定小鼠体质量,脱臼处死小鼠,摘眼球取血,按组别装入EP管,静置后,4 ℃ 以3 000 r·min-1离心15 min,取血清,分装,-20 ℃保存,测定细胞因子[11-12]。采用ELISA法,按照试剂盒说明书进行操作,分别将小鼠血清以及不同浓度的对照品加入96孔微孔板的相应待测孔中,每孔50 μL,加样时尽量不触及孔壁,轻轻晃动混匀,用封板膜封板后置于37 ℃中温育30 min;弃去液体,甩干,每孔加洗涤液300 μL,静置30 s后弃去,如此重复5次,拍干;每孔加入酶标试剂50 μL,空白孔除外;37 ℃温育30 min;弃去液体,甩干,每孔加洗涤液300 μL,静置30 s后弃去,如此重复5次,拍干;每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,37 ℃避光显示15 min;每孔再加入终止液50 μL;以空白孔调零,450 nm波长测量各孔的A值[13]。以标准物的浓度为横坐标、A值为纵坐标,分别得出IL-2、IFN-γ、IL-10、IL-6的线性回归方程为Y=0.001 3X-0.212 4(r=0.998 1),Y=0.002 2X+0.032 4(r=0.995 5),Y=0.004X-0.100 3(r=0.997 4),Y=0.036 9X+0.130 5(r=0.995 0)。
3结果
3.1对小鼠巨噬细胞吞噬功能的影响见表1。由表1可见,经环磷酰胺构建的模型组,其碳粒廓清率和吞噬指数均低于空白对照组(P<0.05,P<0.01),说明环磷酰胺能显著降低小鼠的碳粒廓清能力和巨噬细胞的吞噬功能;阳性药组的碳粒廓清能力和吞噬指数均明显高于模型组(P<0.05,P<0.01),说明所选用的阳性药左旋咪唑能明显增强小鼠的碳粒廓清能力和吞噬功能,并能使其恢复到正常水平;高剂量组刺糖多糖与模型组比较,碳粒廓清率和吞噬指数均有统计学意义(P<0.01),说明刺糖多糖能够增强小鼠碳粒廓清功能和吞噬功能,并与剂量呈正比。
表1刺糖多糖对小鼠碳粒廓清能力和吞噬功能的影响
Tab.1 Effects of polysaccharides fromSaccharumalhagion carbon granular clearance function and phagocytic function in mice
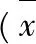
±s,n=8)
注:与空白对照组比较*P<0.05,**P<0.01;与模型组比较△P<0.05,△△P<0.01。
3.2 对小鼠免疫器官的影响 见表2。由表2可见,模型组的胸腺指数和脾指数明显低于空白对照组(P<0.01),说明环磷酰胺能够造成小鼠免疫器官的萎缩;阳性药组的胸腺指数和脾指数均高于模型组(P<0.01),基本恢复到正常水平,说明阳性药左旋咪唑能对抗环磷酰胺引起的小鼠免疫器官萎缩;低剂量组刺糖多糖与模型组比较,无统计学差异,但是中、高剂量组刺糖多糖与模型组比较差异均有统计学意义(P<0.05,P<0.01),说明刺糖多糖能够对抗由环磷酰胺引起的小鼠胸腺萎缩和脾萎缩。
表2刺糖多糖对小鼠免疫器官的影响
Tab.2 Effects of polysaccharides fromSaccharumalhagion the immune organ in mice

±s,n=8)
注:与空白对照组比较*P<0.05,**P<0.01;与模型组比较△P<0.05,△△P<0.01。
3.3对小鼠溶血素水平的影响见表3。由表3可见,模型组与空白对照组比较,其溶血素水平显著降低(P<0.01),说明环磷酰胺能够影响小鼠的血清溶血素水平,对小鼠的体液免疫功能有抑制作用;阳性药组的溶血素水平比模型组高(P<0.05),说明所选用的阳性药左旋咪唑能够明显提升小鼠的血清溶血素水平,将其恢复到正常水平;低、中剂量组的刺糖多糖与模型组和空白对照组比较,无统计学差异,但是高剂量组和模型组比较(P<0.01),有统计学差异,能够增强小鼠血清溶血素水平;随着剂量的增加,血清溶血素水平也逐渐增高,具有一定的量效关系。
表3刺糖多糖对小鼠溶血素水平的影响
Tab.3 Effects of polysaccharides fromSaccharumalhagion hemolysin level in mice
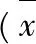
±s, n=8)
注:与空白对照组比较*P<0.05,**P<0.01;与模型组比较△P<0.05,△△P<0.01。
3.4对小鼠血清中细胞因子含量的影响见表4。由表4可见,环磷酰胺构建的模型组,其IL-2、IFN-γ、IL-10和 IL-6均低于空白对照组,差异有统计学意义(P<0.05,P<0.01);阳性药组与模型组比较,A值也明显升高,差异有统计学意义(P<0.05,P<0.01),说明所选用阳性药左旋咪唑能增加免疫抑制小鼠血清中细胞因子的含量;刺糖多糖低、中剂量组与模型组比较,差异较小,无统计学意义;而刺糖多糖高剂量组与模型组比较,IL-2和IL-10明显升高,差异有统计学意义(P<0.01),IFN-γ和IL-6则仅有较小的提升。综上所述,刺糖多糖对环磷酰胺引起的免疫抑制小鼠血清细胞因子的含量有提升作用。
表4刺糖多糖对小鼠细胞因子的影响
Tab.4 Effects of polysaccharides fromSaccharumalhagion hemolysin level in mice
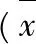
±s, n=8)
注:与空白对照组比较*P<0.05,**P<0.01;与模型组比较△P<0.05,△△P<0.01。
4讨论
本实验采用经典的免疫学研究方法,用环磷酰胺造免疫抑制小鼠动物模型,灌胃给药,观察灌服不同剂量多糖的免疫抑制小鼠的碳粒廓清功能和吞噬指数。实验结果表明,刺糖多糖能对抗免疫器官萎缩,增强免疫抑制小鼠的吞噬指数(P<0.05)。
溶血素是一种抗红细胞抗体,动物血清与鸡血红细胞一起可以产生溶血现象,通过这个过程中释放的血红蛋白量可以确定溶血素的含量,进而反映小鼠合成抗体的能力,可以依此评价小鼠的体液免疫。研究结果表明,刺糖多糖可以增强体液免疫,提升免疫抑制小鼠的血清溶血素水平(P<0.05)。
多糖可以通过激活免疫细胞,诱生多种细胞因子作用于免疫系统,IL-2是辅助性T细胞分泌的一种调节免疫应答的重要介质,通过对IL-2的含量测定,也从分子水平反映了机体免疫功能的状态[14-15];IFN-γ主要是由活化的Th1细胞产生的重要的细胞因子之一,可以有效地促进细胞免疫功能,IL-10是免疫和炎症抑制因子,IL-6主要是由巨噬细胞、T细胞等多种细胞产生,可以调节免疫应答功能[16-17]。本实验研究结果表明,刺糖多糖能够增强由环磷酰胺造成的免疫抑制小鼠血清中IL-2和IL-10的含量,而对IFN-γ和IL-6的含量没有显著的提升。
机体免疫力低下是由多种因素引起的,多糖作为一种植物性中药,可以增强细胞免疫和体液免疫,作为免疫调节剂。刺糖在新疆维吾尔医院中常作为一味增强机体免疫力的维药。本研究表明,刺糖多糖对非特异性免疫、体液免疫和细胞免疫均有促进作用,具有良好的开发前景。
参考文献:
[1]吴晶,李改茹,常军民.刺糖中多糖的提取工艺研究[J].中成药,2011,33(5):902-904.
[2]秦洁华,李雪华,肖庆,等.龙眼壳多糖含量的测定及其免疫活性研究[J].西北药学杂志,2010,25(2):110-112.
[3]Wang Yuefei,Wang Jie,Wu Jing,et al.In vitro antioxidant activity and potential inhibitory action against α-glucosidase of polysaccharides from fruit peel of tea(CamelliasinensisL.)[J].J Zhejiang Univ Sci B,2014,15(2):173-180.
[4]Yi Ran,Liu Xiaomin,Dong Qi.A study of lycium barbarum polysaccharides(LBP) extraction technology and its anti-aging effect[J].Tradit Complement Altern Med,2013,10(4):171-174.
[5]张梅,雨田,苏筱琳,等.川明参多糖的理化性质和免疫活性研究[J].华西药学杂志,2007,22(4):396-398.
[6]买尔旦·马合木提,古丽仙·胡加,米克热帕·阿布都买买提.新疆紫草免疫活性有效部位的初筛[J].新疆医科大学学报,2013,36(12):1724-1727.
[7]盛玉青,尹鸿萍.螺旋藻多糖硫酸酯抗肿瘤及免疫活性的研究[J].中国医院药学杂志,2008,28(9):724-727.
[8]张庭廷,聂刘旺,刘爱民,等.金樱子多糖的免疫活性研究[J].中国实验方剂学杂志,2005,11(4):55-58.
[9]仰榴青,茆广华,吴向阳,等.银杏外种皮多糖的免疫活性研究[J].时珍国医国药,2009,20(4):872-873.
[10]张振凌,吴筱菁,王磊,等.中药猫爪草有效部位的免疫活性研究[J].中华中医药杂志,2007,22(2):120-122.
[11]李珂珂,栾希英,刘现兵.拳参水提物对小鼠免疫功能的影响[J].中药材,2010,33(8):1302-1306.
[12]Razali F N,Ismail A,Abidin N Z,et al.Stimulatory effects of polysaccharide fraction fromSolanumnigrumon RAW 264.7 murine macrophage cells[J].PLoS One,2014,9(10):e108988.
[13]Sun S,Zheng K S,Zhao H,et al.Regulatory effect of astragalus polysaccharides on intestinal intraepithelial γδ T cells of tumor bearing mice[J].Molecules,2014,19(9):15224-15236.
[14]汤伟.丹参多糖的分离纯化及免疫活性研究[D].广州:南方医科大学,2011:45-48.
[15]晏继红,王仕宝,刘文虎.中药免疫增强剂研究进展[J].西北药学杂志,2013, 28(5):549-552.
[16]朱银玲.杨桃多糖的提取及免疫活性研究[D].广州:广东工业大学,2008:29-32.
[17]况炜,陈慧玲,章皓,等.羊栖菜多糖免疫调节活性的实验研究[J].实用医学杂志,2012,28(23):3872-3873.
Preliminary study on the immune activity of polysaccharides fromSaccharumalhagi
ZHAO Jin, CHANG Junmin, ZHENG Jie, CHENG Yufeng, LI Gairu*(Xinjiang Medical University, Urumqi 830054, China)
Abstract:ObjectiveTo assess the immunomodulation effects of polysaccharides from Saccharum alhagi in immunosuppression mice. Methods The polysaccharides were extracted with water,and precipitated with ethanol from Saccharum alhagi. Immunosuppression mice model was induced by cyclophosphamide,and intragastrically administered with polysaccharides from Saccharum alhagi. Nonspecific immune function was evaluated by the carbon granular clearance test, antibody level by hemolysin test and cell factor determination,including IL-2,IL-6,and IL-10. Results Polysaccharides from Saccharum alhagi could enhance carbon granular clearance and hemolysin levels in immunosuppression mice,and also increase the content of IL-2 and IL-10. Conclusion The polysaccharides from Saccharum alhagi showed strong immune activities to immunosuppression mice.
Key words:polysaccharides from Saccharum alhagi;water extraction and alcohol precipitation;immune activities
(收稿日期:2015-07-17)
*通信作者:李改茹,女,副教授
作者简介:赵津, 女, 硕士研究生
基金项目:国家自然科学基金项目(编号:81460633)
中图分类号:R965
文献标志码:A
文章编号:1004-2407(2016)02-0158-04
doi:10.3969/j.issn.1004-2407.2016.02.014

