检测子宫内膜异位症中PI3K/Akt通路和VEGF的临床意义
李燕 朱君 黄彩彩

【摘要】目的:探讨子宫内膜异位症患者中血管内皮生长因子(VEGF)、磷脂酰肌醇-3 激酶/蛋白激酶B(PI3K/Akt)表达水平及其与血管生成的关系,并且探讨VEGF与PI3K在调控血管生成过程中的相互关系。方法:利用S-P方法对32例EM手术标本和30例子宫肌瘤中VEGF、Akt及微血管密度(MVD)的表达进行检测。结果:EM中正常内膜、在位内膜和异位内膜Akt、VEGF 阳性表达率分别为 200%(6/30)、375%(12/32)、844%(27/32)、600%(18/30)、750%(24/32)、875%(28/32);EM中正常内膜、在位内膜和异位内膜MVD分别是(1037±524)、(1914 ± 710)、(4824±1054)。Akt、VEGF和血管密度在EM中异位内膜较正常内膜组高表达,在调控血管生成过程中,Akt与VEGF呈正相关。结论:PI3K/Akt、VEGF 均参与EM的发生发展,在EM血管生成中发挥关键作用,共同参与EM过程。
【关键词】子宫内膜异位症;磷脂酰肌醇-3激酶/蛋白激酶B;血管内皮生长因子
【中图分类号】R711【文献标志码】A
子宫内膜异位症(endometriosis,EM)是育龄女性的妇科疾病之一,在经期引起慢性盆腔痛,影响患者的身心健康。血管生成与EM的发生发展密切相关,血管内皮生长因子(VEGF)是关键的促血管生成因子。EM是良性的妇科疾病,但其特点,具有类似恶性肿瘤远处转移和种植生长能力,由此推断,它的发病机制可能与恶性肿瘤存在某些共同之处。在恶性肿瘤中,PI3K/AKT信号通路调控异常,上调VEGF表达,增加肿瘤血管形成。本研究拟采用EM的在位子宫内膜和异位内膜以及正常子宫内膜,S-P方法检测VEGF和Akt蛋白表达,了解EM中PI3K/Akt和VEGF是否参与EM的发生发展,为EM的防治提供新思路和理论根据。
1资料和方法
11一般资料
于2013年2月至2014年2月入院的在我院行手术治疗、术后病理检查确诊为EM的患者中随机抽取32例,选择的患者月经周期均规则,无生殖内分泌疾病、急慢性盆腔炎、妇科恶性肿瘤及宫内节育器放置术等,术前6月没有进行过激素类药物治疗史,没有子宫内膜病变。收集患者的异位和在位内膜作为实验组;收集无EM患者30例,取其内膜组织作为对照组。无EM患者的年龄平均约(3363±23)岁。患有EM的患者年龄平均约(354±27)岁。经检验,两组的患者在年龄、体重、月经周期和AFS分期的差异无统计学意义,各组内的平均年龄构成无统计学差异。收集的病理切片由病理科专家确诊为EM。该实验经本医院医学伦理委员会审批通过,标本收集前均与患者签订知情同意书。
12方法
121标本采集取患有EM患者的子宫内膜组织、异位内膜组织以及无EM患者的子宫内膜,10%甲醛固定,脱水、浸腊和包埋。每份标本行HE染色后,光镜下观察组织学形态,入选标本镜下检查找到内膜腺体和间质细胞。
122方法试剂均购自上海北诺生物科技有限公司,兔抗人Akt单克隆抗体(LS-C50301);兔抗人VEGF 单克隆抗体(PA116948)、鼠抗人 CD34 单克隆抗体(MA137329),操作步骤按试剂盒说明书进行。
123结果判定VEGF 和Akt的S-P染色主要表现在腺上皮的胞质,部分在间质细胞,片状或颗粒状、深或浅棕黄色的染色被定义为阳性细胞。采取半定量方法计算阳性细胞的平均百分率,具体方法:在每张切片中采集5个高倍镜视野,并且随机计数约100个细胞,统计并计算每个视野下阳性细胞占100各细胞的平均百分比;阳性细胞数 <10%的定义为(-);在 10%~30% 之间的定义为(+);在30%~70%的定义为 (++);在70%以上的定义为 (+++)。CD34 抗体可用作有效地统计微血管密度(MVD)的指标,并用作定量统计,用低倍镜下挑选出最高的MVD 区,显微镜下计数5个满视野的微血管数量,求平均值,即可认为是该EM的平均微血管数目[1]。
13统计学方法
采用SPSS 130统计软件,计数资料采用χ2检验,多组间比较用单因素方差分析,变量间的相关分析选用非参数统计方法,按α=005的水准,P<005则表明,拒绝零假设,说明差异有统计学意义。
2结果
表1说明:(1)VEGF、Akt、MVD在正常内膜、EM在位内膜及异位内膜组织的表达差异有统计学意义;(2)Akt、VEGF 在异位内膜较在位内膜组织及正常内膜高表达,说明Akt、VEGF可能对EM的发生、发展存在影响;(3)MVD在异位内膜高表达,说明新生血管对肿瘤的发生、转归有关键作用。
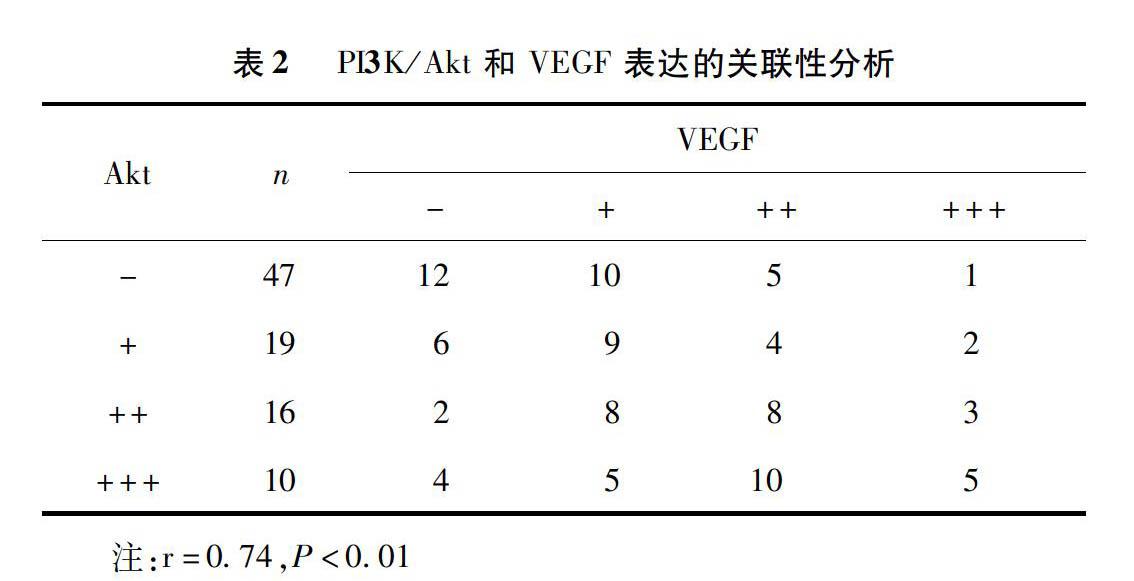
表2说明:在促进血管生成的过程中,Akt与VEGF呈明显正相关,PI3K/Akt信号通路促进肿瘤血管生成,可能通过促进VEGF的表达来实现。
3讨论
子宫内膜异位症是具有生长功能的子宫内膜组织碎片出现在子宫腔及子宫肌层以外的其他部位,以痛经和不孕为主要临床症状。在育龄女性中的发生率约为15%,严重影响患者的生活质量[2] 。不孕和盆腔痛的妇女发病率可增长至35%~50%。EM表现为子宫内膜腺体和间质出现在子宫体以外的部位,随卵巢激素变化,发生周期性出血。50%的妇女不孕不育与50%~60%患有慢性盆腔痛的育龄女性常患有EM。其病变广泛,周围纤维组织增生、粘连、散在褐色结节,形态多样,并向直肠子宫陷凹深部浸润,随卵巢激素的周期性变化,有增生和分泌改变,易复发,很少癌变[3]。
EM是一种依赖卵巢雌、孕激素的疾病,对Ⅲ、Ⅳ期患者,根据情况,采用保留生育功能手术或保留卵巢功能或根治性手术,术后采用性激素治疗,减轻患者经期疼痛,延迟复发,增加受孕率,但无法彻底治愈[4]。
EM发病机制中“经血逆流”是主导学说,但近年证实,90%女性均有经血逆流,但其中只有10%女性发生EM[5]。说明经血逆流只是病因,而子宫内膜在腹腔内种植,血液供应的建立和支持是必不可少的。
血管生成与EM的发生和发展密切相关,最重要的促血管生成因子是VEGF[6]。VEGF具有促血管形成的功能[7],VEGF是高度特异性的血管内皮细胞有丝分裂原,在月经周期中,参与子宫内膜血管的形成。在病理情况下,VEGF与血管过度生成有密切关系。VEGF的主要生理功能有[8,9]:(1) 促进细胞的有丝分裂,降解细胞外蛋白和基底膜,从而使血管内皮细胞迁移并增生;(2)增加血管的通透性,为血管芽延伸生长提供良好基质;(3)在细胞浆内,快速短暂地增加钙离子浓度,刺激磷脂酰肌醇的磷酸化,上调信号通路的表达。
VEGF与受体结合后具有生物活性,Flk-1/KDR与VEGF结合后诱导血管生成的能力最强。VEGF的表达常出现在感染性疾病、肿瘤、伤口愈合、排卵,月经和胚胎发育等。有研究表明:在正常内膜组织中,VEGF的表达低于EM的异位内膜、在位内膜及腹腔液中,表明EM与VEGF的过表达有关。
细胞内重信号转导通路之一PI3K/Akt信号通路调控细胞的增殖、向不同方向分化以及细胞凋亡。Kayisli[10]和Quezada[11]均证实了PI3K/Akt通路参与调节细胞增生和子宫内膜自身稳态调节。
PI3K/Akt信号通路由PI3K家族与其下游分子丝氨酸/苏氨酸蛋白激酶Akt或蛋白激酶B(PKB)组成。Akt由3部分构成:即氨基端的PH结构域、中间的激酶活性区及羧基端的尾部。PI3K/Akt信号转导通路中起关键作用的是Akt蛋白激酶,Akt的磷酸化有利于Akt达到最大活化效应[12]。
PI3K/Akt信号转导通路被上调激活后,诱发细胞无限增殖和凋亡抵抗,故该通路与各种肿瘤的发生发展有关[13]。Gordan等[14]研究表明,PI3K/Akt信号通路可通过多种途径上调低氧诱导因子-la (HIF-la)的表达。HIF-1a可促进VEGF的表达,而VEGF可通过其本身和活化PI3K/Akt信号通路两种途径促进血管形成。PTEN则通过阻滞PI3K/Akt信号通路抑制血管形成[15]。
各项研究证明,在多种肿瘤组织中,出现PI3K/Akt信号通路上调,诱使细胞恶变、癌细胞存活、抑制其凋亡、加快肿瘤血管的形成、促进肿瘤细胞的增殖、向深层浸润、肿瘤转移以及增加肿瘤细胞耐药[16]。
本实验初步证明:(1)EM异位内膜组织中微血管密度(MVD)较在位内膜及正常内膜组织高,差异有统计学意义。说明血管生成确实对EM的发生、发展过程有重要的影响;(2)EM异位内膜组织中 Akt、VEGF的表达较在位内膜及正常内膜组织高,差异有统计学意义。说明PI3K/Akt、VEGF 对EM的发病、转归有重要作用;(3)Akt阳性表达组中,VEGF也高表达;Akt表达阴性组中,VEGF也低表达,差异有统计学意义。说明在EM的生物学过程中,Akt与VEGF呈正相关。PI3K/Akt可能通过VEGF诱导血管内皮细胞增长,从而促进EM的发生、发展。本研究提示EM血管生成过程中,PI3K/Akt信号转导通路与VEGF 之间呈正相关。能否通过阻断PI3K/Akt信号通路来靶向调控VEGF的表达,从而减少血管生成,降低异位内膜转移、复发机率,有待进一步研究。
参考文献
[1]杜灵彬,毛伟敏,陈万青,等.中国2003-2007年喉癌发病率和死亡率分析.中华流行病学杂志,2012,33(4):395-398.
[2]李雷,冷金花.子宫内膜异位症及其治疗对女性生育影响的研究进展.中国实用妇科与产科杂志,2013,29(5):393-396.
[3]Ren F, Wang D,Jiang Y, et al. Epigenetic inactivation of hMLH1 in the malligant transformation of ovarian endometriosis. Arch Gynecol Obstet,2012,285(1):215-221.
[4]Olovsson M. Immunological aspects of endometriosis: an update. Am J Reprod Immunol, 2011, 66 Suppl 1:101-104.
[5]Hull ML,Charnock-Jones DS, Chan CL, et al. Antiangiogenic agents are effective inhibitors of endometriosis. J Clin Endocrinol Metab, 2003,88(6):2889-2899.
[6]Barcz E, Milewski , Dziunycz P, et al. Peritoneal cytokines and adhesion formation in endometriosis: an inverse association with vascular endothelial growth factor concentration. Fertil Steril, 2012 ,97(6):1380-1386.
[7]Li YZ, Li SL, Li X, et al. Expression of endogenous hypoxia markers in vulvar squamous cell carcinoma. Asian Pac J Cancer Prev, 2012,13(8):3675-3680.
[8]Mahabeleshwar GH, Byzova TV. Angiogenesis in melanoma. Semin Oncol,2007,34(6):555-565.
[9]Walters EH, Reid D, Soltani A, et al. Angiogenesis :a potentially critical part of remoding in chronic airway disease. Pharmacol Ther,2008,118(1):128-137.
[10]Guzeloglu Kayisli O, Kayisli UA, Luleci G, et al. In vivo and in vitro regulation of Akt Activation in human endometrial cells in estrogen dependment. Biol ReProd, 2004,71(3):714-721.
[11]Quezada S, Avellaira C, Johnson MC,et al. Evaluation of steroid receptors,Coregulators and molecules associated with uterine receptivity in secretory endometrial from untreated women with polycystic ovary syndrome.Fertil Steril,2006,85(4):1017-1026.
[12]Nicholson KM, Anderson NG. The Protein kinase B/Akt signalling path way in Human malignaney.Cell Signal,2002,14(5):381-395.
[13]Hanada M, Feng J, Hemmings BA. Structure regulation and function of PKB/AKT-a major therapeutic target. Biochim Biophys Acta, 2004,1697(1-2):3-16 .
[14]Gordan JD, Simon MC. Hypoxia-inducible factors: Central regulators of the tumor phenotype. Curr Opin Genet Dev, 2007,17(1):71-77.
[15]Fang J, Ding M, Yang L, et al. PI3K/PTEN/AKT signaling regulates prostate tumor angiogenesis. Cell Signal, 2007,19(12):2487-2497.
[16]Yousif NG.Fibronectin promotes migration and invasion of ovarian cancer cells through up-regulation of FAK-PI3K/Akt pathway. Cell Biol Int, 2014,38(1):85-91.
(收稿日期:2015-08-20)

