两种不同复合唑来膦酸骨水泥的体外浸提对比实验研究
徐跃王振兴于秀淳*
两种不同复合唑来膦酸骨水泥的体外浸提对比实验研究
徐跃1王振兴2于秀淳3*
目的对比观察不同唑来膦酸含量的两种骨水泥在体外的药物释放情况,为临床应用其治疗骨巨细胞瘤奠定体外药物释放动力学基础。方法将唑来膦酸分别与聚甲基丙烯酸甲酯骨水泥及磷酸钙骨水泥以0.2%、0.4%、0.6%的质量比混合制备复合唑来膦酸骨水泥的测试标本,并同时设立空白对照,所制两种不同骨水泥标本均分成a(空白对照)、b(含0.2%的唑来膦酸)、c(含0.4%的唑来膦酸)、d(含0.6%的唑来膦酸)4组,每组1个标本。将4组标本分别放于5mL生理盐水中,并最终置于智能溶出仪中持续浸提42天,于特定时间点取样待测,用高效液相色谱仪测定浸提液中唑来膦酸的浓度,计算各时点的药物释放浓度和释放总量百分比,并绘制相应曲线。结果 复合唑来膦酸聚甲基丙烯酸甲酯骨水泥的各实验组浸提液色谱图中未发现唑来膦酸吸收峰的出现,而复合唑来膦酸磷酸钙骨水泥的各实验组浸提液色谱图中均可见唑来膦酸吸收峰的出现且各实验组在第42天实验结束时的唑来膦酸累计溶出量百分比:b组>d组>c组。结论 唑来膦酸不能从聚甲基丙烯酸甲酯骨水泥中释放,但可以从磷酸钙骨水泥中释放并最终可以以一稳定药物浓度缓慢、持久释放。
聚甲基丙烯酸甲酯骨水泥;磷酸钙骨水泥;唑来膦酸;药物释放
骨巨细胞瘤是一种常见的原发性骨肿瘤,其术后的局部高复发率一直是治愈骨巨细胞瘤的一大难题。二膦酸盐类药物是目前临床上最为重要的一组治疗由破骨细胞介导以骨吸收为特点的疾病的药物。口服和静脉给药是目前二磷酸盐类药物主要给药途径,存在生物利用度低、服用时间长、治疗费用昂贵、上消化道溃疡等不足。鉴于骨水泥在作为骨缺损修复材料和多种药物缓释系统的载药载体上的成功应用经验,将二者有机的结合起来,制备一种新型的局部药物缓释体系来预防和治疗骨巨细胞瘤术后复发是一种理想的选择,目前尚未有相关临床研究报道。
目前,临床应用较为成熟的骨水泥类型有两种:聚甲基丙烯酸甲酯骨水泥(Polymethylmethacrylate bone cement,PMMA)和磷酸钙骨水泥(Calciumphosphatecement,CPC)。聚甲基丙烯酸甲酯骨水泥作为一种常用的骨科材料具有以下优点:经过多年抗生素骨水泥在临床中的应用经验,已经证实骨水泥是抗生素的良好药物载体;在治疗骨肿瘤类疾病时其聚合反应产生的高热可以有效的杀死瘤腔内残留的肿瘤细胞;骨水泥价格经济合理,不增加患者额外的经济负担。近年来,磷酸钙骨水泥以其在修复骨缺损方面明显的优越性而受到广泛关注。磷酸钙骨水泥具有可以和骨组织结合并逐渐被吸收,最终被新骨组织替代等优良特性。以CPC为载体的药物缓释体系是一种新型的给药方式,植入生物体内骨骼后载体所负载的药物能持续、稳定、高效地缓慢释放,达到修复骨缺损和药物治疗的双重目的[1]。
因此,将二磷酸盐类药物加入到两种骨水泥中制备成以骨水泥为载体的药物缓释体系,来预防和治疗骨巨细胞瘤的术后复发就成为笔者的设想。唑来膦酸作为第3代二磷酸盐类药物的代表药物,以其理化性质稳定、药理作用强大以及临床应用剂量小等优点成为笔者实验选择对象[2]。本文即通过体外浸提实验观察分析两种不同复合唑来膦酸骨水泥体外药物释放特性,来为临床应用复合唑来膦酸骨水泥治疗骨巨细胞瘤奠定体外药物释放动力学的基础。
1 实验材料与方法
1.1 实验材料
唑来膦酸标准品(中国药品生物制品检定所,100mg/支,批号:100778-200501,供HPLC含量测定用);聚甲基丙烯酸甲酯骨水泥(PALACOS Heraeus Medical GmbH, Wehrheim,Germany);磷酸钙骨水泥(粉末型,上海瑞邦生物材料有限公司);紫外分光光度仪(岛津UV-2550型);高效液相色谱仪(安捷伦);酸度计(PHS-3C型);智能溶出试验仪(ZRS-4型);电子天平(BS124S型);移液管;试管;容量瓶;乙腈(国药集团,色谱纯);四氢呋喃(国药集团,色谱纯);磷酸氢二铵(国药集团,分析纯);重蒸馏水;注射用生理盐水。
1.2 实验方法
1.2.1 标本的制备和实验分组
将唑来膦酸分别与聚甲基丙烯酸甲酯骨水泥及磷酸钙骨水泥固相以0.2%、0.4%、0.6%的质量比混合均匀后,按预设液固相比例量加入液相溶液,在室温(25℃)下混合,并搅拌成糊状后分别推入数个直径为0.9cm,高度1.0cm的圆柱体预制塑料模具中,待骨水泥固化完全后,将标本于模具中移出,并修整使其表面平整,边缘光滑;以同样方法制备空白对照,所制两种不同骨水泥标本均分成a(空白对照)、b(含0.2%的唑来膦酸)、c(含0.4%的唑来膦酸)、d(含0.6%的唑来膦酸)4组,每组1个标本(可以颜色区分两种不同骨水泥,聚甲基丙烯酸甲酯骨水泥为绿色,磷酸钙骨水泥为白色,如图1、2,彩图见插页)。
图1 自制复合唑来膦酸聚甲基丙烯酸甲酯骨水泥实验标本

图2 自制复合唑来膦酸磷酸钙骨 水泥实验标本
1.2.2 浸提实验
将盛有标本及5mL生理盐水的密闭试管按实验分组依次将试管编为a-d号,放入盛有50mL生理盐水的溶出瓶中并最终置于智能溶出仪中,将智能溶出仪的温度设置为摄氏37℃,调整转速为25转/分钟,持续浸提42天。于1、2、3、4、5、6、7、9、11、14、17、21、24、28、35、42d时间点分别取样品浸提液2.5mL,储存在离心管中,置于-20℃冰箱中储存待测。每次取样前,将试管取出,都经顺时针方向搅拌溶液10次、逆时针方向10次后再取浸提液。取完浸提液后,试件用生理盐水冲洗3遍,重新更换试管中浸提液后放入溶出瓶中浸提,待下次取样。所有样品待采集完成后,送济南军区总医院药理科制剂室应用高效液相色谱仪检测药物浓度。
1.2.3 浓度检测
所取浸提液中药物浓度,采用高效液相色谱法检测。记录并计算每个实验组每天唑来膦酸的释放量及累计释放量,并与对应时间点绘制药物的释放曲线。
1.2.3.1 检测条件

表1 色谱条件
1.2.3.2 唑来膦酸标准品溶液色谱图
精确称量在120℃环境中干燥至恒重的唑来膦酸标准品10mg,加生理盐水溶解,并定容至100mL容量瓶中,配制浓度为100ug/mL的标准品溶液。依次进样样本溶液10微升并记录色谱图。标准品色谱图见下图所示(图3)。
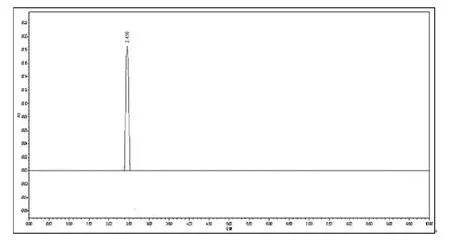
图3 唑来膦酸标准品溶液色谱图,浓度为100ug/mL
1.2.3.3 唑来膦酸浓度与色谱峰面积线性关系的确立[3]
精密称取唑来膦酸标准品约25mg,置100mL量瓶中,加流动相溶解并稀释至刻度,摇匀。采用倍比稀释法配制,浓度分别为2.5、5、12.5、25、50、75和100ug/mL的唑来膦酸标准品溶液,进样 10uL,记录色谱图,量取峰面积,由溶液浓度(C,ug/mL)对峰面积(A)线性回归,得回归方程:A=3802.444C-1241.140,决定系数R2=0.992.做拟合优度检验,F=583.752,<0.001,拟合度很好。结果表明,本品在2.5~100ug/mL浓度范围内,浓度与色谱峰面积线性良好(如图4)。

表2 唑来膦酸标准溶液浓度和峰面积
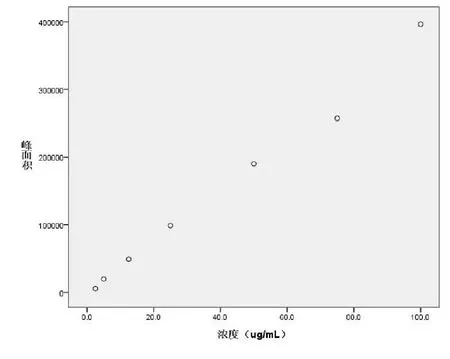
图4 唑来膦酸标准品浓度与对应峰面积关系的散点图
2 结果
2.1 复合唑来膦酸聚甲基丙烯酸甲酯骨水泥实验组样品色谱图
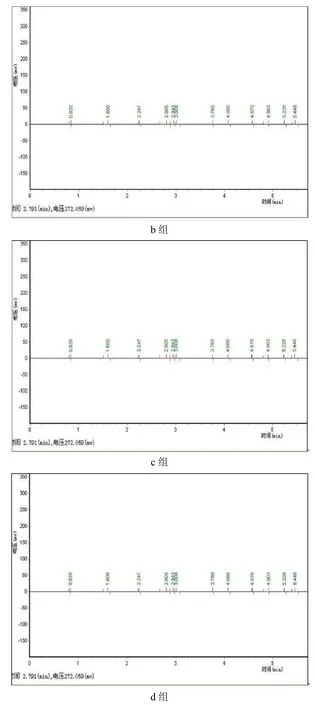
图53 组复合唑来膦酸聚甲基丙烯酸甲酯骨水泥浸提1天后的色谱图
如图3所示,在上述检测条件下流动相基线平稳,标准品溶液的保留时间约为2.45分钟,峰形完好,结果与文献记载相吻合[4]。但是,如图5所示在所有实验组样品溶液检测中,色谱仪记录的图谱均为直线,并没有检测到样品峰。
2.2 复合唑来膦酸磷酸钙骨水泥实验组

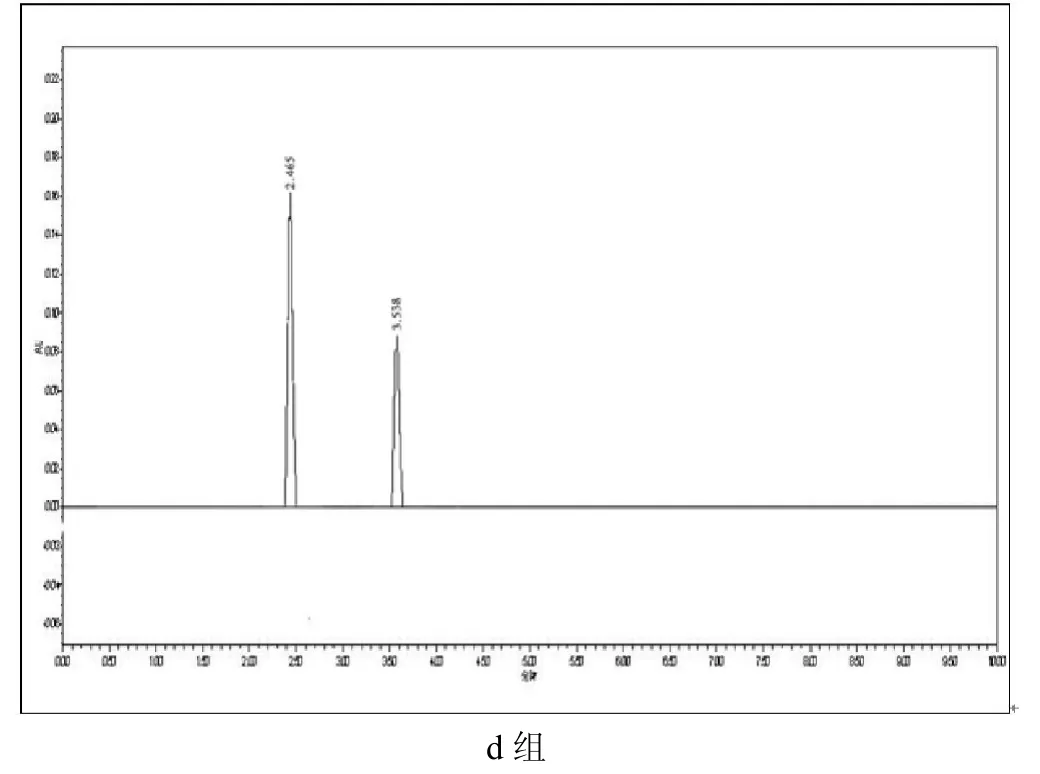
图6 各组复合唑来膦酸磷酸钙骨水泥浸提1天后的色谱图
空白对照组(a组)及实验组(b、c、d组)样品色谱图如图6所示,对照观察各组色谱图,在唑来膦酸标准品溶液出峰位置处(2.45min),b、c、d各实验组均可观察到唑来膦酸吸收峰的出现,详细记录浸提42d中每个实验组在唑来膦酸出峰位置的波峰面积,以便推算唑来膦酸每日的释放浓度。
2.3 各组浸提标本的重量及其中唑来膦酸含量(表3)

表3 各组浸提标本重量(mg)及标本中唑来膦酸含量(mg)
2.4 各组每日唑来膦酸溶出量及释放曲线图
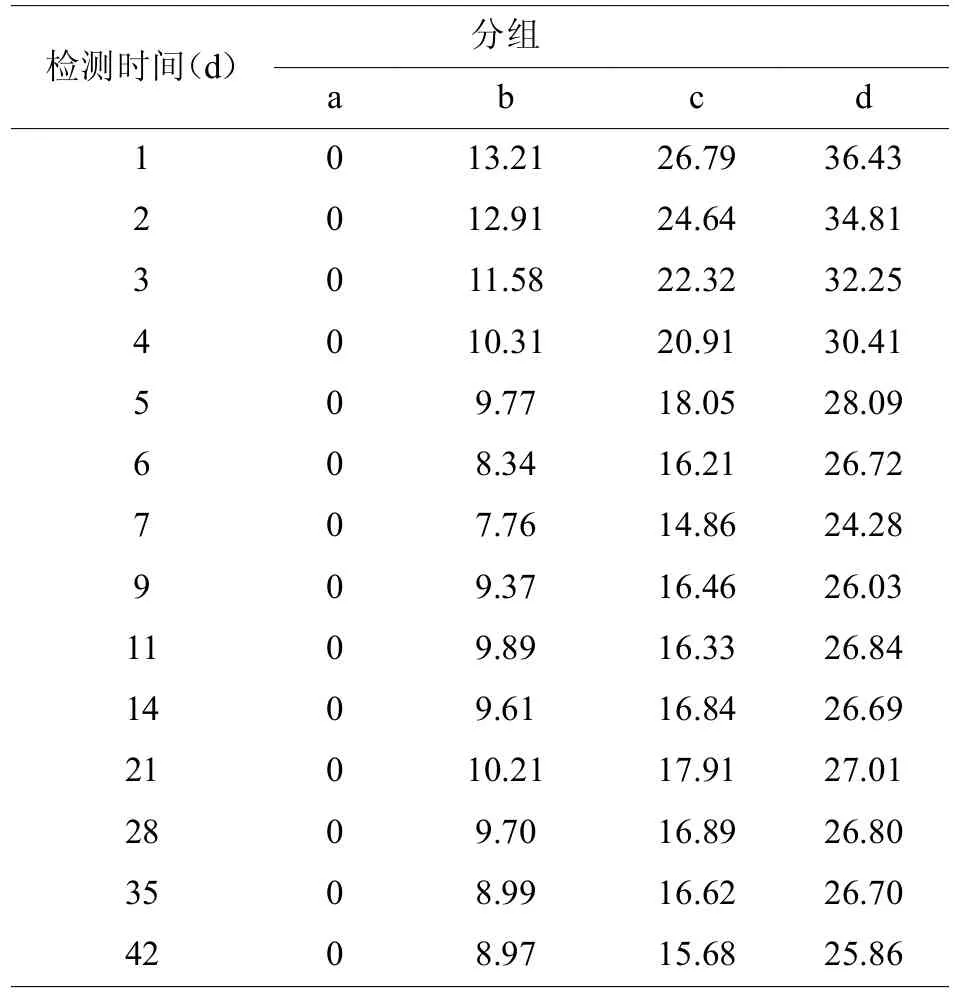
表4 每日唑来膦酸溶出量(ug/mL)

图7 各组每日唑来膦酸溶出量变化趋势
2.5 各组唑来膦酸累计溶出量百分比及变化趋势曲线图
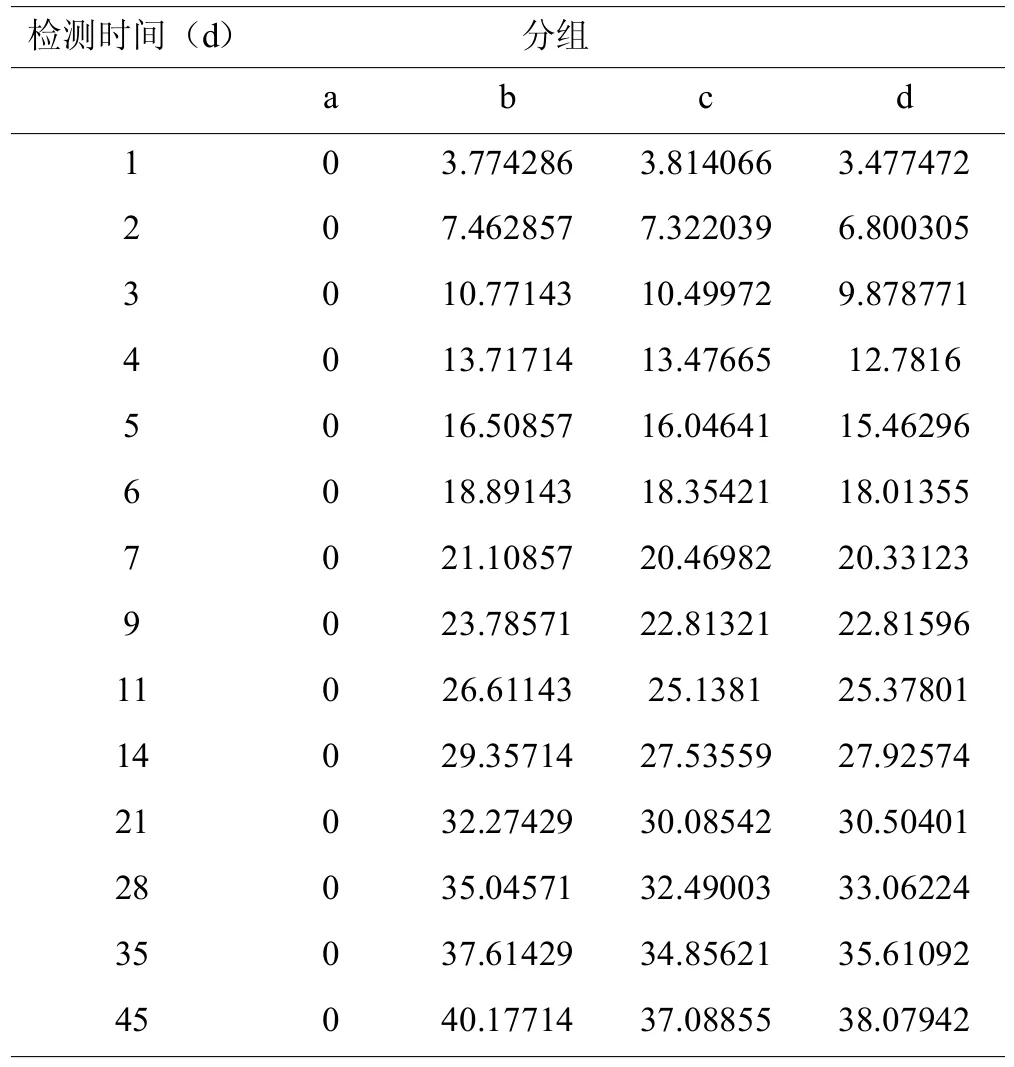
表5 唑来膦酸累计溶出量百分比(%)
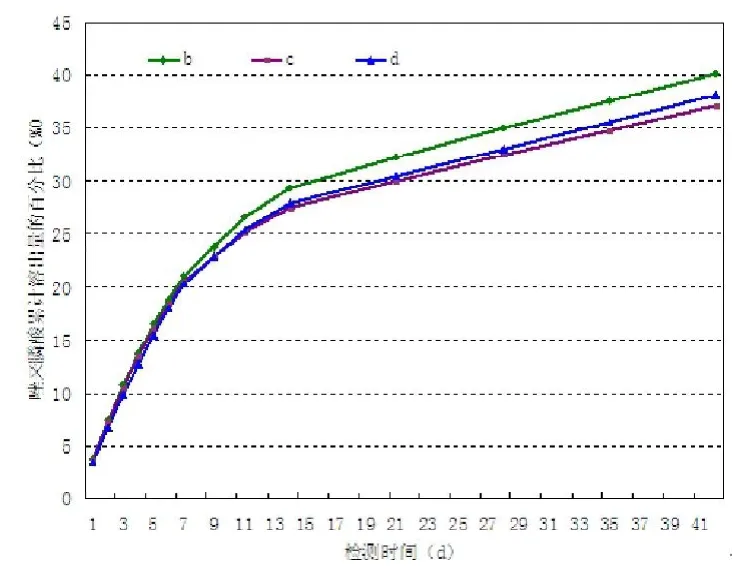
图8 各组唑来膦酸累计溶出量百分比变化趋势
由表5和图8可见,各实验组在不同时间点的唑来膦酸释放总量百分比有如下特点:①各实验组在实验结束的第42天时的药物释放总量百分比:b组>d组>c组。②各实验组的累计药物释放百分比斜率在起初的快速释放期较陡峭,而在后期的缓慢释放期则变得较为平缓(图8彩图见插页)。
3 讨论
3.1 复合唑来膦酸聚甲基丙烯酸甲酯骨水泥
在本次研究中,笔者严格按照文献报道设定实验条件制备复合唑来膦酸骨水泥的实验标本;同时根据文献报道,笔者将浸提液设定为5mL[5],放入智能溶出仪中持续浸提42天。在浓度检测时,笔者选用安捷伦高效液相色谱仪进行标本浓度检测,检测器为紫外光谱检测器,色谱柱为 SHIMADZUVP-ODSC18柱(200mm×4.6mm,5 m),选用乙腈-四氢呋喃-0.05mol/L磷酸氢二铵(4∶1∶100,并用50%的磷酸溶液调节Ph至2.55)为流动相,在对原样品溶液和标准品溶液进行检测后,笔者获得了标准品溶液的色谱图像,根据色谱结果显示,唑来膦酸标准品在该检测条件下保留时间约为2.45分钟,峰形良好。但是在各组样品溶液检测中,检测线均显示为一条直线,并未检测到唑来膦酸。这种结果与大多数学者报道的结果不一致,也与笔者预期的结果相悖。
复合唑来膦酸骨水泥作为一种潜在的药物缓释体系,如何建立一种合适的体外模型对研究它的药释特性事关重要。在本研究中,笔者以生理盐水作为模拟体液,应用智能溶出仪模拟体液在体内的流动,同时将温度设定为37℃,以最大限度的模拟体内环境。有学者报道应用PBS溶液或者是模拟人工体液作为浸提液,研究载药体系的体外药释特性[6]。其中模拟人工体液的配制方法为:模拟体液的配制NaCl 8g、KCl 0.2g、CaCl20.2g、NaHCO31.0g、MgCl2·6H2O 0.1g、NaH2PO40.05g,溶于1000mL水中,盐酸调Ph7.5,定容至1000mL,0.22 m滤膜滤过[6]。唑来膦酸作为二磷酸盐类药物,具有可以和溶液中的多种阳离子螯合形成螯合物的特性,这显然会影响到样品溶液浓度的检测。因此笔者选用生理盐水作为浸提液。第一,生理盐水的渗透压和组织液及血浆的渗透压相似;第二,在临床应用中唑来膦酸也是和生理盐水配伍使用。尽管本次研究并未获得预期结果,但是笔者认为这与浸提液并无直接关系。
在本研究中笔者将4mg唑来膦酸加入到1g骨水泥粉末中,相当于在40g骨水泥粉末中加入160mg唑来膦酸,这个比例是相当高的。而在临床使用过程中4mg已经是唑来膦酸使用的最大安全剂量。在药物比如此大的情况下,笔者仍未能检测到样品中的唑来膦酸,充分说明了在实验条件下,唑来膦酸并未从骨水泥中成功释放出来,或者仅有极少量的释放,难以达到临床使用的有效药物浓度。
虽然在诸多关于抗生素骨水泥的文献报道中,PALACOS[7]骨水泥因其在洗脱率和药代动力学特性上的优异表现被认为是一种理想的药物缓释载体,但是在笔者的研究中并未获得预期结果。在抗生素骨水泥的研究中,骨水泥的表面积和孔隙率是影响抗生素洗脱决定性的因素[8]。一项研究表明增加40%抗生素骨水泥的表面积,可以提高抗生素的释放达20%[9]。有学者认为孔隙率决定了参加洗脱交换的液体量[10],而参与洗脱交换的液体量的多少对于唑来膦酸这种溶解度偏低的物质的溶出释放是至关重要的。在本研究中笔者采用了手工混合的方法来增加骨水泥的孔隙率。研究证明手工混合可以通过增加骨水泥制备过程中截留的气体量提高骨水泥的孔隙率[11]。但是阴性结果提示单纯通过采用手工混合方法制备的骨水泥,其孔隙率不足以达到可以使唑来膦酸从聚甲基丙烯酸甲酯骨水泥中有效溶出的水平。因此笔者认为唑来膦酸直接添加在聚甲基丙烯酸甲酯骨水泥粉体中,并采用手工混合的方法制备复合唑来膦酸骨水泥并不可行。
3.2 复合唑来膦酸磷酸钙骨水泥
县人大常委会坚持把“双联”工作作为提升代表工作水平的重要抓手,突出夯实基层基础工作,使“双联”工作更接地气更富活力。
Urabe等[12]采用高效液相色谱法和微生物分析法研究载万古霉素的CPC和PMMA的药物释放特性,结果显示载药CPC的药物释放量要明显高于载药PMMA,仅第1天药物释放量就相差8倍;载药CPC的药物释放较为平缓,药物释放的持续时间长,约为8周左右,而载药PMMA的药物释放多为呈爆发性的表面释放,持续性差,有效药物浓度的维持多为数日,一般不超过2周。
以CPC为载体的药物缓释体系作为一种新型的给药方式,不同于其他载药系统的是 CPC含有大量的微孔结构,它所载荷的药物能够通过微孔分布于整个骨水泥结构中,而不是单纯的只吸附在材料表面,药物就能随着CPC的缓慢降解而更持久、稳定的缓慢释放[13]。
本实验将唑来膦酸与磷酸钙骨水泥分别以0.2%、0.4%、0.6%的质量比混合均匀后,制备出复合唑来膦酸的磷酸钙骨水泥标本,并通过体外的生理盐水浸提实验首次证实了唑来膦酸可从磷酸钙骨水泥中缓慢释放,释放过程符合多空隙性材料的释放特点,大致可分为3期:快速释放期(约6天左右)、过渡期(约4天左右)和缓慢释放期。
Yang等[14]研究载甲氨蝶呤CPC的药物释放,发现初始阶段甲氨蝶呤的释放呈爆发式,而后快速下降,但仍能维持最小释放浓度长达2~4月。
大量研究发现载药CPC的药物释放初期通常会有突释现象,这与吸附在CPC表面的药物先释放有关,随着时间的延长药物释放速率也逐渐减慢,药物在平均100小时后释放速率显著减慢,此后以较慢的释放速率维持释放较长一段时间,甚至长达数月[15]。
结合本实验中的各实验组唑来膦酸累计溶出量百分比变化趋势图所示:各实验组唑来膦酸累计溶出量百分比斜率即药物释放速率在6天左右的快速释放期内较为陡峭,而在缓慢释放期则变得较为平缓,这同样也说明复合唑来膦酸CPC的药物释放在前期存在突释现象,而后期则显著减慢。
CPC药物缓释载体系统是一个均相的基质系统,药物通过微孔进行扩散实现缓慢释放,影响药物释放速率的内部因素有孔隙率,微孔直径和曲折率等,CPC固化后的不同微孔结构影响着药物在CPC内弥散度[16]。在复合唑来膦酸CPC的表面药物释放时,唑来膦酸从CPC中释放就相当于直接溶解过程;然而,唑来膦酸从CPC内部释放时,唑来膦酸的释放会受到CPC内部微孔结构的影响,因此各实验组在实验结束时的唑来膦酸释放总量百分比存在差异。随着药物释放后,羟基磷灰石可以重结晶,微孔和微孔之间的通道随之不断的调整,使药物释放速率保持相对稳定[17-19]。各实验组的累计药物释放百分比斜率在药物缓慢释放期存在差别。这可能也反映了复合唑来膦酸CPC内部微孔结构对各组药物释放的影响。比较各实验组唑来膦酸的释放总量百分比斜率得出:c组斜率最小,说明将唑来膦酸与磷酸钙骨水泥以0.4%的质量比混合后制备的载药体系的局部药物释放时间可能最长,从释放规律角度认为可能是最合适的唑来膦酸加入量。并且在42天本实验结束时,3种浓度载药缓释体系均以稳定的溶出速率释放唑来膦酸,若药物以此规律继续释放,则可根据复合唑来膦酸的CPC中的药物总量及每日药物溶出量推算其释放周期可达数月,这表明复合唑来膦酸的CPC缓释体系最终能以稳定药物浓度持久、缓慢释放。
3.3 实验结论
唑来膦酸不能从聚甲基丙烯酸甲酯骨水泥中释放,但可以从磷酸钙骨水泥中释放并最终可以以一稳定药物浓度缓慢、持久释放。
[1]张文明,戴伯川.磷酸钙骨水泥作为药物缓释载体的研究进展[J].福建医科大学学报,2002,36(3):340-342.
[2]应明.二磷酸盐类药物[J].江苏医药,1999,25(7):515-516.
[3]王玲玲,高蒿,宗国军.HPLC测定唑来膦酸的含量及有关物质[J].胡应和中国新药杂志,2006,15(8):211-212.
[4]胡汉昆,颜锵,刘薇芝.唑来膦酸质量标准的建立[J].中国药师,2010,13(12):1781-1782.
[5]Nelson CL.The current status of material used for depot delivery of drugs[J].Clin Orthop Relat Res,2004(427):72-78.
[6]张威,马子静,李长龄,等.载依替米星骨水泥体外释放规律考察[J].中国医院药学杂志,2009,29(6):462-465.
[7]Wahlig H.Kinetics of the liberation of antibiotics from bone cements-results of comparative studies in vitro and in vivo[J]. Aktuelle Probl Chir Orthop,1987,31:221-226.
[8]Neut D,van de Belt H,van Horn JR,et al.The effect of mixing on gentamicin release from polymethylmethacrylate bone cements [J].Acta Orthop Scand,2003,74(6):670-676.
[9]Greene N,Holtom PD,Warren CA,et al.In vitro elution of tobramycin and vancomycin polymethylmethacrylate beads and spacers from Simplex and Palacos[J].Am J Orthop,1998,27(3):201-205.
[10]杨骐宁,蔡迅梓,严世贵.抗生素骨水泥的药释特性和增效思路[J/CD].中华关节外科杂志:电子版,2011,5(3):369-373.
[11]Rasyid HN,vander Mei HC,Frijlink HW,et al.Concepts for increasing gentamicin release from handmade bone cementbeads[J]. Acta Orthopaedica,2009,80(5):508-513.
[12]Urabe K,Naruse K,Hattori H,et al.In vitro comparison of elution characteristics of vancomycin fromcalciumphosphatecementand polymethylmethacrylate[J].J Orthop Sci,2009,14(6):784-793.
[13]张亮,陈统一.载药磷酸钙骨水泥研究进展[J].国际骨科学杂志,2012,33(4):228-230.
[14]Yang Z,Han J,Li J,et al.Incorporation of methotrexate in calcium phosphate cement:behavior and release in vitro and in vivo[J].Orthopedics,2009,32(1):27.
[15]Masri BA,Duncan CP,Beauchamp CP,et al.Long-term elution of antibiotics from bone-cement[J].J Arthroplasty,1998,13(3):331-338.
[16]叶向阳,甄平,李晓飞,等.磷酸钙骨水泥药物缓释体系的研究应用[J].中国组织工程研究与临床康复,2009,13(47):9317-9320.
[17]Woo KM,Jun JH,Chen VJ,et al.Nano-fibrous scaffolding promotes osteoblast differentiation and biomineralization[J].Biomaterials,2007,28(2):335-343.
[18]Tang ZG,Hunt JA.The effect of PLGA doping of polycaprolactone films on the control of osteoblast adhesion and proliferation in vitro[J].Biomaterials,2006,27(25):4409-4418.
[19]Grover LM,Gbureck U,Wright AJ,et al.Biologically mediated resorption of brushite cement in vitro[J].Biomaterials,2006,27(10):2178-2185.
Experimental comparative study of two different zoledronic acid-loaded bone cement in vitro elution
XuYue1,Wang Zhenxing2,Yu Xiuchun3.
1 Department of Pediatric Surgery,the Qianfoshan Hospital,Jinan Shandong, 250000;2 Department of Pediatric,Department of Orthopaedics Oncology,the People's Hospital of Linyi City,Linyi Shandong,276000;3 Department of Orthopaedics,the General Hospital of Jinan Military Command,Jinan Shandong, 250000,China
Objective To comparative study the drug release test of two different zoledronic acid-loaded bone cements in vitro.Toprovidedrugrelease kinetic basic resultsin vitro,which can cure giant cell tumor of bone inclinical application. Methods Fourzoledronic acidmass fractionsweretested:0%(groupa),0.2%(groupb),0.4%(group c),0.6%(group d),eachgroup had 1sample.Theywere madeintothe two differentbonecementtestedspecimens(Polymethylmethacrylate bone cement and Calcium phosphate cement).Each group was dipped into 5ml physiological saline and lixiviated for 42 days.Quantitative leaching liquor of each group was collected at specific times,and concentrations of zoledronic acid were detected by high performance liquid chromatograph.Zoledronic acid's drug release densities and release percents of total amount of each group at specific times were computed,and their drug delivering curves were drawn.Results The leaching liquor chromatograms of each experimental group on zoledronic acid-loaded Polymethylmethacrylate bone cement were found no absorption zoledronic acid peak,however,the each experimental group on Calcium phosphate cement could show the absorption peak on zoledronic acid and the percentages of drug release total amount on three experimental groups were group b>group d>group c.Conclusion Zoledronic acids can not be released from Polymethylmethacrylate bone cement,but it can be released from calcium phosphate cement,besides it release slowly and lastingly with the stable concentration.
Polymethylmethacrylate bone cement;Calcium phosphate cement;Zoledronic acid;Drug delivery
R318.08
A
10.3969/j.issn.1672-5972.2016.02.002
swgk2015-10-00226
徐跃(1987-)男,硕士,医师。研究方向:骨科。
[作者简介]王振兴(1985-)男,硕士,医师。研究方向:小儿骨科、骨肿瘤。
2015-11-17)
1山东省千佛山医院小儿外科,山东济南250000;2临沂市人民医院小儿骨、骨肿瘤科,山东临沂276000;3济南军区总医院骨病科,山东济南250000;
*[通讯作者]于秀淳(1965-)男,博士,主任医师。研究方向:骨肿瘤,脊柱外科。徐跃、王振兴为本文共同第一作者。

