荔枝核总黄酮对肝纤维化大鼠模型PPARγ/c-Ski表达的影响*
康 毅,罗伟生,黄 红,黄旭平,张扬武,黄 瑞,谭全肖
(1.广西中医药大学第一附属医院 南宁 530001;2.广西中医药大学第一临床医学院 南宁 530001)
荔枝核总黄酮对肝纤维化大鼠模型PPARγ/c-Ski表达的影响*
康 毅1,罗伟生2**,黄 红2,黄旭平2,张扬武2,黄 瑞2,谭全肖2
(1.广西中医药大学第一附属医院 南宁 530001;2.广西中医药大学第一临床医学院 南宁 530001)
目的:本研究主要观察荔枝核总黄酮(TFL)对二甲基亚硝胺(DMN)诱导的肝纤维化大鼠的防治效果,并从PPARγ、c-Ski等信号分子角度探讨TFL抗肝纤维化的作用机制。方法:90只雄性SD大鼠随机分为空白对照组、模型组、TFL(高、中、低)剂量组和秋水仙碱阳性对照组,每组15只。空白对照组不造模,其余各组按2 mL·kg-1腹腔注射0.5%的DMN溶液制作肝纤维化模型(生理盐水稀释,每周前3天,共4周);造模同时TFL高、中、低剂量组分别以TFL 200、100、50 mg·kg-1·d-1灌胃给药,秋水仙碱组以秋水仙碱0.1 mg·kg-1·d-1灌胃给药,空白对照组和模型组给予等体积生理盐水灌胃,每日1次,共6周(上述灌胃药物均用适量生理盐水配置成混悬液);6周末处死大鼠,腹主动脉真空负压采血检测天冬氨酸 转氨酶(AST)、丙氨酸转氨酶(ALT)、转化因子-β1(TGF-β1)血清水平;Masson染色法观察大鼠肝纤维化程度,并进行肝纤维化半定量评分;运用免疫组化检测各组肝组织α-平滑肌肌动蛋白(α-SMA)、氧 化物酶体增殖物活化受体γ(PPARγ)和c-Ski的蛋白相对表达水平。结果:与空白对照组比较,模型组大鼠血清AST、ALT、TGF-β1水平、肝纤维半定量评分和 肝组织α-SMA蛋白表达均显著升高(P<0.05);PPARγ和c-Ski蛋白相对表达明显减少(P<0.05);与模型组比较,荔枝核总黄酮各组血清AST、ALT、TGF-β1水平、肝纤维半定量评分和肝组织α-SMA蛋白表达均明显减少(P<0.05);肝组织PPARγ、c-Ski的蛋白相对表达明显增加(P<0.05),且具有一定量效关系。结论:TFL能够有效地降低DMN诱导的肝纤维化大鼠的肝损伤,改善其肝纤维化的程度;其抗肝纤维化的作用机制可能是通过上调PPARγ/c-Ski表达,下调α-SMA和TGF-β1表达,抑制肝星状细胞活化来实现。
肝纤维化 荔枝核总黄酮 α-平滑肌肌动蛋白 转化因子-β1 过氧化物酶体增殖物活化受体γ c-Ski
肝纤维化是在各种肝损因素持续作用下,肝细胞外基质(Extracellular Matrix,ECM)异常增多和降解不足,引起肝脏组织结构及功能异常的病理变化。肝纤维化如果得不到 控制而持续进展,最终会发展成为肝硬化,并会产生多种危及生命的并发症,如:肝功能衰竭、肝性脑病、肝癌等[1,2]。目前研究认为,肝纤维化乃至早期肝硬化均是可逆的[3],肝星状细胞(Hepatic Stellate Cell,HSC)的活化和增值为肝纤维化发生和发展的中心环节[1,4]。过氧化物酶体增殖物活化受体γ(Peroxisome Proliferatorsactivated Receptor γ,PPARγ)可影响HSC的活化,延缓肝纤维化的形成,并与多条信号通路交联介导肝纤维化的转归[5]。TGF-β/Smads信号通路在肝纤维化启动、进展乃至肝硬化形成中发挥核心作用,活性蛋白c-Ski是TGF-β/Smads信号通路中的阻遏子[6]。PPARγ活化后对c-Ski始发于转录水平的上调,提示c-Ski可能是PPARγ的又一靶基因[7]。
荔枝核味甘、微苦,归肝、肾经,具有行气散结、祛寒止痛的功效。荔枝核总黄酮(Total Flavone from Litchi Chinensis Sonn.,TFL)为荔枝核中有药理活性的主要成分之一,本课题组前期研究已证TFL具有抗肝纤维作用[8-10]。本课题通过动物大鼠实验,从血清水平、病理形态学角度验证TFL抗肝纤维化效应,并采用酶联免疫吸附法( ELISA)检测血清TGF-β1水平,免疫组化技术检测PPARγ、c-Ski和α-SMA的表达情况,探讨TFL抗肝纤维化的可能细胞分子生物学机制。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠90只,体质量150±20 g,鼠龄5周,由广西医科大学动物中心提供,合格证:SCXK桂2009-0002。
1.2 试剂和仪器
TFL,纯度为82.1%(南京泽朗医药科技有限公司,批号:ZL131022300YY);秋水仙碱片,规格:0.5 mg/片(西双版纳版纳药业有限责任公司,批号:130323);DMN,规格:1 g·mL-1(美国Sigma公司产品),由桂林医学院科学实验中心友好提供;兔抗鼠PPARγ多克隆抗体(美国Abcam公司,批号:GPV1432),兔抗鼠c-Ski多克隆抗体(美国Abcam公司,批号:GSC1422);兔抗鼠α-SMA多克隆抗体(武汉三鹰公司,批号:14395);TGF-β1 ELISA试剂盒(武汉博士德生物工程有限公司,批号:2271145327),DAB显色试剂盒、免疫组织化学二抗试剂(福建迈新公司);全自动生化分析仪7600-020(日本HITACHI公司);倒置照相显微镜CK2(日本Olympus公司)。
1.3 方法
1.3.1 造模
90只大鼠随机分为空白对照组、模型组、秋水仙碱组、TFL高剂量组、TFL中剂量组、TFL低剂量组,每组15只。空白对照组不予处理。参照Ala-Kokko等[11]方法腹腔注射2 mL·kg10.5%DMN,每周3天,连续4周,制作肝纤维化模型。造模当日即开始分组给药,空白对照组、模型组按5 mL·kg-1·d-1生理盐水灌胃,荔枝核总黄酮按高、中、低剂量组分别按生药计算为200、100、50 mg·kg-1·d-1灌胃,秋水仙碱组按0.1 mg·kg-1·d-1秋水仙碱灌胃,灌胃药物均用适量生理盐水配制成混悬液,每日1次,共给药6周。参考覃浩等[10]《荔枝核总黄酮预防大鼠肝纤维化的初步研究》。
1.3.2 肝功能及TGF-β1检测
血液常规离心分离出血清后,采用全自动生化分析仪检测ALT、AST水平,采用酶联免疫吸附法(ELISA)检测血清TGF-β1水平,严格按照试剂盒说明书操作。
1.3.3 Masson染色
实验结束后处死大鼠,取肝右叶中部组织用4%的多聚甲醛固定,常规石蜡包埋,进行Masson染色。肝纤维化分级评分参照2002年中华肝脏病学会肝纤维化分级法[12]。
1.3.4 免疫组织化学染色检测α-SMA 、PPARγ、c-Ski蛋白表达
肝 组织防脱切片经过常规脱蜡、脱水;2% EDTA抗原热修复20 min,PBS冲洗;3% H2O2阻断10 min,PBS冲洗;分别滴加α-SMA、PPARγ、c-Ski多克隆抗体(按说明书预先稀释),孵育1 h后PBS冲洗;滴加二抗,孵育20 min,然后PBS冲洗;DAB显色;苏木精复染,脱水,透明,封片、光学显微镜下观察。参照徐列明等[13]免疫组化显色评分标准进行评分。
1.4 统计学 分析
2 结果
2.1 基本实验情况
实验过程中共死亡3只大鼠,其中秋水仙碱组死亡1只,模型组死亡2只。秋水仙碱组大鼠死亡原因为灌胃时大鼠挣扎导致灌胃针穿破食管和胸腔主动脉致大出血而死亡;模型组死亡大鼠,经解剖及肝脏HE染色检查证实死于急性肝衰竭。故有3只死亡大鼠不计入统计学分析。
2.2 各组血清ALT、AST、TGF-β1水平
空白对照组大鼠血清ALT、AST水平分别为38.96±3.72和73.34±7.82,模型组大鼠血清ALT、AST水平分别为200.97±10.53和382.65±19.39,与空白对照组相比显著增加(P<0.05)。TFL各剂量组和秋水仙碱组血清ALT、AST分别为:高剂量组61.48±8.08、111.29±11.55,中剂量组84.90± 12.83、147.83±12.91,低剂量组94.30±14.33、154.56± 10.36,秋水仙碱组98.65±6.63、154.56±12.68,各治疗组血清ALT、AST水平均明显低于模型组(P<0.05),且TFL高、中剂量组血清ALT水平较秋水仙碱组明显降低(P<0.05)。TFL低剂量组血清ALT水平稍低于秋水仙碱组,但无统计学意义。详见表1。
空白对照组大鼠血清TGF-β1水平为267.11± 18.78,模型组大鼠血清TGF-β1水平为410.02± 10.75,与空白对照组相比有明显增高(P<0.05)。TFL高、中、低剂量组和秋水仙碱组血清TGF-β1水平分别为298.28±17.92、329.17±18.16、354.44± 18.79和364.16±14.88,各治疗组均明显低于模型组(P<0.05),且TFL高、中剂量组血清AST水平较秋水仙碱组降低(P<0.05)。TFL低剂量组血清AST与秋水仙碱组无统计学差异。详见表1。
2.3 肝脏组织病理学变化
Masson染色显示:①空白对照组:无纤维组织增生(图1A);②模型组:汇管区可见大量胶原纤维增生,并在相邻汇管区、汇管区与中央静脉之间可见纤维间隔形成,分割、包绕肝小叶(图1B);肝纤维化半定量评分较空白对照组明显增高(P<0.05),见表3;③TFL高剂量组:可见胶原纤维轻度增生,窦周和小叶内纤维化局限,汇管区及小叶间纤维间隔轻度阔大,肝小叶结构正常(图1C);④TFL中、低剂量组和秋水仙碱组汇管区和小叶间纤维粗大,数量较多(图1D、1E、1F);⑤TFL高、中、低剂量组和秋水仙碱组肝纤维化半定量评分较模型组低(P<0.05),TFL高、中剂量组较秋水仙碱组肝纤维化评分低(P<0.05)。各组肝纤维化半定量计分结果具体见图1、表2、表3。
表1 大鼠血清ALT、AST、TGF-β1表达情况()
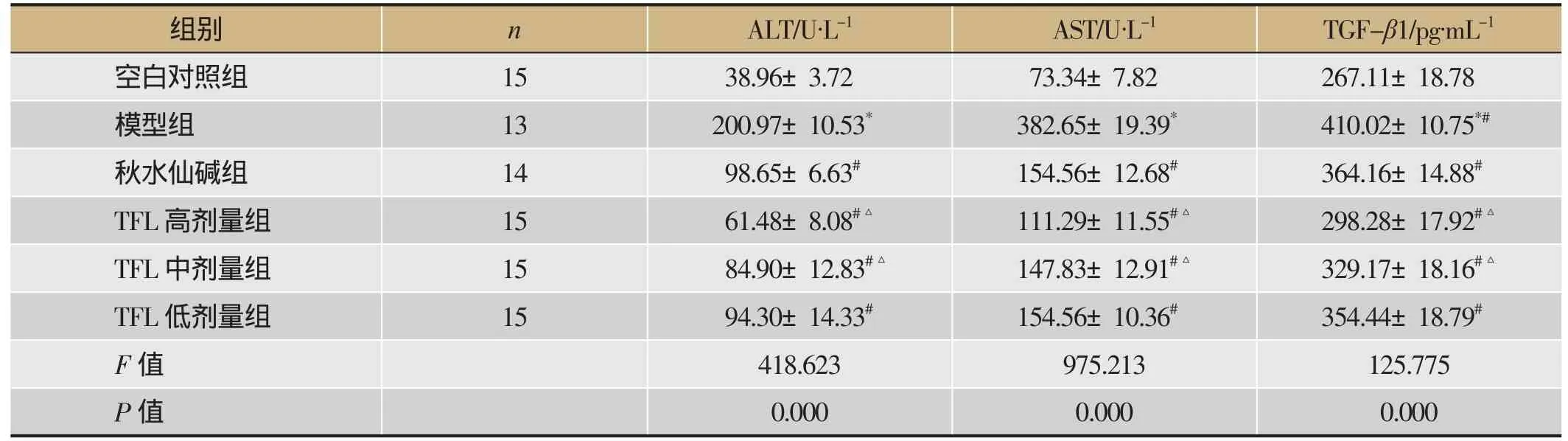
表1 大鼠血清ALT、AST、TGF-β1表达情况()
注:与空白对照组比较,*P<0.05;与模型 组比较,#P<0.05;与秋水仙碱组比较,△P<0.05。
?
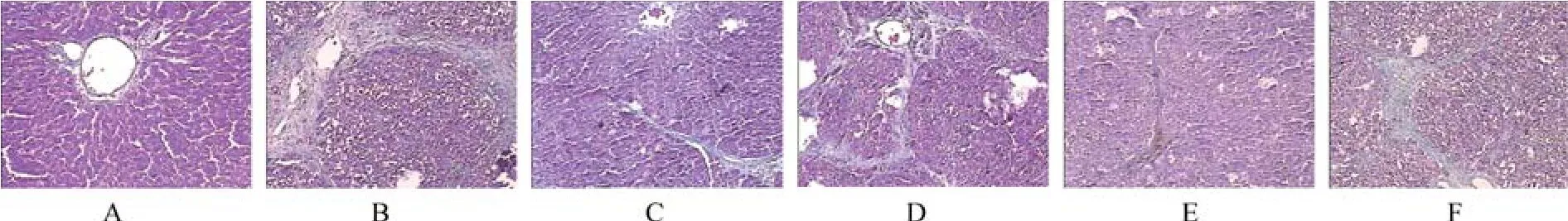
图1 肝组织Masson染色(100×)
2.4 各组α-SMA蛋白表达
免疫组化染色结果显示:α-SMA阳性表达细胞被染成棕黄色。空白对照组大鼠肝组织中α-SMA仅在汇管区和窦周间质细胞中少量表达。模型组大鼠肝组织中α-SMA广泛表达于中央静脉、窦周间隙、汇管区和纤维间隔中,其中汇管区和纤维间隔中表达丰富;显色指数评分显著高于空白对照组(P<0.05)。TFL高、中、低各组和秋水仙碱组α-SMA表达均有所减少(P<0.05),TFL各组呈现剂量依赖性;与秋水仙碱组比较,TFL高、中剂量组α-SMA表达较低(P<0.05);TFL低剂量组α-SMA表达较秋水仙碱稍高,但无统计学意义(见图2、表2)。
2.5 各组PPARγ、c-Ski蛋白表达
免疫组化染色显示,在空白对照组中PPARγ、c-Ski广泛 表达且特点相似,在纤维间隔、肝窦、汇管区和中央静脉等均可见表达,明显高于模型组(P<0.05);与模型组比较,TFL高、中、低剂量组和秋水仙碱组PPARγ、c-Ski表达明显增加(P<0.05),且TFL各组有剂量依赖性;与秋水仙碱组比 较,TFL高、中剂量组PPARγ、c-Ski表达明显增加(P<0.05);TFL低剂量组PPARγ、c-Ski表达较秋水仙碱稍低,差异无统计学意义(见图3、表3)。
3 讨论
肝纤维化的分子生物学机制涉及多种细胞、细胞因子和多条信号通路,且其相互影响交联成网。其中,HSC的激活、增殖是肝纤维化发生的中心环节[1,4]。当肝脏因理化等因素损害时,HSC由静息状态被激活转化为具有增殖、分泌和收缩等活性的MFB,并在细胞内大量表达α-SMA。目前研究认为,α-SMA是HSC活化的重要标志[1,14]。PPARγ属于配体依赖的核激素受体超家族,可抑制HSC的活化,延缓肝纤维化的形成,并与多条信号通路交联介导肝纤维化的转归[5],多种内源或外源性PPARγ配体可明显抑制HSC纤维生成活性[15, 16]。
活性蛋白c-Ski是Ski原癌基因蛋白家族成员,它不能直接与DNA结合,而是作为转录辅助子调控相关信号蛋白的核转录。TGF-β/Smads信号通路在肝纤维化启动、进展乃至肝硬化形成中发挥核心作用,c-Ski是TGF-β/Smad信号通路的阻遏子,它可以通过结合TGF-β I型受体(TβRI),从而干扰smad2、smad3磷酸化、阻止磷酸化smad3与smad4结合形成有活性的smad复合物及募集大量辅抑制子而阻断TGF-β/smad途径对靶基因的转录调控[17,18]。现有报道PPARγ活化后对c-Ski始发于转录水平的上调,并提示c-Ski可能是PPARγ的又一靶基因[7]。田雪等[19]报道PPARγ激动剂吡格列酮可以上调糖尿病大鼠肾组织中c-Ski的表达,抑制TGF-β1的表达。
表2 肝纤维半定量评分和α-SMA显色指数()
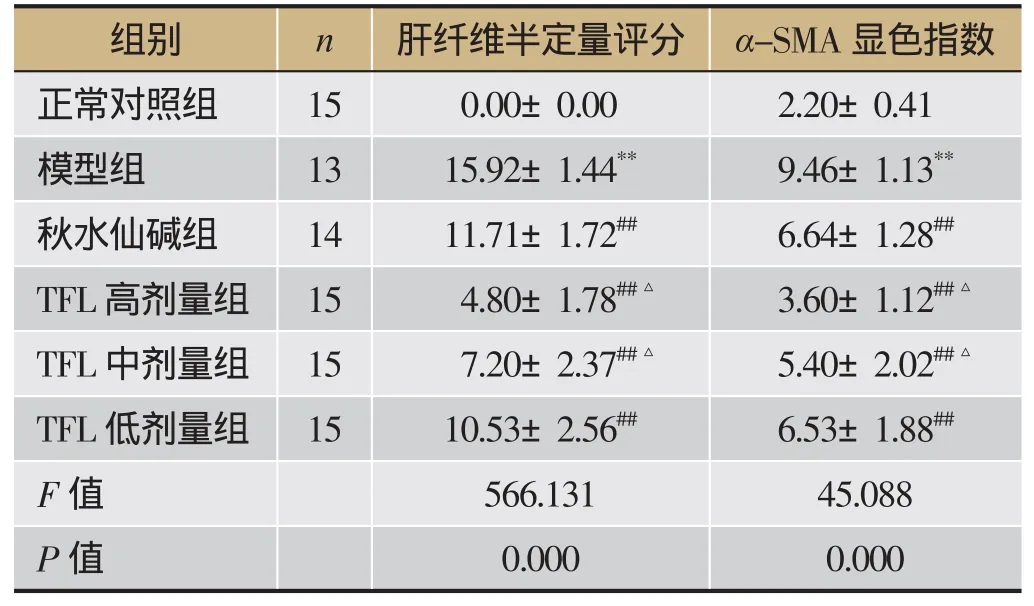
表2 肝纤维半定量评分和α-SMA显色指数()
注:与空白对照组比较,**P<0.01;与模型组比较,##P<0.01;与秋水仙碱组比较,△P< 0.05。
?
表3 各组大鼠肝组织PPARγ、c-Ski显色指数()
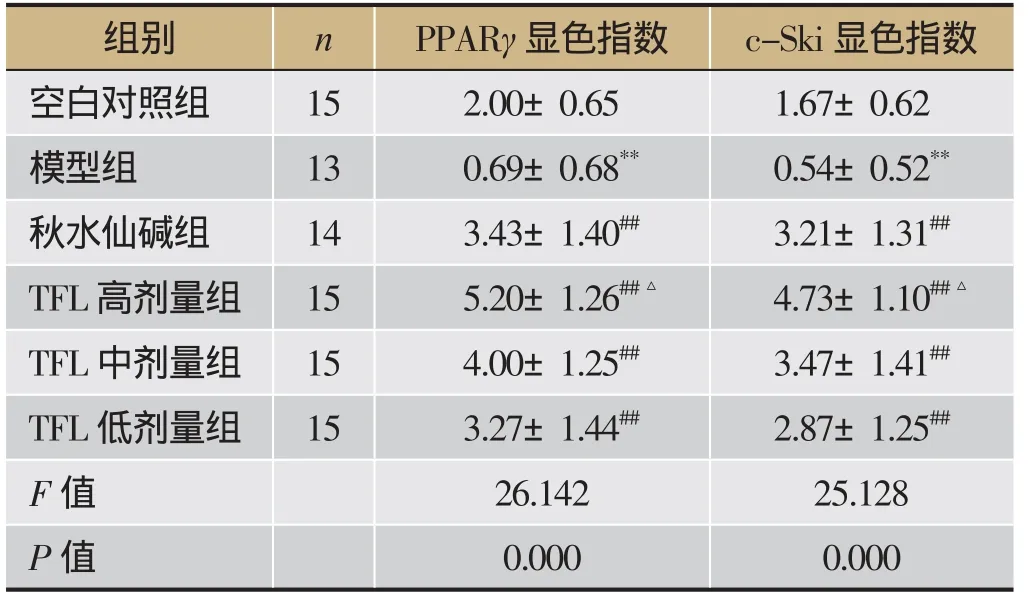
表3 各组大鼠肝组织PPARγ、c-Ski显色指数()
注:与空白对照组比较,**P<0.01;与模型组比较,##P<0.01;与秋水仙碱组比较,△P<0.05。
?
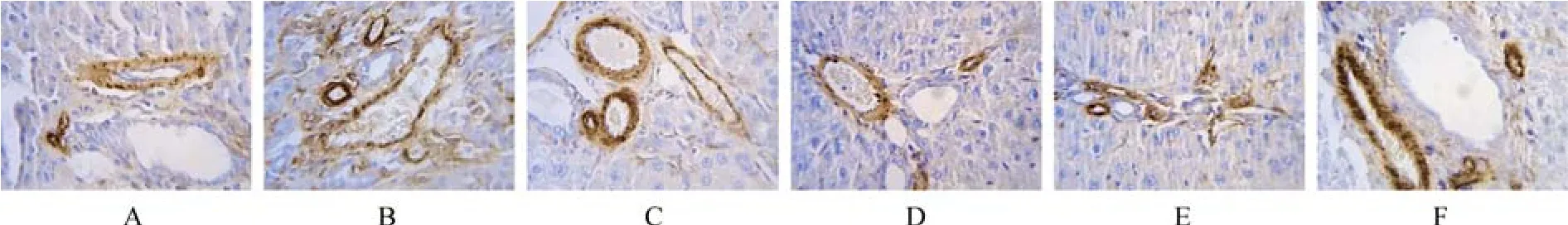
图2 大鼠肝组织α-SMA免疫组化染色(400×)
本实验结果显示:肝纤维化模型组血清AST、ALT水平、肝纤维化半定量评分显著高于空白对照组(P<0.05);TFL高、中、低各组和秋水仙碱组血清AST、ALT水平、肝纤维化半定 量评分均有所减少(P<0.05),其中TFL高剂量组、TFL中剂量组均优于秋水仙碱组(P<0.05),表明TFL有较好的护肝和抗肝纤维化作用,且具有一定剂量依从性。肝纤维化模型组肝组织α-SMA显色指数、血清TGF-β1水平显著高于空白对照组(P<0.05),而PPARγ、c-Ski显色指数明显降低(P<0.05);TFL高、中、低剂量各组和秋水仙碱组肝组织α-SMA显色指数、血清TGF-β1水平明显低于模型组(P<0.05),而PPARγ、c-Ski显色指数明显升高(P<0.05)。这表明,TFL抗肝纤维化作用机制可能是通过上调PPARγ、c-Ski表达水平,抑制α-SMA、TGF-β1高表达,抑制肝星状细胞活化,进而抑制肝纤维化的发生和发展。
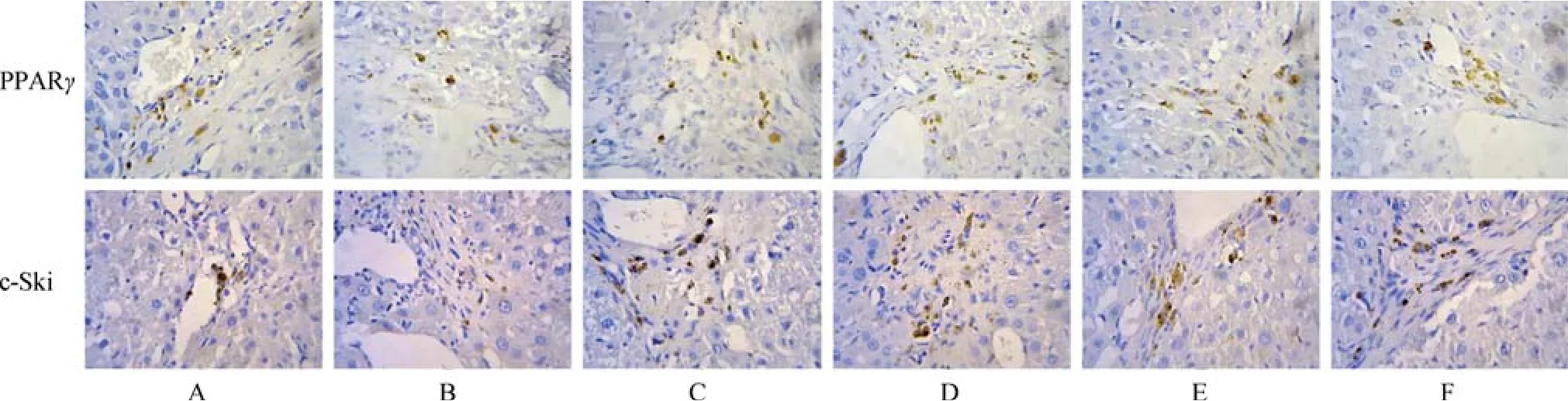
图3 大鼠肝组织PPARγ、c-Ski免疫组化染色(400×)
综上所述,荔枝核总黄酮可以降低实验肝纤维化大鼠血清ALT、AST水平,具有肝功能保护作用;荔枝核总黄酮能够明显改善实验性肝纤维化大鼠肝纤维化程度,具有良好的抗肝纤维化作用;荔枝核总黄酮抗肝纤维化的作用机制可能是通过上调肝脏中PPARγ、c-Ski的表达,抑制α-SMA、TGF-β1高表达,抑制HSC活化,进而抑制肝纤维化的发生和发展。但是,肝纤维化涉及到的细胞分子生物学机制极其复杂,单独研究荔枝核总黄酮对某类细胞或某几个信号分子的干预存在局限。后续研究应从细胞信号通路交联角度继续完善荔枝核总黄酮抗肝纤维化的具体机制研究,评估其是否具有成为抗肝纤维化新药的可能。
1 Friedman S L. Mechanisms of hepatic fibrogenesis. Gastroenterology, 2008, 134(6): 1655-1669.
2 Lee U E, Friedman S L. Mechanisms of hepatic fibrogenesis. Best Pract Res Clin Gastroenterol, 2011, 25(2): 195-206.
3 Iredale J P, Bataller R. Identifying molecular factors that contribute to resolution of liver fibrosis. Gastroenterology, 2014, 146(5): 1160-1164. 4 Puche J E, Saiman Y, Friedman S L. Hepatic stellate cells and liver fibrosis. Compr Physiol, 2013, 3(4): 1473-1492.
5 Zhang F, Lu Y, Zheng S. Peroxisome proliferator-activated recaptorgamma cross-regulation of signaling events implicated in liver fibrogenesis. Cell Signal, 2012, 24(3): 596-605.
6 Bonnon C, Atanasoski S. c-Ski in health and disease. Cell Tissue Res, 2012, 347(1): 51-64.
7 李工博,李军,曾益军,等. PPARγ对TGFβ/smad信号通路阻遏子c-Ski的上调作用.生理学报, 2011, 63(1): 62-68.
8 罗伟生,欧士钰,靳雅玲,等.荔枝核总黄酮抗肝纤维化作用的实验研究.重庆医学, 2013, 42(4): 373-375, 378.
9 喻勤,傅向阳,罗伟生,等.荔枝核总黄酮对大鼠肝纤维化TGF-β/ Smad信号通路的影响.中国实验方剂学杂志, 2013, 19(18): 223-227.
10 覃浩,孙旭锐,欧仕玉,等.荔枝核总黄酮预防大鼠肝纤维化的初步研究.第三军医大学学报, 2011, 33(22): 2353-2356.
11 Ala-Kokko L, Pihlajaniemi T, Myers J C, et al. Gene expression of type I, III and IV collagens in hepatic fibrosis induced by dimethylnitrosamine in the rat. Biochem J, 1987, 244(1): 75-79.
12 中华肝脏病学会肝纤维化学组.肝纤维化诊断及疗效评估共识.中华肝脏病杂志, 2002, 10(5): 8-9.
13 徐列明,刘平,吕刚,等. I、IV型胶原及板层素在肝纤维化大鼠肝窦周围的变化.中华消化杂志, 1995, 15(3): 146-148.
14 Chang X M, Chang Y, Jia A. Effects of interferon-alpha on expression of hepatic stellate cell and transforming growth factor beta1 and alphasmooth muscle actin in rats with hepatic fibrosis. World J Gastroenterol, 2005, 11(17): 2634-2636.
15 Zhang F, Lu Y, Zheng S. Peroxisome proliferator-activated receptorgamma cross-regulation of signaling events implicated in liverfibrogenesis. Cell Signal, 2012, 24(3): 596-605.
16 孙凯,黄晓卉,甄茂川,等.过氧化物酶增殖物激活受体γ对大鼠肝星状细胞增殖及凋亡的影响.中华实验外科杂志, 2006, 23(10):1194-1196.
17 He J, Tegen S B, Krawitz A R, et al. The transforming activity of Ski and SnoN is dependent on their ability to repress the activity of Smad proteins. J Biol Chem, 2003, 278(33): 30540-30547.
18 Ferrand N, Atfi A, Prunier C. The oncoprotein c-ski functions as a direct antagonist of the transforming growth factor-{beta} type I receptor. Cancer Res, 2010, 70(21): 8457-8466.
19 田雪,于倩,张捷,等.糖尿病大鼠肾组织中PPAR-γ对TGF-β1、c-Ski调控作用的研究.天津医科大学学报, 2013, 19(1): 31- 35.
Effect of Total Flavone from Litchi chinensis Sonn. on PPARγ/c-Ski Expression in Liver Fibrosis Rat Model
Kang Yi1, Luo Weisheng2, Huang Hong2, Huang Xuping2, Zhang Yangwu2, Huang Rui2, Tan Quanxiao2
(1. The First Affiliated Hospital of Guangxi University of Traditional Chinese Medicine, Nanning 530001, China; 2. The First Clinical Medical College of Guangxi University of Traditional Chinese Medicine, Nanning 530001, China)
This study was aimed to observe the protective and treatment effect of total flavone from Litchi chinensis Sonn. (TFL) on dimethylnitrosamine (DMN) induced hepatic fibrosis in rat’s hepatic tissues. The action mechanism was discussed from the aspect of signaling molecules which included peroxisome proliferatoractivated receptor-γ (PPARγ) and c-Ski on the antifibrotic effect of TFL. A total of 90 male SD rats were randomly divided into the blank control group, model group, TFL (high, medium and low dose) group, and the colchicine positive control group, with 15 rats in each group. No rat model was established in the blank control group. Rats in other groups were intraperitoneally injected with 0.5% DMN (2 mL·kg-1, diluted by normal saline, injected on the first 3 days of each week for 4 weeks) for the establishment of hepatic fibrosis rat model. Meanwhile, intragastric administration of TFL (200 mg·kg-1·d-1, 100 mg·kg-1·d-1, 50 mg·kg-1·d-1) was given to the TFL high, medium and low dose group, respectively. The intragastric administration of colchicines of 0.1 mg·kg-1·d-1was given to the colchicines group. Intragastric administration of the same volume of normal saline was given to the blank control group and the model group, once a day for 6 weeks (Intragastric administration of all medication was prepared into injectable suspension with appropriate amount of normal saline). Rats we re sacrificed at the end of the 6thweek. Vacuum blood collection was given fro m the abdominal aorta for the detection of AST, ALT and TGF-β1 levels. Masson staining was used to observe the degree of hepatic fibrosis in rats. And the degree of hepatic fibrosis was semi-quantitatively scored. The immunohistoche mical method was used to detect the relative expression levels of α-SMA, PPARγ and c-Ski in hepatic tissues from each group. The results sho wed that compared with the blank control group, the AST, ALT and TGF-β1 levels, hepatic fibrosis semi-quantitative score, and the expression level of α-SMA in hepatic tissues of the model group were obviously increased (P <0.05). The relative expression levels of PPARγ and c-Ski were obviously decreased (P < 0.05). Compared with the model group, the AST, ALT and TGF-β1 levels, hepatic fibrosis semi-quantitative score, and the expression level of α-SMA in each TFL group were obviously decreased (P < 0.05). The relative expression levels of PPARγ and c-Ski in hepatic tissues were obviously increased (P < 0.05) with certain dose-effect relationship. It was concluded that TFL can effectively decrease the hepatic injury of hepatic fibrosis rats induced by DMN, and improve the degree of hepatic fibrosis. The antifibrotic effect of TFL may be realized through the upregulation of PPARγ/c-Ski expression, downregulation of α-SMA and TGF-β1 expression, and the inhibition of hepatic stellate cell activation.
Hepatic fibrosis, flavone from Litchi chinensis Sonn., α-smooth muscle actin, transforming growth factor β1, peroxisome proliferators-activated receptor gamma, c-Ski
10.11842/wst.2016.01.018
R575
A
(责任编辑:朱黎婷 张志华,责任译审:王 晶)
2015-06-26
修回日期:2015-10-27
* 国家自然科学基金地区科学基金项目(81360530):TGF-β-Smad-CTGF/PPARγ-c-Ski信号交联介导肝纤维化及荔枝核总黄酮的效应机制,负责人:罗伟生。
** 通讯作者:罗伟生,博士生导师,教授,主任医师,主要研究方向:消化系统疾病的临床和基础研究。

