利用好氧颗粒污泥处理水产循环养殖废水的研究*
高锦芳 谭洪新,2,3 顾德平 罗国芝,2,3# 陈家捷 刘文畅(.上海海洋大学水产与生命学院,上海 20306;2.上海水产养殖工程技术研究中心,上海 20306;3.水产动物遗传育种中心上海市协同创新中心,上海 20306;.上海市奉贤区农业委员会,上海 2099)
水产循环水养殖系统(RAS)与传统的水产养殖模式相比,具有占地面积少、节约耗水量、高密度集约化和废水排放可控等优点。RAS的推广可有效解决养殖废水的排放问题,但RAS容易积累硝态氮,一般情况下,硝态氮的安全质量浓度在50 mg/L以下[1],高浓度硝态氮将影响养殖对象的生长,使其成活率、免疫力降低,体质变弱甚至死亡[2-3]。同时,硝态氮排放到环境中将使周围水体富营养化,因此需要在RAS中添加反硝化处理设备去除硝态氮。
好氧颗粒污泥具有同时硝化反硝化(SND)的特点,因此可将好氧颗粒污泥应用于RAS的硝态氮处理[4-5]。目前,好氧颗粒污泥主要应用于生活污水和工业污水处理,还未有研究将好氧颗粒污泥应用于水产循环养殖废水的处理[6]。为此,本研究尝试用好氧颗粒污泥处理水产循环养殖废水,为水产循环养殖废水中硝态氮的去除提供参考。
1 材料与方法
1.1 试验装置及运行工况
试验采用序批式活性污泥反应器(SBR)处理水产循环养殖废水,SBR有效体积为6 L,接种絮体为上海海洋大学循环水研发平台内生物絮凝养殖罗非鱼的生物絮体,其总悬浮固体(TSS)为3 472.67 mg/L,接种量为3 L。SBR运行周期为180 min,其中曝气160 min,沉降10 min,出水5 min,进水5 min。每周期出水体积为3 L,每天排泥500 mL,水力停留时间(HRT)为6 h,污泥停留时间(SRT)为15 d。低溶解氧体系不利于好氧颗粒污泥的形成[7],因此将3个平行运行的SBR连接在一个ACO-008B型空气泵上,每个SBR的曝气量为30 L/min,曝气时SBR内溶解氧为6.4~7.1 mg/L。因水产循环养殖废水中缺乏好氧颗粒污泥形成和保持活性的必要条件,为保证水中足够的碳源,每天从RAS取水后添加葡萄糖,维持碳氮比(溶解性有机碳/(氨氮+硝态氮))为15。研究表明,在中性偏碱的环境中,好氧颗粒污泥对有机物及氮素的去除效果较佳[8],所以在试验中添加碳酸氢钠维持进水pH在7.0~8.5。进水硝态氮质量浓度为24.0~50.0 mg/L,亚硝态氮为0.020~0.475 mg/L,氨氮为0.12~6.03 mg/L,溶解性磷酸盐为1.8~15.7 mg/L,溶解性有机碳为179.0~605.1 mg/L。
1.2 水质测定及絮体形态观察
试验期间每天测定SBR中水质指标,每2天测定TSS及挥发性悬浮固体(VSS)的质量浓度,并考察絮体沉降性能。pH、溶解氧、温度采用Multi3430型多参数水质测量仪测定。水样经0.45 μm滤膜抽滤后,测定溶解性有机碳、硝态氮、氨氮、亚硝态氮和溶解性磷酸盐的质量浓度。其中,硝态氮采用N-(1-萘基)-紫外分光光度法测定;氨氮采用纳氏试剂分光光度法测定;亚硝态氮采用盐酸萘乙二胺比色法测定;溶解性磷酸盐采用钼锑抗分光光度法测定[9];溶解性有机碳采用总有机碳分析仪测定;TSS、VSS采用称重法测定。采用SVI5衡量絮体沉降性能,SVI5指混合液沉降5 min后1 g干絮体所占的体积,SVI5越小,表示絮体沉降性能越好。每隔2天用显微镜观察絮体并拍照,最后用4’,6-二脒基-2-苯基吲哚(DAPI)染色好氧颗粒污泥[10],用荧光倒置显微镜观察污泥形态。
1.3 粗蛋白和粗脂肪的测定
采用元素分析仪对生物絮体中的碳、氮含量进行分析,粗蛋白采用杜马斯燃烧定氮法测定[11];粗脂肪采用Floch法测定[12],方法如下:将接种生物絮体或好氧颗粒污泥于65 ℃干燥,称取一定干燥物质用氯仿-甲醇混合溶液浸提24 h,抽滤混合液,将得到的滤液放置于50 mL已称重的烧杯中真空干燥12 h,称量烧杯质量,粗脂肪质量分数计算如下:
M=(W3-W2)/W1×100%
(1)
式中:M为生物絮体或好氧颗粒污泥中粗脂肪的质量分数,%;W3为加入滤液并真空干燥12 h后的烧杯质量,g;W2为烧杯自身质量,g;W1为生物絮体或好氧颗粒污泥的质量,g。
1.4 胞外聚合物(EPS)的提取及测定
好氧颗粒污泥的形成机制为EPS假说,认为EPS将微生物细胞与颗粒态物质连接形成好氧颗粒污泥[13-14]。EPS采用超声波法提取:取40 mL泥水混合液于5 578 r/min下离心5 min,倒去上清液,取出固体加入20 mL纯水,用漩涡振荡器重悬浮1 min,再将混合液于6 831 r/min下离心10 min,将上清液经0.45 μm滤膜抽滤,得到松散结合胞外聚合物(LB-EPS)。将剩余固体用20 mL超纯水重悬浮,将得到的混合液放置在冰浴中用SCIENTZ-ⅡD型细胞破碎仪(400 W)超声10 min,8 818 r/min下离心10 min,上清液经0.45 μm滤膜抽滤,得到紧密结合胞外聚合物(TB-EPS)[15]。EPS中的多糖含量采用硫酸-蒽酮法测定(基准物质为葡萄糖);蛋白质含量采用修正的Folin-酚法测定(基准物质为牛血清蛋白);DNA采用二苯胺法测定(基准物质为2-脱氧-D-核糖)[16]。
2 结果与讨论
2.1 絮体变化
图1、图2分别为200倍显微镜和高倍电子显微镜下接种生物絮体和培养成熟的好氧颗粒污泥图片。由图1(a)、图2(a)可见,接种生物絮体结构松散、边缘模糊,而从图1(b)、图2(b)可见,培养成熟的好氧颗粒污泥边缘整齐,颗粒结构紧密,平均粒径约为150 μm,外观呈橙黄色颗粒状。可将好氧颗粒污泥的培养过程分解为絮体优势期、竞争共存期、颗粒优势期[17]。竞争共存期时,SBR通过沉降出水将沉降性能较差的絮体排出,使颗粒污泥形成生长优势。对好氧颗粒污泥进行DAPI染色,经观察发现,好氧颗粒污泥是由微生物形成的结构紧凑、外形规则的密集聚合体。由于好氧颗粒污泥紧密的结构和较大的粒径使其具有好氧区域、缺氧区域和厌氧区域,保持了良好的生物多样性。通过异养细菌、硝化细菌和反硝化细菌的协同作用,好氧颗粒污泥可以较好地实现碳氮的同步去除[18]。
SBR运行期间,混合液TSS、VSS、SVI5的变化情况见图3。由图3(a)可见,混合液SVI5从最初的126.73 mL/g升高到236.55 mL/g,再持续降低至28.94 mL/g,运行后期,SBR内成功培养出大量好氧颗粒污泥,这些好养颗粒污泥具有较好的沉降性能。由图3(b)可见,SBR运行过程中VSS变化趋势与TSS变化趋势相同,两者质量浓度在波动中持续增加,在39~51 d基本处于稳定状态,好氧颗粒污泥培养结束后,SBR内VSS稳定在16.33~17.47 g/L,TSS稳定在17.25~18.57 g/L。
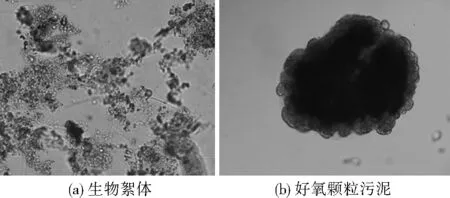
图1 200倍显微镜下的生物絮体和好氧颗粒污泥Fig.1 The photos of the bioflocs and aerobic granule sludge under 200 magnified visual field

图2 5 000倍电子显微镜下的生物絮体和好氧颗粒污泥Fig.2 The photos of the bioflocs and aerobic granule sludge under electron microscope of 5 000 times
2.2 反应器出水水质
SBR运行期间水质变化情况如图4所示。由图4可见,SBR运行初期,出水亚硝态氮、硝态氮、溶解性有机碳及溶解性磷酸盐的浓度均明显降低,氨氮浓度波动较大。第1天出水亚硝态氮、溶解性磷酸盐的浓度高于进水,说明SBR中存在反硝化反应及有机质的降解。随着SBR中好氧颗粒污泥的逐渐形成,硝态氮、溶解性有机碳、溶解性磷酸盐都达到较好的去除效果,去除率在90%以上。反应器出水亚硝态氮不稳定,多次出现出水亚硝态氮浓度高于进水的情况,这是因为好氧颗粒污泥内部存在厌氧区,具有反硝化作用,而亚硝态氮作为反硝化的中间产物,出水浓度受进水氨氮影响较大。总体看来,出水亚硝态氮的浓度较低,在罗非鱼的耐受范围内,不会对水产养殖产生影响。受进水氨氮浓度影响,SBR出水氨氮波动较大,氨氮去除率总体在50%左右,较硝态氮去除率低,这是缘于好氧颗粒污泥主要以硝态氮为氮源,对硝态氮的适应浓度较高,因此SBR对硝态氮的处理效果更好。
2.3 典型周期内SBR的水质变化
图5为一个典型周期内SBR中3种形态氮和溶解性有机碳的变化。由图5可见,SBR内硝态氮在5 min内被迅速利用,从27.7 mg/L降到5.1 mg/L,运行到10 min后,硝态氮已下降到1.0 mg/L以下,在随后的170 min内,硝态氮稳定在0.6 mg/L以下。亚硝态氮、氨氮在运行前期均呈先升高再降低的趋势,其中亚硝态氮在运行90 min后达到稳定,氨氮在运行30 min后达到稳定,两者在运行后期均维持较低的浓度水平。SBR中溶解性有机碳在30 min内迅速降低,说明反应器内发生硝化—反硝化反应,SBR内的好氧颗粒污泥能快速吸附并利用水体中的氮素和溶解性有机碳。王昌稳等[19]研究发现,由于好氧颗粒污泥由大量微生物细胞和EPS构成,具有负表面电位和很高的吸附活性,同时好氧颗粒污泥具有多孔表面,因此能够快速吸附利用水中的氨氮,通过硝化作用将其氧化为硝态氮。此外,好氧颗粒污泥内部存在缺氧区和厌氧区,有助于硝态氮被快速反硝化利用,最终以氮气的形式排出实现氮素去除。
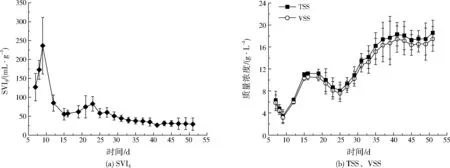
图3 SBR运行过程中SVI5、TSS、VSS变化Fig.3 The changes of SVI5,TSS,VSS during the operation of SBR
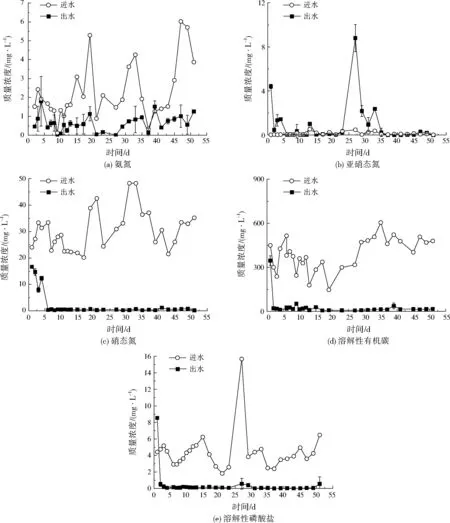
图4 运行过程中SBR内水质变化Fig.4 The changes of water quatily during the operation of SBR
2.4 粗蛋白和粗脂肪含量变化
随着SBR的运行,生物絮体逐渐培养成好氧颗粒污泥,期间粗蛋白及粗脂肪的变化情况见图6。由图6可见,SBR内生物絮体粗蛋白的质量分数从最初的29.9%最高增加到46.6%,运行结束后,好氧颗粒污泥的粗蛋白质量分数为34.6%,说明生物絮体经驯化后可以利用水产循环养殖废水中的硝态氮合成细胞内物质。生物絮体中粗脂肪的质量分数总体呈上升趋势,从最初的1.2%增加到2.0%以上。生物絮凝养殖目前已成功应用到滤食性水产品如罗非鱼、对虾的养殖中,且有研究表明,罗非鱼和虾类会主动摄食生物絮体,提高对絮体蛋白的利用率[20-21]。本研究培养出的好氧颗粒污泥粗蛋白含量已达到罗非鱼的生长需求,但粗脂肪含量与罗非鱼的生长需求(7.67%~9.34%)相差较大[22-23]。因此,好氧颗粒污泥是否能在处理水质的同时以饲料或补充蛋白的形式应用到实际养殖中,还有待进一步的研究。

图5 典型周期内SBR的水质变化Fig.5 The changes of water quatily in a typical cycle of SBR

图6 粗蛋白和粗脂肪的变化Fig.6 The change of crude protein and crude fat
2.5 生物絮体与好氧颗粒污泥EPS比较
EPS是在一定环境条件下细菌和其他微生物用于自我保护和互相黏连而分泌于细胞外的一种具有黏性的聚合物[24],EPS对好氧颗粒污泥的形成、稳定起着重要的作用。EPS由LB-EPS及TB-EPS共同构成,其中LB-EPS位于细胞外层,主要靠氢键和离子键结合,有较高的负电性和较强结合水能力,使絮体外层具有空间位阻和静电斥力,其特点是结构松散,能够溶解营养物质和氧。TB-EPS位于细胞内层,通过疏水结合位相互结合在一起,使絮体具有紧密的结构[25-26]。
利用超声波法分别提取接种生物絮体及好氧颗粒污泥的TB-EPS和LB-EPS,研究发现,生物絮体内TB-EPS和LB-EPS的质量浓度(以单位质量VSS中总有机碳(TOC)质量计,下同)分别为(12.70±1.92)、(0.79±0.39) mg/g,好氧颗粒污泥中TB-EPS和LB-EPS的质量浓度分别为(55.97±8.62)、(0.64±0.02) mg/g。可见,生物絮体中LB-EPS含量较好氧颗粒污泥高,而TB-EPS含量较好氧颗粒污泥低,进一步证明了LB-EPS使絮体变得松散,TB-EPS使絮体变得紧密的结论。
生物絮体与好氧颗粒污泥的LB-EPS、TB-EPS物质组成见图7。由图7可见,生物絮体LB-EPS中的多糖显著高于好氧颗粒污泥(P<0.05),而蛋白质、腐殖酸、DNA、TOC含量与好氧颗粒污泥无显著差异(P>0.05)。好氧颗粒污泥TB-EPS中的多糖、TOC含量显著高于生物絮体(P<0.05),而蛋白质、腐殖酸和DNA无显著性差异(P>0.05)。可见生物絮体与好氧颗粒污泥中EPS的主要区别成分是多糖。
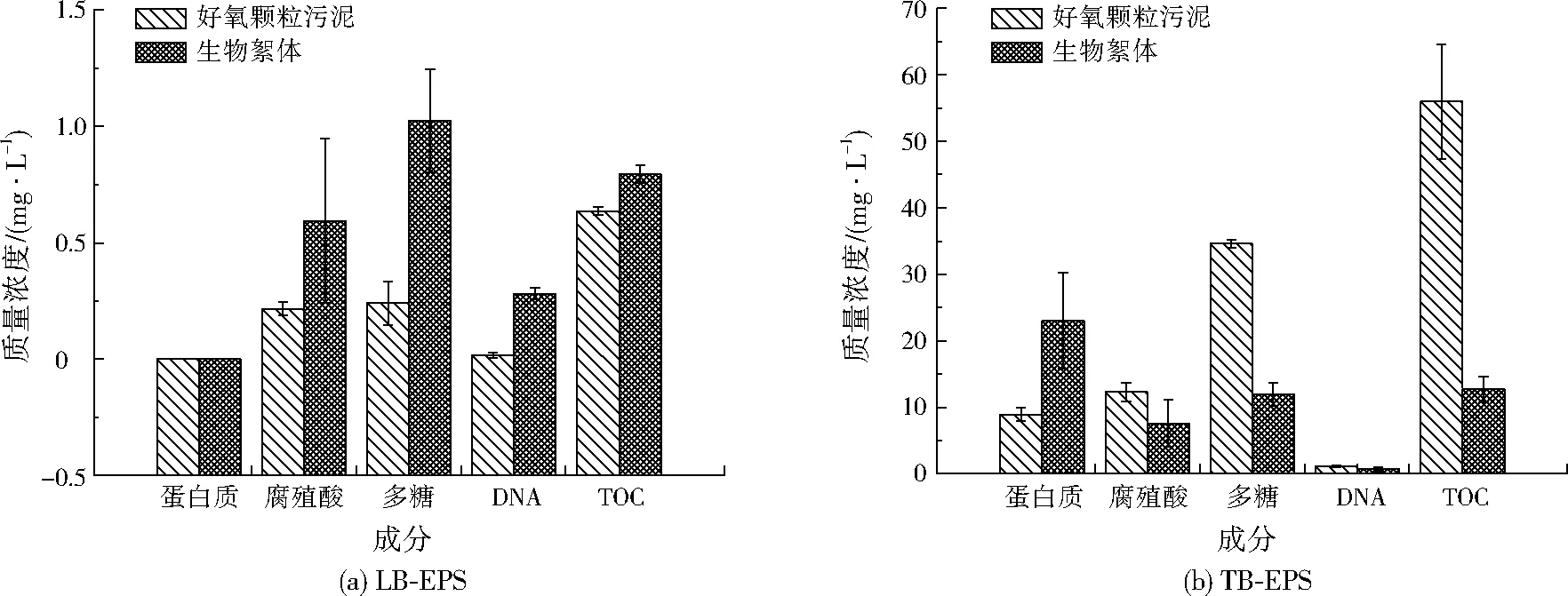
图7 生物絮体和好氧颗粒污泥EPS中蛋白质、腐殖酸、多糖、DNA、TOC质量浓度Fig.7 The content of protein,humic acid,polysaccharide,DNA,TOC in EPS of bioflocs and aerobic granule sludge
3 结 论
(1) 在SBR内接种生物絮体,用水产循环养殖废水培养好氧颗粒污泥,在溶解氧为6.4~7.1 mg/L的条件下,培养出的好氧颗粒平均粒径在150 μm,SBR内VSS在16.33~17.47 g/L,TSS在17.25~18.57 g/L,好氧颗粒污泥对水产循环养殖废水具有较好的处理效果,硝态氮、溶解性有机碳、溶解性磷酸盐去除率均在90%以上。运行结束后,好氧颗粒污泥粗蛋白和粗脂肪含量均高于接种生物絮体。
(2) 生物絮体内LB-EPS含量比好氧颗粒污泥高,而TB-EPS含量比好氧颗粒污泥低,这与生物絮体结构松散,而好氧颗粒污泥结构密实有关。生物絮体与好氧颗粒污泥中EPS的主要区别成分是多糖。
[1] 罗国芝,鲁璐,杜军,等.循环水养殖用水中反硝化碳源研究现状[J].渔业现代化,2011,38(3):11-17.
[2] VAN BUSSEL C G J,SCHROEDER J P,WUERTZ S,et al.The chronic effect of nitrate on production performance and health status of juvenile turbot (Psettamaxima)[J].Aquaculture,2012,326/327/328/329:163-167.
[3] CAMARGO J A,ALONSO A,SALAMANCA A.Nitrate toxicity to aquatic animals:a review with new data for freshwater invertebrates[J].Chemosphere,2005,58(9):1255-1267.
[4] SHOW K Y,LEE D J,TAY J H.Aerobic granulation:advances and challenges[J].Applied Biochemistry and Biotechnology,2012,167(6):1622-1640.
[5] MORGENROTH E,SHERDEN T,VAN LOOSDRECHT M,et al.Aerobic granular sludge in a sequencing batch reactor[J].Water Research,1997,31(12):3191-3194.
[6] 彭永臻,吴蕾,马勇,等.好氧颗粒污泥的形成机制、特性及应用研究进展[J].环境科学,2010,31(2):273-281.
[7] CHIU Z C,CHEN M Y,LEE D J,et al.Diffusivity of oxygen in aerobic granules[J].Biotechnology and Bioengineering,2006,94(3):505-513.
[8] 傅金祥,唐玉兰,王海彪,等.不同pH值下好氧颗粒污泥形成过程与特性[J].沈阳建筑大学学报(自然科学版),2010,26(4):734-738.
[9] 国家环保总局《水和废水监测分析方法》编委会.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[10] AZIM M E,LITTLE D C.The biofloc technology(BFT) in indoor tanks:water quality,biofloc composition,and growth and welfare of Nile tilapia(Oreochromisniloticus)[J].Aquaculture,2008,283(1/2/3/4):29-35.
[11] 张丽英.饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社,2003.
[12] FOLCH J L,SLOANE STANLEY G.A simple method for the isolation and purification of total lipids from animal tissues[J].Journal of Biological Chemistry,1957,226(1):497-509.
[13] LIU Yu,YANG Shufang,TAY J H,et al.Cell hydrophobicity is a triggering force of biogranulation[J].Enzyme and Microbial Technology,2004,34(5):371-379.
[14] MCSWAIN B S,IRVINE R L,HAUSNER M,et al.Composition and distribution of extracellular polymeric substances in aerobic flocs and granular sludge[J].Applied and Environmental Microbiology,2005,71(2):1051-1057.
[15] YU Guanhui,HE Pinjing,SHAO Liming,et al.Extracellular proteins,polysaccharides and enzymes impact on sludge aerobic digestion after ultrasonic pretreatment[J].Water Research,2008,42(8/9):1925-1934.
[16] FRØLUND B,PALMGREN R,KEIDING K,et al.Extraction of extracellular polymers from activated sludge using a cation exchange resin[J].Water Research,1996,30(8):1749-1758.
[17] 王畅,苏馈足,邓绣坤,等.活性污泥颗粒化过程中絮体与颗粒污泥竞争作用研究[J].合肥工业大学学报(自然科学版),2011,34(10):1536-1539.
[18] 王硕,于水利,徐巧,等.好氧颗粒污泥特性、应用及形成机理研究进展[J].应用与环境生物学报,2014,20(4):732-742.
[19] 王昌稳,赵白航,李军,等.好氧颗粒污泥吸附氨氮性能[J].化工学报,2014,65(3):942-947.
[20] 罗国芝,李文清,陈佳捷,等.生物絮凝技术在我国水产养殖中的应用研究现状和发展趋势分析[J].中国水产,2013(11):64-67.
[21] LIU Liping,HU Zhenxiong,DAI Xilin,et al.Effects of addition of maize starch on the yield,water quality and formation of bioflocs in an integrated shrimp culture system[J].Aquaculture,2014,418/419:79-86.
[22] 王爱民,韩光明,封功能,等.饲料脂肪水平对吉富罗非鱼生产性能、营养物质消化及血液生化指标的影响[J].水生生物学报,2011,35(1):80-87.
[23] CRAB R,DEFOIRDT T,BOSSIER P,et al.Biofloc technology in aquaculture:beneficial effects and future challenges[J].Aquaculture,2012,356/357:351-356.
[24] WINGENDER J,NEU T R,FLEMMING H C.Microbial extracellular polymeric substances: characterization,structure,and function[M].Heidelberg:Springer Science & Business Media,1999.
[25] SHENG Guoping,YU Hanqing,LI Xiaoyan.Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems:a review[J].Biotechnology Advances,2010,28(6):882-894.
[26] 龙腾锐,龙向宇,唐然,等.胞外聚合物对生物絮凝影响的研究[J].中国给水排水,2009,25(7):30-34.

