天冬氨酸-β-环糊精对土壤中芴和镉的分配行为研究*
徐 兰 胡苏杭 章绍康 王光辉
(东华理工大学水资源与环境工程学院,江西 南昌 330013)
土壤是人类赖以生存的重要的环境因素,但是20世纪80年代以来,随着我国经济地飞速发展,人们在农业生产中大量使用农药、化肥,工业企业大量排放重金属和有机物,使得进入土壤的有毒有害物质日益增多,土壤污染问题日益严重。镉(Cd)是一种生物毒性很强的重金属,而我国农田土壤中普遍存在着轻度到中度的Cd污染[1]。2014年的《全国土壤污染状况调查公报》显示,土壤Cd超标率居无机污染物首位[2],农田Cd 污染的面积已超过20×104hm2,每年产生出来的Cd 超标农产品达1.46×109kg[3]。多环芳烃(PAHs)是有机物的不完全燃烧产生的,部分来自森林失火、火山喷发等自然因素,但现在主要是由于汽车尾气排放、石油生产和加工等人为因素造成的[4]。随着经济的迅速发展,我国的PAHs排放量呈逐年增加趋势,以美国环境保护署(EPA)优先控制的16种PAHs为例,1999年我国PAHs的排放量为9 799 t,其中具有致癌性的7种PAHs为2 000 t[5]。芴是一种代表性PAHs,广泛用于制药、染料、杀虫剂、除草剂,在土壤中检出率较高。环糊精是由环糊精葡萄糖基转移酶作用于淀粉并由α-1,4糖苷键衔接构成的一类环状低聚糖,β-环糊精是其中的一种,由于它本身无毒且具有可生物降解性,因此是一种优良的环境友好材料,在环境领域有广泛地应用[6]。本研究在β-环糊精的基础上合成了水溶性更好的天冬氨酸-β-环糊精(ACD),同时对重金属具有配位能力、对有机物具有包结作用。笔者在研究ACD对芴的包结作用和对Cd的配位作用的基础上,着重研究了ACD对芴、Cd在土壤表面分配行为的影响,为复合污染土壤中重金属和有机物的同时增效修复提供理论基础。
1 实验部分
1.1 主要材料和仪器
仪器:DZ-6020型真空干燥箱;GM-0.33Ⅱ真空过滤机;TDL-5-A离心机;HH-S4恒温水浴锅;T6新世纪紫外—可见分光光度计;NEXUE470傅立叶变换红外光谱(FTIR)仪(美国Nicolet公司);KS康氏恒温振荡器;VG Multilab2000 X射线光电子能谱(XPS)仪(美国Thermo公司);Agilent55原子吸收光谱仪(美国Agilent公司);高效液相色谱(HPLC)仪(美国Agilent公司);F-7000型分子荧光光谱仪(日本Hitachi公司)。
试剂:β-环糊精、氢氧化钾、环氧氯丙烷、天冬氨酸、无水甲醇、无水乙醇、碳酸镉,均为分析纯;芴,纯度为99%。
土壤样品采自南昌某工业园区,pH=5.86,有机质质量浓度为26.40 g/kg,总氮质量浓度为1.68 g/kg,总磷质量浓度为0.28 g/kg,含水率为24.5%,阳离子交换容量(CEC) 为24.26×10-2mol/kg。
1.2 实验方法
1.2.1 ACD的合成
[7]的合成方法,在250 mL的锥形瓶中加入8.1 g β-环糊精,再加入70 mL的蒸馏水和6.7 g的氢氧化钾,搅拌至β-环糊精完全溶解,在水浴锅中加热至50 ℃,再加入13.3 g天冬氨酸,滴加10.2 g环氧氯丙烷,于60 ℃条件下反应1 h,冷却至室温,用硫酸调节pH至5~6,再加入160 mL无水乙醇,静置1~2 h,过滤后用水浴锅将滤液中的乙醇蒸出,并浓缩至30 mL,加入足量无水甲醇(约300 mL),静置过夜,过滤后真空干燥,得到12.9 g白色固体,即为ACD。
1.2.2 ACD与芴和Cd的相互作用
(1) ACD与芴的相互作用实验:配制质量浓度为2、4、6、8、10 g/L的ACD溶液,分别加入一定量的芴溶液,使芴质量浓度为1 mg/L,静置24 h后,用分子荧光光谱仪在275 nm激发波长下扫描发射光谱。
(2) ACD与Cd的相互作用实验:将过量的碳酸镉固体溶解到10 g/L的ACD溶液中,置于恒温振荡器里振荡48 h后离心分离,取上清液,经喷雾干燥处理后得到的样品以及ACD、碳酸镉分别用XPS仪进行分析。
1.2.3 土壤对β-环糊精和ACD的吸附行为
(1) 吸附动力学:称取2.0 g的土壤样品两份置于两个150 mL的锥形瓶中,分别加入20 mL质量浓度为7 g/L的β-环糊精或ACD溶液,然后置于恒温振荡器中,在(25±1) ℃、160 r/min条件下振荡,间隔一定时间取样,以3 000 r/min离心20 min后,取上清液测定β-环糊精或ACD浓度[8-11],确定吸附平衡时间和动力学方程。
(2) 吸附等温线:称取一系列2.0 g的土壤样品置于150 mL的锥形瓶中,分别加入20 mL不同质量浓度的β-环糊精或ACD溶液,然后置于恒温振荡器中,在(25±1) ℃、160 r/min条件下振荡至吸附平衡,以3 000 r/min离心20 min后,取上清液测定β-环糊精或ACD浓度,确定吸附等温线。
1.2.4 ACD对土壤中芴和Cd的分配系数影响
(1) 称取一系列2.0 g的土壤样品置于150 mL的锥形瓶中,分别加入20 mL质量浓度为50 mg/L的芴溶液,在此基础上加入不同质量浓度的ACD,在(25±1) ℃、160 r/min条件下恒温振荡,达到平衡后,以4 000 r/min离心30 min,取上清液,用HPLC仪测定芴的浓度,分别计算不同质量浓度ACD作用下芴的分配系数[12]。
(2) 称取一系列2.0 g的土壤样品置于150 mL的锥形瓶中,分别加入20 mL质量浓度为60 mg/L的Cd溶液,在此基础上加入不同质量浓度的ACD,在(25±1) ℃、160 r/min条件下恒温振荡,达到平衡后,以4 000 r/min离心30 min,取上清液,用原子吸收光谱仪测定Cd的浓度,分别计算不同质量浓度ACD作用下Cd的分配系数[13]。
分配系数的计算公式如下:
(1)
式中:Kd为芴或Cd的分配系数,L/kg;c为芴或Cd在土壤固相中的质量浓度,mg/kg;c’e为芴或Cd在液相中的平衡质量浓度,mg/L。
2 结果与讨论
2.1 ACD的FTIR分析
β-环糊精、天冬氨酸和ACD的FTIR分析结果见图1。857 cm-1为β-环糊精中的D-吡喃葡萄糖结构振动,946 cm-1为α-1,4糖苷键的骨架振动,1 026、1 153 cm-1处分别出现C—C与C—O键的耦合振动峰和C—O—C键的伸缩振动峰,3 193 cm-1为O—H伸缩振动,这些均为β-环糊精的特征峰。天冬氨酸的氨基反对称伸缩振动峰位于3 134 cm-1处,2 361 cm-1为天冬氨酸中羧基的特征峰。对比天冬氨酸和ACD可以得出,ACD中也有羧基产生,说明天冬氨酸中的羧基加入到了ACD中,但天冬氨酸上的氨基在ACD上并不明显,这是由于环氧基开环与部分氨基加成产生了新键—NH—,是没有N—H伸缩振动峰的。图1中ACD的1 397 cm-1峰与羧基中O—H的弯曲振动有关,这个振动峰是O—H的弯曲振动和O—C—C对称伸缩振动的合频,说明了ACD中羧基的存在,进一步证明ACD保留了大部分的β-环糊精的特征峰,表明ACD仍然保有β-环糊精的空腔结构。
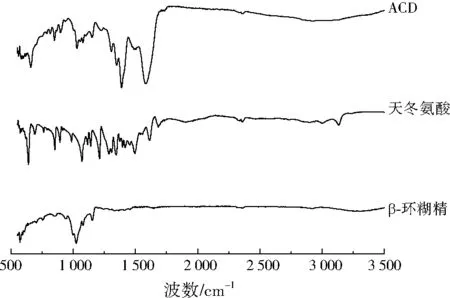
图1 β-环糊精、天冬氨酸和ACD的FTIRFig.1 FTIR of β-cyclodextrin,aspsrtic acid and ACD
2.2 ACD与芴的相互作用
ACD与芴相互作用的分子荧光光谱变化如图2所示。比较曲线1和曲线5可以发现,ACD本身不产生荧光,但是ACD与芴相互作用后会产生荧光。分析曲线2至曲线6发现,在发射波长为370 nm处有一个明显的芴的发射峰,且随着ACD浓度逐渐升高,检测到的荧光强度也相应增强,这是因为当芴进入ACD的疏水性空腔后发生包结作用,这种微环境的极性改变会导致量子化产率的提高,从而增强荧光强度[14],由此可以说明ACD与芴相互作用后已经发生了包结作用。
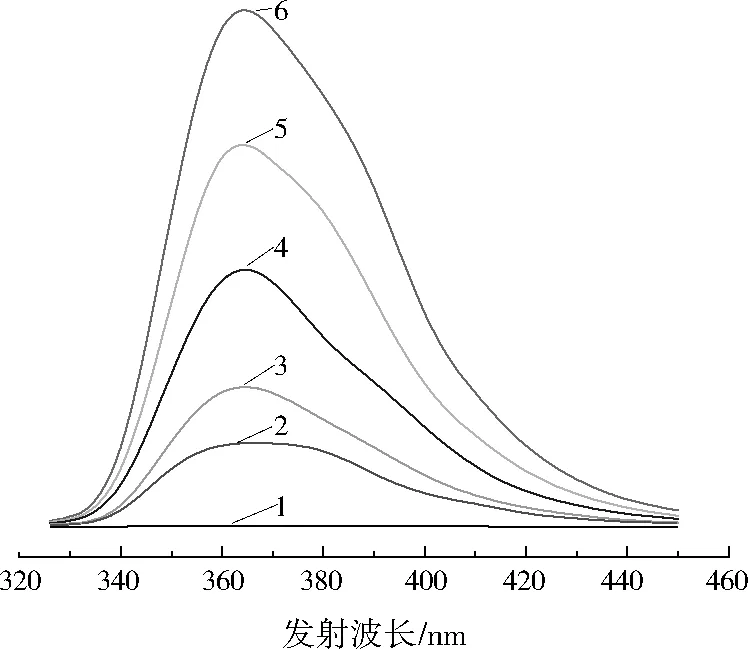
1—8 g/L ACD; 2—2 g/L ACD、1 mg/L芴; 3—4 g/L ACD、1 mg/L芴; 4—6 g/L ACD、1 mg/L芴;5—8 g/L ACD、1 mg/L芴;6—10 g/L ACD、1 mg/L芴图2 ACD与芴相互作用的分子荧光光谱Fig.2 Fluorescence emission spectra of the reaction of fluorene and ACD
2.3 ACD与Cd的相互作用
利用XPS研究了ACD与Cd之间的配位作用,主要配位元素配位前后结合能的变化如表1所示。生成的配合物与碳酸镉和ACD相比,Cd 3d、N 1s、O 1s的结合能发生了一定的偏移。Cd 3d 的结合能由碳酸镉的404.51 eV偏移到了配合物的405.31 eV;N 1s、O 1s的结合能由ACD的400.69、530.70 eV移到了配合物的401.29、531.58 eV,说明Cd已成功配位到ACD分子结构的氨基和羧基上。
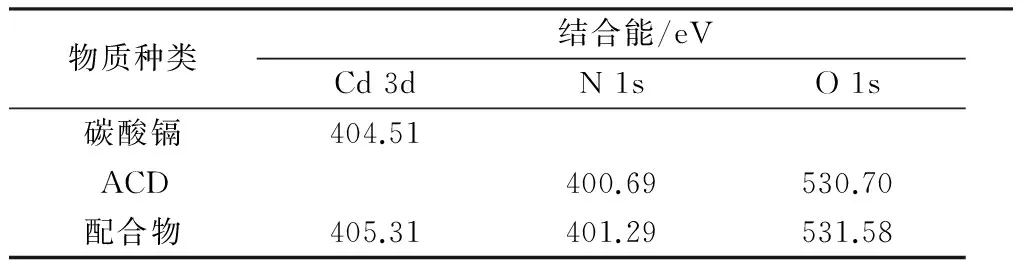
表1 碳酸镉、ACD及其配合物中的XPS分析
基于上述分析,ACD对芴的包结作用和对Cd的配位作用是在ACD分子结构的不同位置上进行的,ACD分子结构中的氨基和羧基对Cd的配位作用发生在空腔腔体的外部,而ACD对芴的包结作用发生在空腔腔体的内部,作用模式如图3所示。
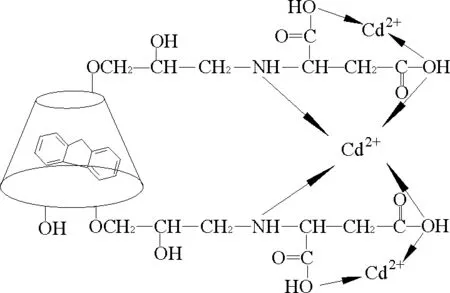
图3 ACD与芴、Cd的相互作用模式Fig.3 The interaction model of fluorene and cadmium with ACD
2.4 土壤对β-环糊精和ACD表面的吸附行为
2.4.1 吸附动力学研究
采用准一级动力学方程(见式(2))和准二级动力学方程(见式(3))对不同吸附时间的吸附量进行拟合。
ln(qe-qt)=lnqe-k1t
(2)
(3)
式中:qe为土壤对β-环糊精或ACD的平衡吸附量,mg/g;qt为t时土壤对β-环糊精或ACD的吸附量,mg/g;k1为准一级动力学吸附速率常数,min-1;t为吸附时间,min;k2为准二级动力学吸附速率常数,g/(mg·min)。
由图4可知,土壤对β-环糊精和ACD吸附平衡时间均为150 min。吸附动力学方程拟合结果见表2。由表2可知,准二级动力学方程的相关系数(R2)大于准一级动力学方程的相关系数,表明土壤对β-环糊精和ACD的吸附更符合准二级动力学方程,两者的准二级动力学吸附速率常数分别为0.000 6、0.001 7 g/(mg·min)。
2.4.2 吸附等温线研究
土壤对β-环糊精和ACD的吸附等温线如图5所示,用Langmuir吸附等温线模型(见式(4))进行拟合。
(4)
式中:ce为ACD或β-环糊精的平衡质量浓度,g/L;qmax为土壤对ACD或β-环糊精的最大吸附量,mg/g;K为Langmuir常数,L/mg。
Langmuir吸附等温线模型拟合参数见表3。从表3可以看出,土壤对ACD的最大吸附量为21.49 mg/g,而对β-环糊精的最大吸附量为95.58 mg/g,说明ACD水溶性更好,不容易被土壤固相吸附,能够更好地从土壤中分离出来,而且ACD具备对有机物的包结作用和对重金属的配位作用,因此ACD处理土壤重金属和有机物污染比β-环糊精具有更好的效果。
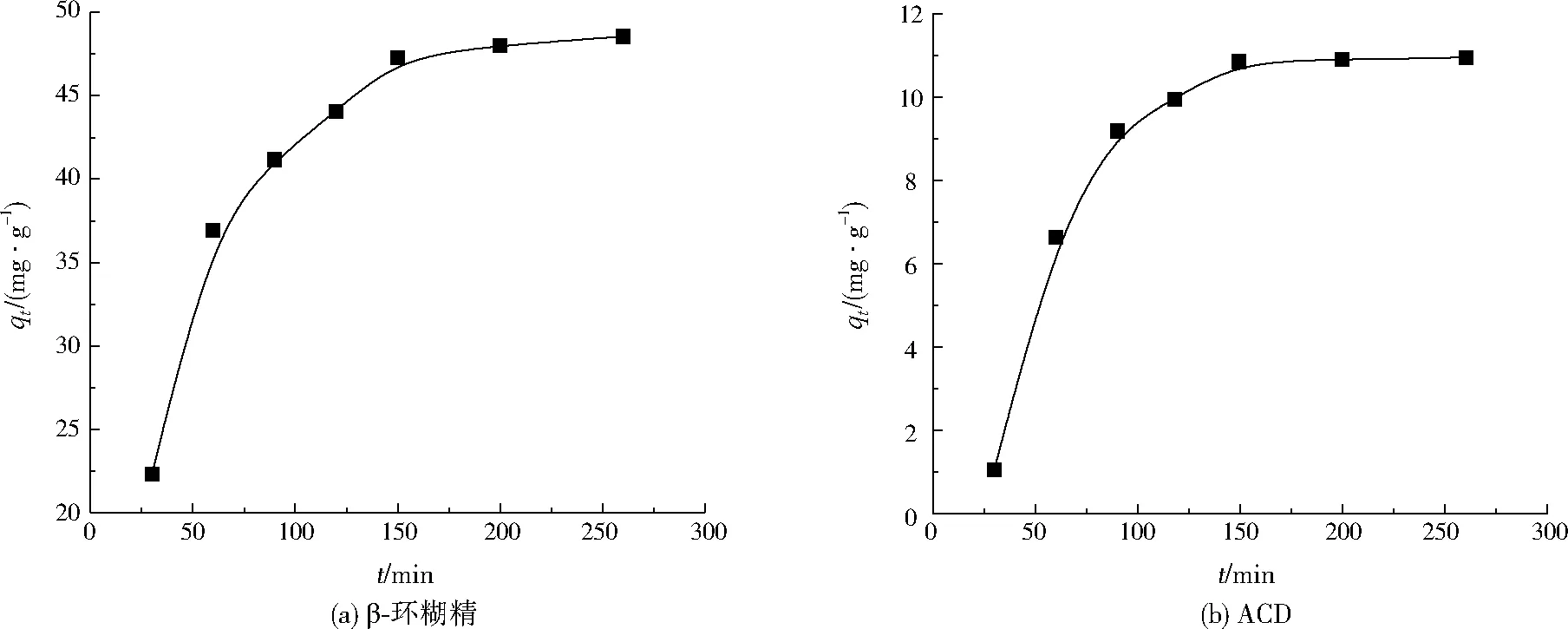
图4 土壤对β-环糊精和ACD的吸附动力学曲线Fig.4 Adsorption kinetic curve of soil on β-cyclodextrin and ACD
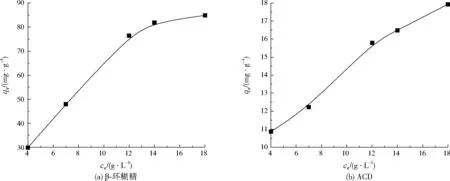
图5 土壤对β-环糊精和ACD的吸附等温线Fig.5 Adsorption isotherm curve of soil on β-cyclodextrin and ACD
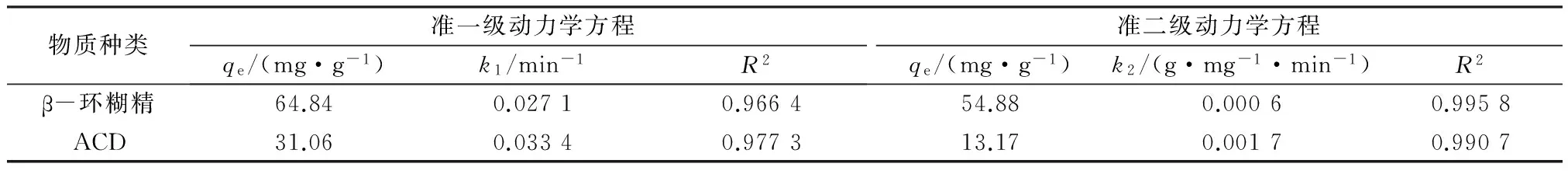
物质种类准一级动力学方程qe/(mg·g-1)k1/min-1R2准二级动力学方程qe/(mg·g-1)k2/(g·mg-1·min-1)R2β-环糊精64.840.02710.966454.880.00060.9958ACD31.060.03340.977313.170.00170.9907

表3 β-环糊精和ACD的Langmuir吸附等温线模型拟合参数

表4 ACD对土壤中芴的分配系数影响

表5 ACD对土壤中Cd的分配系数影响
2.5 ACD对土壤中芴的分配系数影响
不同质量浓度的ACD作用下,芴在土壤中的分配系数见表4。由表4可见,随着ACD浓度的增大,芴在土壤中分配系数变小,表明液相中的芴平衡浓度明显增大,说明ACD对芴的包结作用显著,因此ACD可以使芴等有机物从污染土壤中解吸,可以有效应用于污染土壤的修复。
2.6 ACD对土壤中Cd的分配系数影响
不同质量浓度ACD作用下,Cd在土壤中的分配系数见表5。由表5可见,随着ACD浓度的增大,Cd在土壤中的分配系数明显变小,说明吸附在土壤固相中的Cd在ACD作用下进入了液相,ACD对Cd的配位作用及ACD本身的水溶性特点是出现Cd从固相向液相转移的主要原因。因此,ACD也能使Cd等重金属从污染土壤中解吸,从而可以应用于污染土壤的修复。
3 结 论
(1) ACD的空腔结构可以对芴等有机物发生包结作用,羧基和氨基可以对Cd等重金属发生配位作用。
(2) 与β-环糊精相比,ACD水溶性更好,土壤对ACD的最大吸附量为21.49 mg/g,其吸附过程符合准二级动力学方程。
(3) ACD可以通过对芴等有机物的包结作用和Cd等重金属的配位作用使污染物从土壤固相中解吸,溶解到液相中,从而起到土壤修复的作用。
参考文献:
[1] WEI Binggan,YANG Linsheng.A review of heavy metal contaminations in urban soils,urban road dusts and agricultural soils from China[J].Microchemical Journal,2010,94(2):99-107.
[2] 环境保护部,国土资源部.全国土壤污染状况调查公报[R].北京:环境保护部,2014.
[3] 柳絮,范仲学,张斌,等.我国土壤镉污染及其修复研究[J].山东农业科学,2007(6):94-97.
[4] MURAKAMI M,NAKAGAWA F,AE N,et al.Phytoextraction by rice capable of accumulating Cd at high levels:reduction of Cd content of rice grain[J].Environmental Science & Technology,2009,43(15):5878-5883.
[5] 许姗姗,刘文新,陶澍.全国多环芳烃年排放量估算[J].农业环境科学学报,2005,24(3):476-479.
[6] WANG Guanghui,ZHOU Yueming,WANG Xuegang,et al.Simultaneous removal of phenanthrene and lead from artificially contaminated soils with glycine-β-cyclodextrin[J].Journal of Hazardous Materials,2010,184(1/2/3):690-695.
[7] 戴荣继,张婌,李方,等.含有氨基和羧基的β-环糊精衍生物合成及性能测试[J].北京理工大学学报,1998,18(2):159-164.
[8] LIU Yu,YOU Changcheng,WADA T,et al.Molecular recognition of fluorescent dyes with novel triethylenetraamine-tethered bis(β-cyclodextrin) and its copper(Ⅱ) complex:enhanced binding and selectivity by tether ligation[J].Tetrehedron Letters,2000,41(35):6869-6873.
[9] 孙延春.β-环糊精及其衍生物与TNS超分子包络物研究[J].化学研究与应用,2009,21(10):1447-1450.
[10] LIU Yu,YOU Changcheng,CHEN Yong,et al.Molecular recognition studies on supramolecular systems. 25. Inclusion complexation by organoselenium-bridged bis(β-cyclodextrin)s and their platinum(Ⅳ) complexes[J].Journal of Organic Chemistry,1999,64(21):7781-7787.
[11] WAGNER B D,MACDONALD P J.The fluorescence enhancement of 1-anilinonaphthalene-8-sulfonate (ANS) by modified β-cyclodextrin[J].Journal of Photochemistry and Photobiology A:Chemistry,1998,114(2):151-157.
[12] 朱利中,陈宝梁.多环芳烃在水/有机膨润土间的分配行为[J].中国环境科学,2000,20(2):119-123.
[13] 郝汉舟,靳孟贵,李瑞敏,等.重金属的土水分配行为研究——根际土壤溶液采样器的应用[J].土壤,2009,41(4):577-582.
[14] 靳兰,孙世新,刘育.超分子体系中的分子识别研究(一)——氨基酸修饰β-环糊精对客体分子TNS的包结配位研究[J].高等学校化学学报,2000,21(3):412-414.

