957例新生儿听力和聋病易感基因联合筛查结果分析
原晶晶,张帆,张淼,鲍诗平
(首都医科大学附属北京佑安医院耳鼻咽喉头颈外科,北京 100069)
957例新生儿听力和聋病易感基因联合筛查结果分析
原晶晶,张帆,张淼,鲍诗平
(首都医科大学附属北京佑安医院耳鼻咽喉头颈外科,北京 100069)
目的 探讨新生儿听力和聋病易感基因联合筛查的临床意义。方法 选择2014年1~l2月出生后42 d进行听力复查的957例新生儿,听力复筛采用畸变产物耳声发射(DPOAE)结合自动判别听性脑干反应(AABR)。新生儿在出生后3 d内均已采集足跟血检测9个常见耳聋基因突变位点,包括GJB2基因(35 del G、176 del 16、235 del C、299 delAT)、GJB3基因(538 C>T)、SLC26A4基因(IVS7-2A>G、2 168 A>G)、线粒体DNA 12S rRNA基因(1 555 A>G、1 494 C>T)。结果 听力复筛通过904例,未通过53例,复筛通过率为94.46%。突变携带者50例,携带率为5.22%。听力复筛通过人群中检测出突变携带者45例,携带率为4.98%;听力复筛未通过人群中检测出突变携带者5例,携带率为9.43%。结论 新生儿听力和聋病易感基因联合筛查,可发现部分听力筛查不能发现的高危耳聋新生儿和迟发性耳聋新生儿,并可进行婚育及用药指导。
新生儿;耳聋;听力筛查;基因
听力是日常生活中至关重要的能力,听觉障碍严重影响生活质量。据2006年全国第二次残疾人抽样调查显示,我国听力及言语残疾人口约为2 780万,其中7岁以下的聋儿约有80万[1]。耳聋有遗传和环境因素等多种病因,据报道儿童期感音神经性聋的发病率为1‰,重度先天性聋中有一半以上是遗传病因[2-3]。我国开展普遍的新生儿听力筛查已经超过10年,取得了重大成效。但在新生儿听力筛查中存在一些局限,并非所有的听力损失在出生后立即表现。对于迟发性耳聋,以及潜在的耳聋高危患儿,如药物敏感性耳聋或大前庭水管综合征,现有的筛查方式无法检出[4-5]。为此,2007年提出了听力和基因联合筛查的理念,旨在从遗传学角度早期发现迟发型耳聋患者并做到目标性随访[6]。本研究对957例新生儿听力复筛及聋病易感基因结果进行分析,报道如下:
1 资料与方法
1.1 研究对象 选择2014年1~l2月在首都医科大学附属北京佑安医院耳鼻咽喉头颈外科进行听力复筛的957例正常新生儿为研究对象。
1.2 方法 本研究按知情同意的原则,所有新生儿行听力复筛之前,家长均被详细讲解和告知听力复筛的相关知识,理解同意后进行检查。
1.2.1 听力筛查方法 听力复筛采用畸变产物耳声发射(DPOAE)结合自动判别听性脑干诱发电位(AABR)。复筛为出生后42 d左右,复筛未能通过的新生儿于出生3个月左右转诊至指定的听力诊断中心行评估和医学诊断,对于听力筛查和基因筛查结果异常者定期随访并提供听力学咨询。
1.2.2 聋病易感基因筛查 所有新生儿在出生后3 d内均已采集足跟血作为抽提基因组DNA的血样,应用微阵列芯片法检测9个常见耳聋基因突变位点(博奥生物有限公司),包括GJB2基因(35 del G、176 del 16、235 del C、299 del AT)、GJB3基因(538 C>T)、SLC26A4基因(IVS7-2A>G、2 168 A>G)、线粒体DNA 12S rRNA基因(1 555A>G、1 494 C>T)。
2 结果
2.1 听力筛查结果 957例新生儿中42 d听力复筛通过904例,未通过53例,复筛通过率为94.46%。其中双耳未通过22例,左耳或右耳未过31例。未通过婴儿均建议3个月后定期随访,1例双耳极重度听力损失,行单侧人工耳蜗植入术,基因筛查GJB2 176del16伴235delC复合杂合突变;4例轻度听力损失,其中1例基因筛查异常;27例双耳听力正常,其中2例基因筛查异常;10例家长自觉听力正常,未进行复查,其中1例基因筛查异常;11例失访。
2.2 聋病易感基因突变位点的检测结果 筛查957例新生儿检测出突变携带者50例,携带率为5.22%。在50例突变携带者中GJB2基因突变者31例,突变携带率3.24%,其中176 del 16杂合突变2例,235del C杂合突变21例,299 del AT杂合突变8例;GJB3基因538C>T杂合突变3例,突变携带率为0.31%;SLC26A4基因突变者17例,突变携带率为1.78%,其中2168A>G杂合突变1例,IVS7-2 A>G杂合突变16例;线粒体DNA 12S rRNA基因突变者3例,突变携带率为0.31%,其中1494C>T均质突变0例,1 555A>G均质突变3例;另外复合性突变4例,分别为GJB2 235delC杂合突变伴有SLC26A4 IVS7-2A>G杂合突变1例,GJB2 176del16杂合突变伴有GJB2 235delC杂合突变1例,GJB2 299delAT杂合突变伴有SLC26A4 IVS7-2A>G杂合突变1例,GJB2 235delC杂合突变伴有SLC26A4 2168A>G杂合突变1例(表1)。

表1 957例新生儿携带遗传性耳聋突变基因情况
2.3 听力和聋病基因联合筛查结果 957例受检者中听力筛查和基因筛查均通过者859例;听力筛查和基因筛查均未通过5例;听力筛查通过但基因筛查未通过45例;听力筛查未通过但基因筛查通过48例(表2)。听力复筛通过人群中检测出突变携带者45例,携带率为4.98%;听力复筛未通过人群中检测出突变携带者5例,携带率为9.43%。
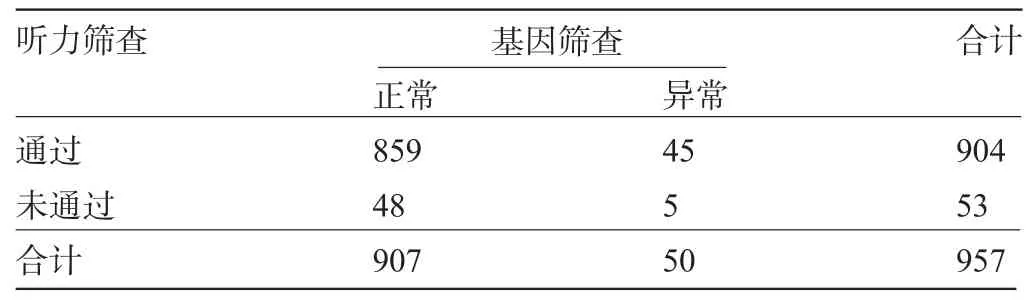
表2 听力筛查通过与未通过儿的基因筛查比较(例)
3 讨论
儿童先天性听力损失的早期发现在改善言语和语言功能上非常有价值,这为普遍的新生儿听力筛查提供了理论基础。新生儿听力与基因联合筛查可预知与遗传相关的迟发性耳聋和潜在的听障高危儿,弥补单纯听力筛查的局限性[7]。本研究对象为产后42 d的新生儿,耳道内羊水、胎脂、耵聍等分泌物已基本排出或吸收,初筛使用DPOAE,本科室听力复筛采用DPOAE及AABR,两项联合应用大大降低了假阳性结果发生的可能性[4]。本研究样本中的听力复筛通过率为94.46%,与聂文英等[8]报道的健康产妇所生新生儿大样本的听力复筛通过率93.97%相符。本研究中新生儿母亲为乙肝、丙肝及梅毒感染者,孕前或孕期经治疗,新生儿筛查结果未受此影响,而远期听力有无异常仍需进一步随访。本研究中外地患者所占比例较高,有一定的失访率,经反复电话随访仍有未行听力复查者,后期将进一步完善随访机制,在院期间强化宣教,普及听力知识。
文献报道GJB2基因突变是我国非综合征型感音神经性耳聋的首要致病基因[9-10],本研究中检出GJB2基因突变者31例,占致聋基因携带人群的62%,突变携带率为3.24%。与文献报道一致。其中176 del 16杂合突变2例,235del C杂合突变21例,299 del AT杂合突变8例。本研究中GJB2 176del16和235delC复合杂合突变为致病突变,听力筛查也未通过,两种检查结果相互印证。该患儿接受人工耳蜗植入术,目前恢复良好。本研究中其他GJB2杂合突变者目前并未出现听力下降,但GJB2杂合突变具有高度的遗传易患性,2个GJB2基因突变者婚配有25%的概率生育耳聋患儿[11],对研究中检出的杂合突变者,可以提供依据进行正确的成年期婚育指导。
本研究共检出GJB3 538C>T突变位点杂合突变3例,突变率为0.31%。GJB3基因突变可导致常染色体显性遗传性非综合征耳聋,也可导致常染色体隐性遗传性非综合征耳聋[12]。基因突变携带者可能是延迟性耳聋患者,虽通过新生儿听力筛查,且未表现出听觉异常,但需要密切注意听力状况,一旦出现听力异常,及时干预。听力异常的常染色体显性遗传性非综合征患者,有50%的概率遗传给后代,常染色体隐性GJB3基因538c>T杂合子突变携带者,应避免与其他耳聋基因携带人群的婚配,如GJB2基因GJB3基因双重杂合突变也能导致耳聋的发生[13]。
SLC26A4基因突变是仅次于GJB2基因突变导致感音神经性耳聋的遗传病因[14-15]。国内研究结果显示97.9%的前庭水管扩大患者具有SLC26A4基因突变[16]。本研究在新生儿中检出SLC26A4基因杂合突变17例,突变携带率为1.78%。前庭水管扩大综合征是感音神经性聋儿童中最常见的内耳异常,双耳受累多见,可从出生后至青春期这一年龄段内任何时期开始发病,发病突然或隐匿,听力下降呈进行性或波动性。首诊时可为重度、极重度聋,轻、中度听力损失者较少见,本病为常染色体隐性遗传。对SLC26A4基因的筛查,可明确诊断,提示患儿采取严格的防护措施,避免头颅外伤、感冒、周围环境压力的急剧改变及用力擤鼻等。
线粒体DNA 12S rRNA基因与氨基糖苷类抗生素易感性有关[17],具有母系遗传特性。本研究发现的3例1555A>G纯合突变新生儿,均通过了听力筛查,这类小儿如果使用氨基糖苷类抗生素,即使少量或微量,也可引起耳中毒,且耳聋不可逆转。经告知家长基因检测结果,并给予相关知识的讲解和用药指导后,此3例小儿目前听力良好。同时,由于线粒体DNA的母系遗传特点,此基因检测结果对该家系所有母系成员均起到预警作用。
在新生儿中开展耳聋基因筛查是对以往新生儿听力筛查的有力互补,能较早检出迟发性耳聋,早期干预,对药物性聋的敏感者也能早期检出,起到警示作用,具有重要的临床意义。本研究中听力复筛通过人群中检测出突变携带者45例,携带率为4.98%;听力复筛未通过人群中检测出突变携带者5例,携带率为9.43%,听力复筛未通过人群耳聋基因携带率明显高于听力复筛通过人群。通过本研究的结果提示在新生儿中开展耳聋基因筛查联合听力筛查意义重大,可在新生儿期筛查出有致聋因素的易患群,及时进行有效的听力防护和干预;特定的基因诊断有重要的临床意义,对筛查出致聋基因的携带者,对其未来的婚配、生育及用药有重要的指导作用。
笔者在后续工作中还需进一步研究耳聋基因检出阳性者与普通听力筛查结果的比较和印证,对基因或听力复筛异常儿童均进行至少5年的听力随访,督促患儿进行定期听力学检测,以便早期发现听力异常,早期治疗,减少听力残疾的发生。
[1]韩冰,李倩,纵亮.新生儿听力及基因联合筛查临床实践及筛查模式研究[J].中华耳科学杂志,2013,11(3):380-383.
[2] Nance WE.The genetics of deafness[J].Ment Retard Dev Disabil Res Rev,2003,9(2):109-119.
[3]Angeli S1,Utrera R,Dib S,et al.GJB2 gene mutations in childhood deafness[J].Acta Otolaryngol,2000,120(2):133-1336.
[4]Papacharalampous GX,Nikolopoulos TP,Davilis DI,et al.Universal newborn hearing screening,a revolutionary diagnosis of deafness:real benefits and limitations[J].Eur Arch Otorhinolaryngol,2011,268 (10):1399-406.
[5]管敏鑫,赵立东.与氨基糖甙类抗生素耳毒性相关的线粒体12SrRNA突变的流行病学特征[J].中华耳科学杂志,2006,4(2): 98-105.
[6]王秋菊,赵亚丽,兰兰,等.新生儿聋病基因筛查实施方案与策略研究[J].中华耳鼻咽喉头颈外科杂志,2007,42(11):809-813.
[7]王秋菊.新生儿聋病基因筛查——悄然的革命[J].听力学及言语疾病杂志,2008,16(2):83-88.
[8]聂文英,宫露霞,刘玉俊.10 501例新生儿听力筛查结果[J].中华医学杂志,2003,83:274-277.
[9]陈文霞,许政敏,杨晓林,等.非综合征型聋儿的GJB2基因突变55例分析研究[J].中国儿童保健杂志,2010,34(12):948-950.
[10]纪育斌,兰兰,王大勇,等.中国非综合征型聋患者GJB2基因突变流行病学文献荟萃分析[J].听力学及言语疾病杂志,2011,19(4): 67-68.
[11]Smith RJH,Robin NH.Genetic testing for deafness-GJB2 and SLC26A4 as causes of deafness[J].J Commun Disord,2002,35(4): 367-377.
[12]Xia JH,Liu CY,Fang BS,et a1.Mutations in the gene encoding gap juncaion protein beta-3 associated with autosomal dominant hearing impairment[J].Nat Genet,1998,20(4):370-373.
[13]李庆忠,王秋菊,赵立东,等.国人非综合征型遗传性聋患者GJB3基因突变分析[J].听力学及言语疾病杂志,2005,13(3):145-148.
[14]Yang T,Vidarsson H,Rodrigo-Blomqvist S,et a1.Transcriptional control of SLC26A4 is involved in Pendred syndrome and nonsvndromic enlargement of vestibular aqueduct(DFNB4)[J].Am J Hum Genet,2007,80(6):1055-1063.
[15]袁永一,戴朴,朱庆文,等.1552侧重度感音神经与SLC26A4基因IVS7-2 A>G突变相关的全序列分析[J].中华耳鼻咽喉头颈外科杂志,2009,44(6):449-454.
[16]赵亚丽.前庭水管扩大与SLC26A4基因分子流行病学研究[D].北京:中国人民解放军军医进修学院,2006.
[17]李倩,王秋菊.新生儿聋病易感基因筛查的研究进展[J].听力学及言语疾病杂志,2015,23(1):91-96.
Study of universal newborn hearing screening and deafness predisposing gene screening in 957 newborns.
YUAN Jing-jing,ZHANG Fan,ZHANG Miao,BAO Shi-ping.Department of Otorhinolaryngology-Head and Neck Surgery, Beijing Youan Hospital,Capital Medical University,Beijing 100069,CHINA
Objective To investigate the clinic significance of universal newborn screening with deafness predisposing genes in newborns.Methods A total of 957 newborns underwent hearing screening at 42 d after birth in our hospital from January 2014 to December 2014.Distortion product otoacoustic emissions(DPOAE)combined with autoauditory brainstem response(AABR)was used in hearing screening.These newborns had been taken blood sample at heel at 3 d after birth for detecting 9 common deafness genes mutation,including GJB2(35 del G,176 del 16,235 del C, 299 delAT),GJB3(538 C>T),SLC26A4(IVS7-2A>G,2 168 A>G)and mitochondria DNA 12S rRNA(1 555 A>G, 1 494 C>T).Results In 957 newborns of hearing screening,904 newborns showed“pass”,while 53 showed“refer”. The rate of showing“pass”was 94.46%.Mutation of deafness predisposing genes were detected in 50 cases,and the positive detection rate was 5.22%.Forty-five cases of mutations were detected in the newborns who passed hearing screening,with the positive detection rate of 4.98%.Five cases of mutations were detected in the newborns who did not pass hearing screening,with the positive detection rate of 9.43%.Conclusion Combined screening of neonatal hearing and deafness predisposing genes can detect newborns with high risk of hearing loss and delayed deafness,which has an important guiding effect in marriage,childbearing and medication.
Newborn;Deafness;Hearing screening;Gene
R722.19
A
1003—6350(2016)15—2441—03
10.3969/j.issn.1003-6350.2016.15.010
2016-03-06)
北京市丰台区卫生系统科学研究项目(编号:2014-18)
鲍诗平。E-mail:baoshiping@163.com

