内镜下黏膜切除大肠宽基息肉的治疗价值
陈丽芬,黄理,姚朝光
(河池市人民医院消化内科,广西 河池 547000)
内镜下黏膜切除大肠宽基息肉的治疗价值
陈丽芬,黄理,姚朝光
(河池市人民医院消化内科,广西 河池 547000)
目的 探讨大肠宽基息肉采用内镜下黏膜切除治疗的临床价值。方法通过前瞻性的随机对照方法的原则,纳入我院2011年9月至2014年7月收治的确诊为大肠宽基息肉的患者共120例,158个息肉,行内镜下黏膜切除术,手术切除的病理组织送病理科检查,记录并发症和成功率,评价内镜下黏膜切除术的安全性及有效性。结果120例患者的基底直径均在2 cm以上,其中2~3 cm者92例,>3 cm者28例;119例患者均一次性完整的剥离,仅一例患者转外科手术治疗,内镜下黏膜切除术的成功率达99.17%;治疗时间平均为85 min;出现即刻出血6例,迟发性出血者12例,经保守治疗后痊愈,仅1例并发穿孔转外科治疗;病理检查管状-绒毛状腺瘤72例,管状腺瘤24例,绒毛状腺瘤24例;40例伴低级别的上皮内瘤变,32例伴高级别的上皮内瘤变;基底边缘的组织并无病变残留。术后对所有患者进行1年的随访观察,均无复发患者及残留患者。结论内镜下黏膜切除治疗宽基息肉局部复发率低,是消化系统宽基息肉安全有效治疗方法,值得临床推广应用。
宽基息肉;内镜下黏膜切除术;内窥镜治疗;临床价值
随着内窥镜技术的不断发展,内镜下黏膜切除术已经成为消化系统息肉的重要治疗方法。目前对于基底直径较小的息肉,可以通过圈套器以及内镜下黏膜切除术进行治疗,但是对于直径较大息肉(>2 cm)内镜下黏膜切除术治疗还存在一定的争议及风险,使临床应用受到一定限制[1-2]。消化道系统的黏膜息肉是发病较为隐匿的常见性疾病,具有一定的潜在癌变风险,息肉-腺瘤-癌变是公认的黏膜息肉演变模式。因此对于腺瘤性息肉无论其大小部位均应当给予去除并行活检病理检查以了解其病理性质[3-4]。宽基息肉通常是指息肉基底较宽并与黏膜壁紧密连接,较带蒂息肉治疗难度大,在黏膜剥离或切除过程中稍有不慎容易导致肠壁的穿孔和病灶处的大出血,影响着治疗效果及预后[5]。近年来不断发展的内镜下黏膜切除术成为一种治疗浅表平坦型病变安全性较高的微创治疗方法[6]。通过内窥镜下完整的切除带病灶的黏膜组织从而达到治疗的目的,取下的病理组织送检之后可以明确病变的性质,有利于对临床预后及风险性加以判断评估,取得了较为满意的临床治疗效果,现将我院近年来的治疗患者报道如下:
1 资料与方法
1.1 一般资料 纳入我院2011年9月至2014年7月收治的确诊为大肠宽基息肉的患者共120例,158个息肉,男性65例,女性55例,年龄平均(46.23±11.36)岁,所有患者均因便血为主要症状入院,伴有不同程度的腹痛、腹泻、里急后重、贫血等相关临床表现。
1.2 治疗器械 电子肠镜(Olympus CF-Q240),20 MHz超声微探头,KD-611L德国爱尔博公司的氩气刀(APC)、圈套器(OLYMPUS SD-13U-1),钛夹装置(HX-610-135、HX-110UR),APC2氩离子凝固器,高频电发生器(RBE VIO 200S)。
1.3 治疗方法
1.3.1 术前评估 治疗前对所有的病变组织采用内窥镜检查,了解病变的深度及部位,并通过黏膜下探查病变抬举征是否为阳性,对抬举征阳性且位于固有肌层与黏膜层的病变组织实施内镜下黏膜切除术。
1.3.2 内镜下黏膜切除术治疗情况 根据息肉的具体情况,对于细长型的宽基带蒂息肉,可选用圈套器圈套蒂部高频电凝切除;对于粗长型的宽基带蒂息肉,则可应用金属钛夹夹闭蒂根部后再应用圈套器高频电凝切除;对于宽基短蒂息肉,则可以在黏膜下注射1:10 000肾上腺素盐水溶液后一次性内镜下黏膜切除(EMR)或分片黏膜切除(EPMR)。
1.3.3 内镜下黏膜切除术后处理 治疗之后嘱患者绝对卧床休息,采用抗生素预防感染、止血和补液治疗,加强病情的监测,尤其注意是否出现迟发性出血的情况,及时采用有效的治疗措施。
1.3.4 随访观察 所有患者均进行了为期1年的随访观察,并于半年及1年时行常规性的内镜检查以了解病灶回复情况及复发情况。
2 结 果
2.1 内窥镜下表现情况 本组120例患者均进行了内镜下黏膜宽基息肉的切除术,息肉内镜下表现为:病变组织均距肛缘在4~15 cm之间,基底直径均在2 cm以上,其中在2~3 cm的有92例,>3 cm的有28例;息肉形态为岛状不规则形态的有63例,扁平隆起形态的有57例,其他镜下表现为表面存在糜烂的有29例,充血水肿的有21例,有14例伴发散在出血。
2.2 内镜下黏膜切除宽基息肉治疗情况 所有患者均行一次完整的内镜下黏膜宽基息肉切除,其中119例患者成功,仅有1例患者转外科手术治疗,内镜下黏膜切除术的成功率达99.17%,治疗时间为44~132 min,平均85 min,其中手术时间在40~80 min者30例,81~120 min者67例,121~160 min者23例;治疗过程中均有不同程度的出血,术中出血量在10~20 mL者34例,21~40 mL者58例,41~100 mL者27例,>100 mL者1例。其中1例4 cm直径息肉患者在黏膜切除的过程中出现了难以控制性出血并发穿孔转外科治疗,其余患者均未见其他严重并发症发生,治疗过程中采用钛夹止血和电凝止血处理之后出血得到了有效控制,术后预防性使用抗生素抗感染,并无发热、腹痛,出现即可出血6例,迟发性出血的有12例,经保守治疗后痊愈。
2.3 内镜下黏膜宽基息肉切除病理检查 所有患者均进行了病灶完整切除并行病理检查,结果显示,未见边缘或基地的病变组织残留,病理检查管状-绒毛状腺瘤72例(图1A),管状腺瘤24例(图1B),绒毛状腺瘤24例;40例伴低级别的上皮内瘤变(图1C),32例伴高级别的上皮内瘤变(图1D)。
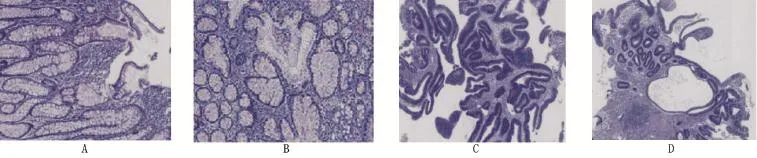
图1 黏膜下宽基息肉切除病理检查(×100)
2.4 随访情况 所有患者均获得为期1年的随访,通过半年、1年内镜检查结果示,患者创面基本痊愈,在术后半年的时候形成的红色瘢痕缓慢消失,经过1年的随访观察,均无复发及残留患者。
3 讨 论
消化道息肉是消化系统的常见疾病,宽基息肉又是消化道息肉里面腺瘤性息肉所占比例较高的一种形式,具有一定的恶变概率,一旦发现均需要进行息肉的切除治疗[7]。随着内镜治疗技术的不断发展,内镜下黏膜息肉切除技术是最常见的内镜息肉切除技术,其操作简单,患者痛苦较少,已在临床上广泛应用[8-10]。但是对于不同类型息肉的操作方法有所差异,对于各种带蒂息肉,使用圈套器或者电凝治疗即可对息肉进行切除,而对于无蒂、宽基或者扁平的息肉类型,还需要针对息肉大小及部位等情况行活检钳或者热活检电切术治疗[11-12],尤其对于较大的宽基息肉,直接行圈套器息肉切除治疗容易伤及深层的肌层组织,引发大出血或外膜穿孔,因此对于此类息肉治疗的镜下切除术的安全性尚存在一定争议[13-14]。
内镜下黏膜切除术是近年来发展起来的一项对宽基息肉具有重要治疗价值的方法[15-16],可以在一次性完成直径2 cm以上的宽基息肉的切除,其切除的深度可达黏膜下层,扩宽了内镜治疗的适应证,使之前只能通过手术治疗切除的病变,在内镜下即可完成,取得了良好的临床治疗效果,本研究纳入病例的治疗时间在44~132 min,平均为85 min,119例患者成功,仅有1例患者转外科手术治疗,内镜下黏膜切除术的成功率达99.17%,大大缩短了治疗时间,提高了临床治疗效率。
由于宽基息肉以腺瘤为主,具有一定的恶变可能,因此主要表现为浸润性生长的特点,由于黏膜下层滋养血管较为丰富,因此位于低位的直肠宽基息肉在操作的过程中发生出血难以避免,出血导致操作视野的模糊,影像息肉的切除操作,而盲目的止血又可能进一步诱发穿孔的发生,导致不得不终止操作,因此术后尽量减少出血并有效止血,对操作尤为关键[17-18]。对于较为明显的出血及黏膜下血管,需要在治疗过程中使用热活检止血,完整切除病灶之前避免使用钛夹以免影响接下来的操作顺利进行。
内镜下结肠息肉最常见的并发症为出血和穿孔,出血又包括治疗过程中的出血及术后的迟发性出血,其中又以迟发性出血最为常见。本研究中有12例出现了迟发性出血,对于该项并发症应当重视并做好术后的观察和预防工作,对于裸露血管和出血点需要进行镜下的电凝处理,对于较粗的血管应当使用钛夹夹闭,有效的防止术后出血的可能。同时完善的术前准备、仔细的术中操作及优质的术后护理也是预防并发症的关键环节,掌握手术适应证和禁忌证是避免并发症的根本。术后观察是治疗的关键,一旦发现便血应及早进行肠镜检查,了解出血的部位及性质。本研究中所有的迟发性出血患者经过及时有效的保守治疗均得到了有效控制。本研究中术后严重并发症仅1人,出现了出血穿孔现象,随着内镜技术的不断改进,并发症的发生率大大降低了,但是由于该例患者病变组织较大,且部位较深,在操作过程中出血影响了视野,增加了并发症出现的可能性。所有患者均获得为期1年的随访,通过半年、1年内镜检查结果示,患者创面基本痊愈,在术后半年的时候形成的红色瘢痕缓慢消失,经过1年的随访观察,均无复发及残留患者。通过本例患者我们总结经验,今后的操作需要更加的重视出血的止血工作,术前应当做好肠道准备,降低视野模糊的可能性。
综上所述,随着内镜下黏膜切除宽基息肉的患者的不断增多,操作的娴熟,局部的并发症发生率得到了有效控制,该项技术对于宽基息肉的治疗是安全有效的,应当不断地总结治疗经验,重视术后的观察,进一步提高治疗的安全性。
[1]尹淑华,王付军.增生性息肉与锯齿状腺瘤研究现状[J].济宁医学院学报,2011,34(2):142-144.
[2]杜桂清.结肠息肉278例临床病理分析[J].贵阳医学院学报,2010, 35(2):188-189.
[3]楼国春,杨建民,柯进晶,等.大肠息肉内镜漏诊及其相关因素分析[J].浙江医学,2014,36(2):98-101.
[4]许文安,汪芳裕,施惠.内镜下黏膜切除术治疗消化道隆起性病变的价值[J].南京医科大学学报(自然科学版),2010,33(12): 1804-1805.
[5]戴小华.内镜下切除大肠息肉592例的体会[J].海南医学,2010,21 (7):78-79.
[6]Sanchez-Yague A,Kaltenbach T,Raju G,et al.Advanced endoscopic resection of colorectal lesions[J].Gastroenterol Clin North Am, 2013,42(3):459-477.
[7]Probst A,Messmann H.Colorectal adenoma:Pro-endoscopic removal[J].Chirurg,2011,82(6):514-519.
[8]Saito Y,Fukuzawa M,Matsuda T,et al.Clinical outcome of endoscopic submucosal dissection versus endoscopic mucosal resection of large colorectal tumors as determined by curative resection[J].Surg Endosc,2010,24(2):343-352.
[9]Rahul K,Muhammad AS,Hendrickse MT.Endoscopic mucosal resection of large colorectal polyps:outcomes from a district UK screening centre[J].Acta Gastroenterol Belg,2013,76(2):225-230.
[10]韩海峰.内镜下治疗大肠息肉68例临床分析[J].中国医学创新, 2013,10(1):113-114.
[11]于冰,唐星火,吕小平,等.EMR治疗老年结直肠无蒂息肉临床应用观察[J].广西医科大学学报,2012,29(2):264-266.
[12]邹龙,刘红专,蔡华蓉,等.氩离子凝固术治疗肠息肉电凝切除术后18例出血患者临床观察[J].海南医学,2011,22(4):81.
[13]张文明,沈俊,张召珍,等.结直肠息肉内镜下特点及治疗[J].中国癌症杂志,2010,20(8):621-625.
[14]Seo GJ,Sohn DK,Han KS,et al.Recurrence after endoscopic piecemeal mucosal resection for large sessile colorectal polyps[J].World J Gastroenterol,2010,16(22):2806-2811.
[15]吕历,高燕.EMR/ESD中黏膜下注射材料的研究进展[J].医学综述,2011,17(22):3476-3478.
[16]Aoki T,Nakajima T,Saito Y,et al.Assessment of the validity of the clinical pathway for colon endoscopic submucosal dissection[J]. World J Gastroenterol,2012,18(28):3721-3726.
[17]Saito Y,Uraoka T,Yamaguchi Y,et al.A prospective,multicenter study of 1111 colorectal endoscopic submucosal dissections(with video)[J].Gastrointest Endosc,2010,72(6):1217-1225.
[18]李建国.结直肠腺瘤性息肉诊疗新进展[J].国际病理科学与临床杂志,2011,31(2):150-154.
R574.6
B
1003—6350(2016)12—2016—03
10.3969/j.issn.1003-6350.2016.12.041
2015-11-11)
陈丽芬。E-mail:chenlifen906@sina.com

