人脐带间充质干细胞释放膜微囊相对理想条件的体外实验研究
金鑫,吴波,毕晓云,陈晶砺,卢怀笋,钟转弟,温丽娟
(1.广州开发区医院检验科,广东 广州 510730;2.广东省江门中医药学校,广东 江门 529000)
人脐带间充质干细胞释放膜微囊相对理想条件的体外实验研究
金鑫1,吴波2,毕晓云1,陈晶砺1,卢怀笋2,钟转弟1,温丽娟1
(1.广州开发区医院检验科,广东 广州 510730;2.广东省江门中医药学校,广东 江门 529000)
目的 通过体外实验考察人脐带间充质干细胞释放膜微囊的相对理想条件。方法将人脐带间充质干细胞培养5代后,再以血清和低氧为交互培养条件,分别进行有血清-常氧(Norm)、无血清-常氧(SF)、有血清-低氧(Hypo)及无血清-低氧(Hypo-SF)四种不同条件下的72 h培养,最后收集膜微囊进行观察鉴定,同时采用流式细胞术分析膜微囊表面分子表达及蛋白定量。结果透射电子显微镜观察结果显示,不同培养条件下的样本照相均有观察到膜状结构,且其中心呈低密度区,多数膜结构直径不超过100 nm,部分发生聚集,整体形态学特征符合膜微囊特点;流式细胞术分析膜微囊的表面标记与来源细胞人脐带间充质干细胞相似,二者均表达CD29、CD44、CD73及CD105,对CD31及CD45不表达,提示该膜微囊为来源于人脐带间充质干细胞;收获细胞数分别为Norm培养:(1.63±0.28)×108个,SF培养:(0.72±0.25)×108个,Hypo培养:(2.32±0.34)×108个,Hypo-SF培养:(1.48±0.33)×108个,Hypo培养显著高于Norm、SF、Hypo-SF培养,差异有统计学意义(t=3.367、6.925、4.216,P<0.05),Hypo-SF显著高于SF培养(t=2.917,P<0.05),差异有统计学意义,Norm培养与Hypo-SF培养差异无统计学意义(t=0.827,P>0.05)。膜微囊蛋白总量从高到低依次为Hypo培养、Hypo-SF培养、SF培养及Norm培养,相同细胞数量所产生的膜微囊蛋白总量从高到低依次为Hypo-SF培养、Hypo培养、SF培养及Norm培养。结论低氧是促进人脐带间充质干细胞释放膜微囊相对更为理想的条件之一,同时建议采用低氧条件下的无血清培养。
人脐带间充质干细胞;膜微囊;释放;条件;体外实验
间充质干细胞(Mesenchymal stromal cell,MSC)为一类成体干细胞总称,此类细胞不仅具有较强的体外增殖能力及调节多种免疫细胞功能的作用,还具备成脂细胞和成软骨细胞等多种细胞分化的功能[1]。目前MSC已获得初步应用,且进展顺利[2-3]。同时大量研究业已证实[4-6],MSC还具有颇强的促血管再生作用,这进一步为心肌梗死与外周血管病的临床治疗指出了新的方向。稍早期的一些研究指出,MSC促血管再生的主要机制是基于其所具有的旁分泌作用[7],但新近的体外实验研究发现,由MSC所释放的膜微囊(Microvesicles,MV)在体外可显著增强血管内皮细胞的增殖能力,故推测其可对机体内已发生损伤的血管具修复作用[8]。人脐带间充质干细胞(Human umbilical cord mesenchymal stromal cell,hUC-MSC)是指存在于新生儿脐带组织中的一种多功能干细胞,其兼具有易于大量获取、免疫原性低以及可在不加用免疫抑制剂的情况下长期存活等诸多优势,较其他种类MSC更具临床开发前景[9]。本研究对hUC-MSC释放MV的相对理想条件进行了体外实验探索,旨在为后续临床应用hUC-MSC-MV开展外周血管病等疾病的治疗提供理论基础,报道如下:
1 材料与方法
1.1 材料
1.1.1 标本采集 本研究脐带标本均取自健康足月顺产的新生儿,共5份,由笔者所在医院产科提供。产妇及其家属对本研究均知情同意,符合医院伦理委员会制定的人标本实验应用规范。
1.1.2 试验设备及试剂 人脐带MSC培养用胎牛血清(购自Stemcell公司);alpha-MEM培养液(购自维森特生物技术有限公司);磷酸缓冲液PBS(自制);2-吗啉乙磺酸生物缓冲液MES(自制);透射电子显微镜(H-7650型,购自日立公司);Optima L-100XP型超速离心机(Beckman Coulter公司);乙酰化乳胶珠(Invitrogen公司);PE标记的小鼠抗人CD29、CD31、CD44、CD45、CD73及CD105单克隆抗体(SEROTEC公司)。
1.2 方法
1.2.1 人脐带MSC的培养及鉴定 参考徐燕等[10]文献资料进行人脐带MSC培养。在培养过程中对全部标本细胞进行形态学观察、表明标记检测及分化能力鉴定,所获细胞均符合人MSC特征[11]。将细胞培养5代后再开展后续实验。
1.2.2 细胞预处理 先将MSC悬浮于Alpha-MEM培养液中,培养液分含或不含10%胎牛血清两种,接着分别接种到150 mm的培养皿中,每皿含细胞2×106个,以血清和低氧(1.0%)为交互培养条件,将接种后的培养皿各20份样本分别放置到有血清-常氧(Norm)、有血清-低氧(Hypo)、无血清-常氧(SF)及无血清-低氧(Hypo-SF)四种不同条件下的培养箱培养72 h。
1.2.3 收集MV并观察鉴定 采用胰蛋白酶消化贴壁细胞,活细胞采用台盼蓝拒染法计数。收集培养上清液离心处理,2 000×g离心10 min将细胞碎片去除,接着以0.45 μm滤膜过滤。再将上清液以100 000×g离心处理2 h,并采用PBS将获得的沉淀物(MV)洗涤2 h,再接着向其加入缓冲液(含KCl为5 mmol/L,MgCl2为1 mmol/L,NaCl为136 mmol/L),混匀后以每管50 μL分装至Ultra-Clear离心管中,放置到-80℃冰箱中并采用透射电子显微镜对hUC-MSC-MV的形态特征进行逐一观察鉴定,同时放大10 000倍照相。
1.2.4 hUC-MSC-MV的表面分子表达及蛋白定量分析 参照文献[12]方法进行表型标记分析。将MV悬液加入到悬浮有直径3.9 μm乙酰化乳胶珠的MES缓冲液中,在4℃环境中反应并过夜,次日将乳胶珠洗涤去除,分别加入各单克隆抗体后室温下避光反应20 min。再次PBS洗涤,流式细胞仪收集数据,采用WinMdi 2.9软件对收集到的数据资料进行分析,以代表单个及两个珠子聚合的点数据设门,分析相对荧光强度。用牛血清白蛋白标准品制备标准曲线采用Bradford法测定蛋白含量。
1.3 统计学方法 采用SPSS17.0统计学软件包对实验数据进行统计学分析,计量资料以均数±标准差(±s)表示,采用t检验,取检验水准α=0.05,P<0.05为差异具有统计学意义。
2 结 果
2.1 MV的形态学特征及鉴定 透射电子显微镜观察结果显示,不同培养条件下的样本照相均有观察到膜状结构,且其中心呈低密度区,多数膜结构直径不超过100 nm,部分发生聚集,整体形态学特征符合膜微囊特点[13],见图1。

图1 10 000倍hUC-MSC-MV电子显微镜下的形态特征
2.2 MV携带MSC表型标记分析结果 MV的表面标记与来源细胞hUC-MSC相似,二者均表达CD29、CD44、CD73及CD105,对CD31及CD45不表达,见图2。说明该MV为来源于hUC-MSC,为hUC-MSC-MV。
2.3 不同培养条件下的hUC-MSC细胞计数及MV蛋白总量比较 结果显示,收获细胞数分别为Norm培养:(1.63±0.28)×108个,SF培养:(0.72±0.25)× 108个,Hypo培养:(2.32±0.34)×108个,Hypo-SF培养:(1.48±0.33)×108个,Hypo培养显著高于Norm、SF、Hypo-SF培养,差异有统计学意义(t=3.367,6.925,4.216,P<0.05),Hypo-SF显著高于SF培养,差异有统计学意义(t=2.917,P<0.05),Norm培养与Hypo-SF培养,差异无统计学意义(t=0.827,P>0.05);MV蛋白总量从高到低依次为Hypo培养、Hypo-SF培养、SF培养及Norm培养;将收获细胞数与MV蛋白总量相结合进行比较发现,相同细胞数量所产生的MV蛋白总量从高到低依次为Hypo-SF培养、Hypo培养、SF培养及Norm培养(图3)。
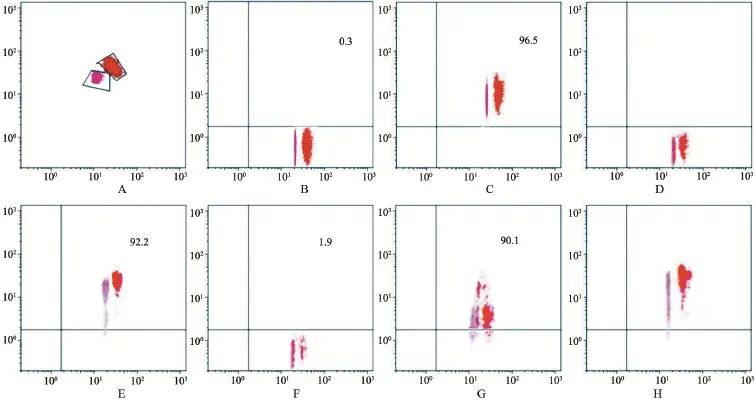
图2 MV携带MSC表型标记分析
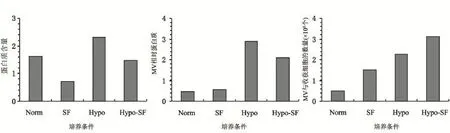
图3 hUC-MSC收获的细胞数
3 讨 论
MV为一种膜状结构。由多种细胞在激活、增殖甚至静息状态下释放,可作为细胞间相互作用的重要介质[14-16]。研究认为,MSC具有促血管再生功能,而该功能并非源于细胞的直接分化作用,而应主要归功于其所产生的MV[17]。然而,目前对通过体外培养MSC来产生MV的实验条件尚未形成统一认识。
本研究发现,MV蛋白总量从高到低依次为Hypo培养、Hypo-SF培养、SF培养及Norm培养,其中Hypo培养、Hypo-SF培养的MV蛋白总量高于SF培养和Norm培养,该结果提示低氧可促进MSC释放MV。但低氧促进MSC释放MV的机制,至今尚未阐明。但从已开展的相关研究中可窥见一二。如有研究显示,低氧对骨髓及脐带MSC的增殖具有促进作用[18],细胞在增殖或被激活过程中会释放MV,低氧条件下,细胞较强的增殖能力也可致使MSC释放MV。本研究结果显示,Norm培养(1.63±0.28)×108个,SF培养(0.72±0.25)× 108个,Hypo培养(2.32±0.34)×108个,Hypo-SF培养(1.48±0.33)×108个,Hypo和Hypo-SF培养数显著高Norm、SF培养,差异有统计学意义,与相关研究相符。证实了低氧有助于骨髓及脐带MSC的增殖。
脐带MSC在低氧刺激48 h后即可在mRNA水平高表达低氧诱导因子(HIF)[19]。刺激持续72 h,MSC高表达HIF蛋白分子以及与能量代谢相关的分子,如乳酸脱氢酶和葡萄糖转移酶-1等。HIF是血管内皮生长因子(VEGF)及促红细胞生成素(EPO)的关键调控因子,它们是低氧刺激下细胞主要的反应因子,与血管新生密切相关[20]。此外,我们在研究中进一步将收获细胞数与MV蛋白总量相结合进行比较发现,相同细胞数量所产生的MV蛋白总量从高到低依次为Hypo-SF培养、Hypo培养、SF培养及Norm培养,Hypo-SF培养与其他三种培养比较以及Hypo培养与后两者比较均有显著性差异,提示无血清培养也可增加MSC释放MV的量。其具体机制目前未见报道,有待进一步研究。但我们可以肯定的是,在加用血清进行培养后,为确保后续实验的可靠性,我们还必须将血清离心清除,而这个过程也难免不会对MV造成干扰。同时血清本身还可能存在有病毒活性及其他未知微生物,不仅可混杂于MV中而影响相关检测,而且也在一定程度上增加了研究者及临床试验者的感染风险。故总体来看,完全没必要将血清纳入hUC-MSC体外培养释放MV的培养基质材料,甚至不用的益处更多。
总之,本次体外实验结果提示,低氧是促进hUC-MSC释放MV相对更为理想的条件之一,这可为临床应用hUC-MSC-MV开展外周血管病等疾病的治疗提供理论基础。然而,低氧促进hUC-MSC释放MV的具体机制,改变条件所生产的MV所携带的活性物质是否也同时具有某些质的差异,仍有待进一步探索阐明。
[1]Bianco P,Cao X,Frenette PS,et al.The meaning,the sense and the significance:translating the science of mesenchymal stem cells into medicine[J].Nat Med,2013,19(1):35-42.
[2]马锡慧,肖漓,石炳毅.间充质干细胞免疫抑制作用及其在移植免疫中应用的研究进展[J].中华细胞与干细胞杂志,2015,5(1): 46-51.
[3]侯威宇,程艳伟,向川.间充质干细胞源性微囊泡和诱导性多潜能干细胞促进关节软骨修复的进展[J].中国组织工程研究,2015,19 (41):6706-6710.
[4]Paul D,Samuel SM,Maulik N.Mesenchymal stem cell:present challenges and prospective cellular cardiomyoplasty approaches for myocardial regeneration [J].Antioxid Redox Signal,2009,11(8): 1841-1855.
[5]Choi YH,Kurtz A,Stamm C.Mesenchymal stem cells for cardiac cell therapy[J].Hum Gene Ther,2011,22(1):3-17.
[6]Williams AR,Hare JM.Mesenchymal stem cells:biology,pathophysiology,translational findings,and therapeutic implications for cardiac disease[J].Circ Res,2011,109(8):923-940.
[7]Mummery CL,Davis RP,Krieger JE.Challenges in using stem cells for cardiac repair[J].Sci Transl Med,2010,2(27):27-30.
[8]冯文磊,张猛,徐芳洁,等.共培养体系间充质干细胞对同源内皮祖细胞增殖和血管形成的影响[J].医学研究生学报,2015,28(3): 229-235.
[9]Choumerianou DM,Martimianaki G,Stiakaki E,et al.Comparative study of stemness characteristics of mesenchymal cells from bone marrow of children and adults[J].Cytotherapy,2010,12(7):881-887.
[10]徐燕,李长虹,孟恒星,等.人脐带间充质干细胞分离培养条件的优化及其生物学特性[J].中国组织工程研究与临床康复,2014,13 (32):6289-6294.
[11]Jin JD,Wang HX,Xiao FJ,et al.A novel rich source of human mesenchymal stem cells from the debris of bone marrow samples[J]. Biochem Biophys Res Commun,2008,376(1):191-195.
[12]Zhang HC,Liu XB,Huang S,et al.Microvesicles derived from human umbilical cord mesenchymal stem cells stimulated by hypoxia promote angiogenesis both in vitro and in vivo[J].Stem Cells Dev, 2012,21(18):3289-3297.
[13]Combes V,AC Simon,GE Grau,et al.In vitro generation of endothelial microparticles and possible prothrombotic activity in patients with lupus anticoagulant[J].J Clin Invest,1999,104(1):93-102.
[14]裴杰,郭宪,张林,等.质膜微囊蛋白3的功能与相关疾病研究进展[J].兰州大学学报:自然科学版,2015,51(5):716-722.
[15]刘柏炎,俞悦,易健,等.细胞质膜微囊蛋白1敲除小鼠神经干细胞培养与生物学特性[J].中国组织工程研究,2014,18(23):716-722.
[16]洪勉名,陈建英.间充质干细胞来源膜微囊转运蛋白减轻心肌缺血再灌注损伤的研究进展[J].现代医药卫生,2014,30(12): 1807-1809.
[17]Wu S,Ju GQ,Du T,et al.Microvesicles derived from human umbilical cord Wharton's jelly mesenchymal stem cells attenuate bladder tumor cell growth in vitro and in vivo[J].PLoS One,2013,8(4): e61366.
[18]Hung SP,Ho JH.Hypoxia promotes proliferation and osteogenic differentiation potentials of human mesenchymal stem cells[J].J Orthop Res,2012,30(2):260-266.
[19]Lavrentieva A,Majore I,Kasper C,et al.Effects of hypoxic culture conditions on umbilical cord-derived human mesenchymal stem cells [J].Cell Commun Signal,2010,89(1):18-27.
[20]Svensson KJ,Kucharzewska P,Christianson HC,et al.Hypoxia triggers a proangiogenic pathway involving cancer cell microvesicles and PAR-2-mediated heparin-binding EGF signaling in endothelial cells[J].Proc NatlAcad Sci USA,2011,108(32):13147-13152.
In vitro study of the relatively ideal conditions for the release of microvesicles in human umbilical cord mesenchymal stromal cell.
JIN Xin1,WU Bo2,BI Xiao-yun1,CHEN Jing-li1,LU Huai-sun2,ZHONG Zhuan-di1,WEN Li-juan1.1.Department of Clinical Laboratory,the Development District People's Hospital of Guangzhou,Guangzhou 510730, Guangdong,CHINA;2.The School of Traditional Chinese Medicine of Jiangmen City,Jiangmen 529000,Guangdong,CHINA
ObjectiveTo investigate the relatively ideal conditions for the release of microvesicles(MV)in human umbilical cord mesenchymal stromal cell(hUC-MSC)through in vitro experiments.MethodsAfter cultivation for 5 generations,the hUC-MSCs were cultured for 72 h,with serum and hypoxia as culture conditions for interaction,under four different conditions:serum and normoxia(Norm),serum-free and normoxia(SF),serum and hypoxia(Hypo), serum-free and hypoxia(Hypo-SF).MV were collected for identification and observation,and molecule expression and protein quantitation on MV surface were determined by flow cytometric analysis.ResultsTransmission electron microscopy(TEM)observation showed that membrane structure was observed in the sample under different culture conditions.The structure showed low density in the center and had a diameter of less than 100 nm mostly,with partial aggregation,whose overall morphology was found in accordance with the characteristics of MV.Flow cytometric analysis revealed that surface markers of the membrane were similar with the source hUC-MSC,which both expressed CD29, CD44,CD105,CD73,and did not express CD31 and CD45,indicating that the membrane was derived from hUC-MSC. The number of harvested cells was(1.63±0.28)×108for Norm culture,(0.72±0.25)×108for SF culture,(2.32±0.34)×108for Hypo culture,and(1.48±0.33)×108for Hypo-SF culture,which was significantly higher in Hypo culture than Norm, SF,Hypo-SF culture(t=3.367,6.925,3.367,P<0.05),as well as in Hypo-SF culture than SF culture(t=2.917,P<0.05), with no significant difference between Norm culture and Hypo-SF culture(t=0.827,P>0.05).The total amount of MV protein from high to low was in the order of Hypo culture,Hypo-SF culture,SF culture,and Norm culture,and the MV protein produced by the same amount of cells from high to low was in the order of Hypo-SF culture,Hypo culture,SF culture,Norm culture.ConclusionHypoxia is one of the relatively desirable conditions to promote the release of MV in hUC-MSC,and the use of serum-free culture under hypoxic conditions is recommended.
Human umbilical cord mesenchymal stromal cell(hUC-MSC);Microvesicles(MV);Release;Conditions;In vitro
R329.2+7
A
1003—6350(2016)12—1896—04
10.3969/j.issn.1003-6350.2016.12.002
2016-02-28)
广东省江门市科技计划项目(编号:20150020003139)
金鑫。E-mail:657237479@qq.com

