西南地区部分野生羊肚菌ITS序列鉴定及生境分析
闫晓雪, 时小东, 张国珍, 秦小波*,宁 华, 陈 放, 陈惠群, 刘洪玉
(1.四川大学生命科学学院 生物资源与生态环境教育部重点实验室,四川 成都 610064;2.四川省自然资源科学研究院 生物技术中心,四川 成都 610015)
西南地区部分野生羊肚菌ITS序列鉴定及生境分析
闫晓雪1, 2, 时小东1, 2, 张国珍2, 秦小波2*,宁 华2, 陈 放1, 陈惠群2, 刘洪玉2
(1.四川大学生命科学学院 生物资源与生态环境教育部重点实验室,四川 成都 610064;2.四川省自然资源科学研究院 生物技术中心,四川 成都 610015)
分析了川渝7个县(/区)18个位点野生羊肚菌的生态环境;同时对羊肚菌的品种进行鉴定。运用SPSS对各位点野生羊肚菌的生态环境相关数据(包括海拔、生长环境、土壤物理指标和有机质、总氮、总磷等化学成分)进行因子分析。采用内转录间隔区(ITS)序列,结合观察特征,鉴定各位点羊肚菌品种。各位点样品PCR 扩增所得片段大小约为1 200~1 800 bp,经过测序及BLAST 分析,18个位点羊肚菌品种集中为羊肚菌(Morchellaesculenta)、尖顶羊肚菌(Morchellaconica)、小羊肚菌(Morchelladeliciosa)等7个种类,与根据形态命名方式得到的结果差距较大;其生境中关键因子为有机质,范围为0.55%~2.60%;其次是磷元素和含水量。西南地区野生羊肚菌生境相似度较高,品种较为集中,为西南地区羊肚菌野生资源研究和人工栽培提供了参考依据。
西南;野生羊肚菌;ITS序列;生态环境
羊肚菌是子囊菌亚门(Ascomycota)羊肚菌属(Morchella)的统称,因其子实体菌盖具有皱似羊肚的不规则凹凸褶而得名[1]。羊肚菌营养价值丰富,具有抗癌、提神、抗氧化等多种功效[2-4],作为名贵的食药兼用菌享誉世界。其分布广泛,种类繁多,在世界许多区域均有分布[5]。我国西南一带野生羊肚菌资源非常丰富,且在大田人工栽培技术方面取得了突破性进展[6-7]。野生菌形态易受子实体发育阶段和生长环境等因素的影响,给其鉴定带来巨大困难,加之许多野生菌形态极为相似,更增加了鉴定难度。随着分子技术的发展,分子生物学的方法在食用菌鉴定中得到广泛应用[8]。内转录间隔区(ITS)为中度保守序列,在种内相对一致,种间差异较明显[9]。同时具有快速、准确和简便等优点,在植物[10]、藻类[11-12]和真菌[13-14]鉴定中得以应用。基于ITS序列的真菌鉴定和亲缘关系研究在羊肚菌研究中也得到了相应应用[15],也有研究用ITS序列将羊肚菌划分为黄色、黑色和变红羊肚菌支系三个支系[11]。目前人工羊肚菌栽培技术尚未成熟,现有产量难以满足市场对羊肚菌的需求[16]。同时在经济利益的驱使下,野生羊肚菌资源的大量采集也造成种质资源不断减少[17]。对羊肚菌生态环境、生理过程和遗传机制等知识的缺乏,严重制约了羊肚菌商业化栽培技术的进程[18]。因此对野生羊肚菌优良品种筛选及生长条件进行深入分析,突破羊肚菌人工栽培的瓶颈,将为羊肚菌产业的健康发展奠定基础。
1 材料与方法
1.1 材料
18个位点羊肚菌材料主要于2014至2015年采集自四川和重庆,整株采集后存放于收集袋中,带回实验室常温保存。
1.2 方法
1.2.1 形态鉴定 根据子实体菌盖和菌柄的着生情况、颜色、形状,以及凹陷状态等信息进行传统分类学鉴定。
1.2.2 土壤理化性质检测 每个采集地选取羊肚菌子实体周边(10 cm直径范围内)土壤,测定其理化指标,方法参见 NY/T 52-1987、Y/T 1121.2-2006、NY/T 1121.6-2006、NY/T 53-1987、GB/T 9837-1988、NY/T 88-1988。土壤电导率E.C 参照《土壤农业化学常规分析方法》第4版,中国环境科学出版社。
1.2.3 菌盖DNA提取 采用全基因组试剂盒提取菌盖基因组DNA,试剂盒购自天根生化科技(北京)有限公司。
1.2.4 序列扩增及检测 参照ITS序列扩增方法[19],PCR引物序列[ITS1(TCCGTAGGTGAA-CCTGCGG)和ITS4(TCCTCCGCTTATTGATATGC)]由华大科技合成;PCR体系(50 μL):2×TaqPCR Master Mix (Vazyme) 25 μL,引物各2 μL,模板DNA 2 μL,ddH2O补齐50 μL;PCR程序:94 ℃预变性3 min;95 ℃变性60 s,50 ℃退火40 s,72 ℃延伸60 s,35个循环;最后72 ℃延伸10 min。PCR产物经1% 琼脂糖凝胶电泳检测后,目的条带回收,送华大科技测序。
1.2.5 数据分析 序列对比采用GenBank数据库中的BLAST程序完成,并用MEGA进行对比分析,根据邻近遗传距离法(NJ法)构建系统发育树,对结果进行分类[20-21];其他数据采用Excel和SPSS分析完成。
2 结果与分析
2.1 羊肚菌发生地生态环境
18个位点羊肚菌采集自7个县/区,具体信息见表1。从生态环境看,羊肚菌采集地多为苔藓、草丛或落叶中,能够避免长时间阳光照射,增加了发生地的湿度和腐殖土厚度。发生区对坡向和坡度要求不是很高,海拔分布范围较广,从247.9 m到2 387.3 m均有分布,说明羊肚菌海拔分布范围广,适应能力较好,这可能取决于羊肚菌品种的多样性,同时也说明各生态因子不是单独作用,而是共同维持羊肚菌菌丝生长和子实体发生等生命周期的各个阶段。

表1 羊肚菌样品来源、形态及分子鉴定结果
2.2 土壤理化性质初步分析
土壤含水量、有机质、总氮、总磷的测定结果见表2。由表2可知,18个位点羊肚菌采集地土壤含水量范围为54.00%~70.00%,M株(表1中编号13株)采集地含水量最小;发生地土壤呈弱酸性,pH值在5.80~7.00左右,其中编号M株和N株(编号15株)采集地土壤酸碱度分别最大和最小;按照划分标准,18个位点土壤有机质含量属于中等肥力类型,含量在0.55%~2.60%;总氮和总磷含量范围分别为0.01%~0.39%和0.02%~0.12%。
运用SPSS对土壤理化值进行描述(表2),由结果可知,18个位点羊肚菌发生地土壤含水量和pH平均值分别为59.54和6.45,P值在可信任范围,说明羊肚菌发生地之间土壤含水量和酸碱度之间均有显著性差异,但含水量偏差较大(标准偏差为4.12),pH在6.45符合羊肚菌生长环境,有利于羊肚菌菌丝的生长和子实体的出现;如果pH太高或太低,羊肚菌子实体则不会发生。就土壤营养成分而言,有机质、总氮、总磷和总钾是其土壤组成的最主要成分,18个位点检测的土壤营养成分之间均存在显著差异。总磷和总氮标准偏差较小,总钾的差异变化较大,而氮元素的含量决定了土壤腐殖质的含量。
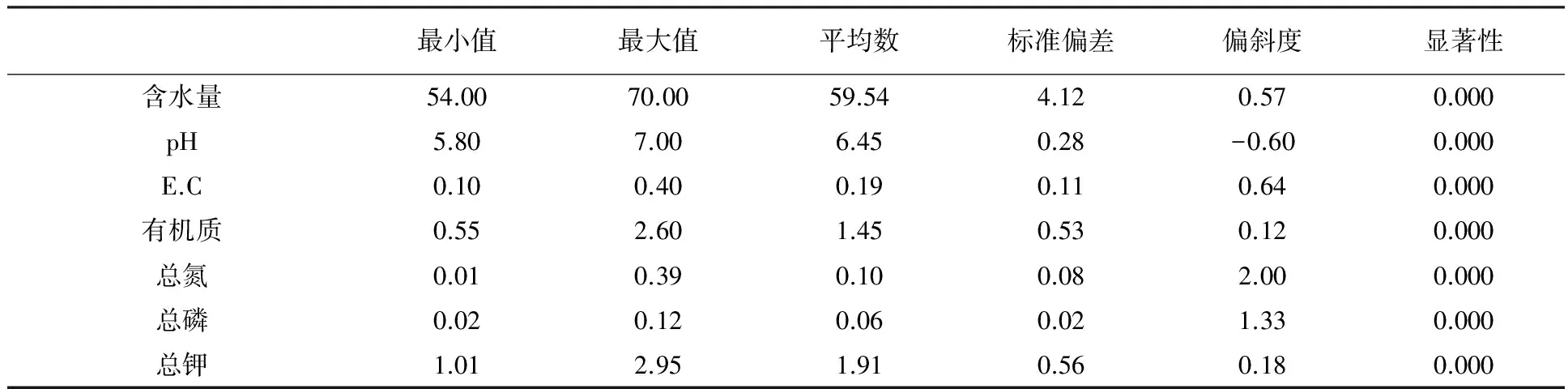
表2 羊肚菌样品生境因子的统计信息
注:E.C为土壤电导率,下同
2.3 土壤理化性质主成分分析
Kaiser-Meyer-Olkin (KMO)检验和Bartletts’s球形检验是用于分析变量间的相关系数和偏相关系数,以及变量间独立性的指标,以便后续判断是否适合进行变量主成分分析。对18个位点野生羊肚菌土壤成分进行KMO和Bartlett’s检验(表3),KMO值为0.505,大于0.5,表明变量间具有相关性,可以进行后续相关性分析。另外,Bartlett’s球形检验值(91.268)显著性Sig.为0.000,达到了显著水平,说明土壤成分间存在共性,并非独立,进一步证明了18个位点野生羊肚菌土壤成分元素间可运用主成分分析法进行分析。

表3 18个位点野生羊肚菌土壤成分的KMO与Bartalett’s 检验
主成分分析可以解释事物本质间的联系,其重要指标为特征根和方差贡献率,由表4可知,各主成分间载荷系数相差不大,不易对各成分进行明确,因此需要进行因子载荷矩阵的旋转,旋转后各载荷系数见表5(采用方差最大化旋转)。由表5可知,旋转后各系数发生了明显极化,第一成分中起主要作用的是有机质,第二主成分中表现出与总磷高度的正相关,第三成分中含水量起主要作用。通过羊肚菌土壤理化性质的主成分分析,可以初步判断有机质、磷元素和含水量在羊肚菌发生中的重要性。
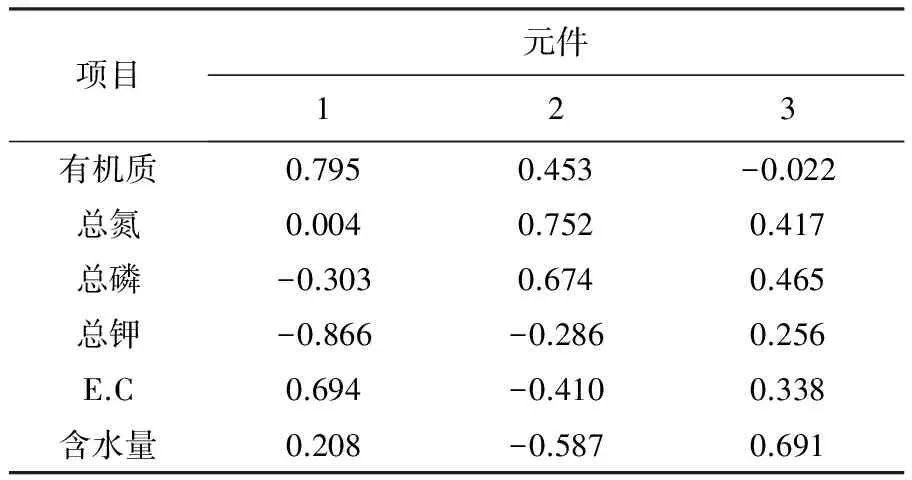
表4 各变量在主成分中的载荷系数

表5 旋转后各原始变量对主成分的载荷表
2.4 基于形态的鉴定
对18个位点野生羊肚菌子实体进行拍照记录,并对所有菌株进行命名。其中编号2、3、5、10、13和14命名为粗柄羊肚菌(Morchellacrassipes),其子实体大小为中型;菌盖浅黄色,表面凹坑不规则或近圆形;菌柄白色,粗壮,基部有膨胀变大现象发生。编号1和9 命名为羊肚菌(Morchellaesculenta),其子实体中等大小,顶端无明显尖端,较钝;菌盖凹坑较多,淡黄色;菌柄较粗,白色或近白色。编号6、7和8 命名为小羊肚菌(Morchelladeliciosa),其子实体较小;菌盖浅褐色,表面凹坑较深,脉棱多纵向排列;菌柄较短,近白色或浅褐色。其余菌株则根据形态分别命名,编号4、17和18为梯棱羊肚菌(Morchellaimportuna),编号11和12为七妹羊肚菌(Morchellaseptimelata),编号15和16为普通羊肚菌(Morchellavulgaris)。
2.5 ITS序列及分析
运用分子生物学方法采用ITS1和ITS4进行PCR扩增,对扩增结果进行琼脂糖凝胶电泳检测,扩增片段的长度约为1 200~1 800 bp。将测序结果与NCBI数据库进行BLAST分析,由表1可知,18个位点羊肚菌在分类中均属羊肚菌科羊肚菌属,其中1、2、5、6、9和10为Morchellaesculenta;11、12、17和18为Morchellaconica; 其余8个编号对应4个种类,而这一结果与根据传统形态学鉴定的结果存在差别(表1)。
结合运用NJ法系统树分析,依据ITS序列将羊肚菌分为黑羊肚菌、黄羊肚菌和变红羊肚菌等3个支系[22-24],本研究中的18个位点野生羊肚菌,主要为黄色羊肚菌支系,包含11株,其次是黑色羊肚菌支系,包含7株,未发现红色羊肚菌支系(图1)。
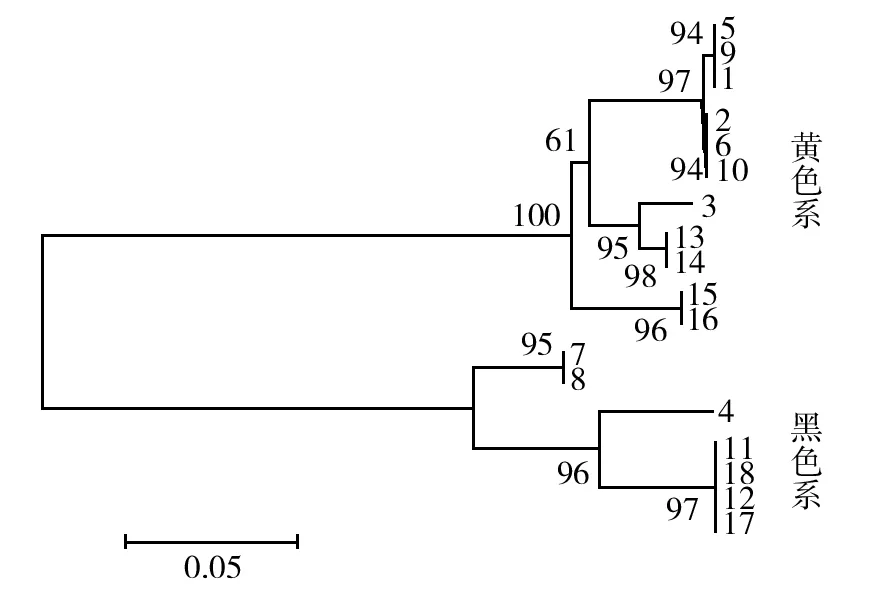
图1 18个样品的系统树分析(NJ法)Fig.1 Phylogenetic tree analysis of 18 samples (NJ Method)
3 讨 论
羊肚菌分布广泛,在世界许多地域均有分布[5]。我国幅员辽阔,生态环境复杂,羊肚菌资源丰富,在云南、四川、重庆、河南、河北、黑龙江、辽宁、新疆、江苏等地均有羊肚菌资源报道[6]。本研究发现在调查区域内羊肚菌的种类较为集中,这可能与地理气候环境有关。对野生羊肚菌资源进行调查,生物学功效的深入分析,以及优质品种的筛选,这将为更好地实现羊肚菌菌种的选育改良及高效人工栽培提供途径。
本研究从形态上鉴定为粗柄羊肚菌的2、5和10号样品,经ITS分析发现为羊肚菌;而形态鉴定的11、12号七妹羊肚菌和17、18号梯棱羊肚菌,经ITS分析发现为尖顶羊肚菌。前者可能因为子实体生长中生境营养供应的断层导致形态更趋于粗柄羊肚菌;而后者可能由于子实体发育时光照影响了形态建成所致。总之,结合形态和分子鉴定更有利于比较分析鉴定羊肚菌。目前,世界上羊肚菌亚种和变种共有313个[18],利用形态对众多羊肚菌种类进行鉴定的难度较大。利用分子手段,特别是依据ITS序列进行真菌鉴定已应用较多[25],同时新一代测序技术的应用和数据挖掘为羊肚菌的命名和鉴定提供了可靠的依据,可有效解决羊肚菌界定的难题和避免同种异名或异种同名的现象发生[1]。
本研究发现调查的野生羊肚菌生境中的有机质较为丰富,这符合食用菌对有机质的需求;同时生境中含水量也对羊肚菌较为重要。野生羊肚菌菌丝生长和子实体的营养环境,以及人工栽培过程中的培养特性研究,一直是羊肚菌研究的难点之一。关于菌丝和菌核营养环境的研究较多,已经取得了大量的数据[26]。目前,碳源、氮源、无机离子、生长因子,以及温度、酸碱度、湿度和光照等野外调查数据较少;关于羊肚菌子实体发生的营养环境的调查也不多,仅有少量报道[27-30]。因此,羊肚菌的规模化人工栽培依然进程缓慢;羊肚菌生长营养条件的数据挖掘,各因素之间的关联分析,以及羊肚菌不同生长阶段对营养元素需求的差异研究尤为重要,将为羊肚菌不同生长周期营养的补给和环境的改良提供理论基础。
[1] 杜习慧, 赵琪, 杨祝良. 羊肚菌的多样性、演化历史及栽培研究进展[J].菌物学报, 2014, 33(2): 183-197.
[2] Hu M, Yan C, Cui W, et al. Induction of apoptosis inHepG2 cells by polysaccharideMEP-II from the fermentation broth ofMorchellaesculenta[J].Biotechnology Letters, 2013, 35(1): 1-10.
[3] Fatih K, Mustafa O, Hüsniye S l, et al. Antimicrobial and antioxidant activities of mycelia of 10 wild mushroom species [J]. Journal of Medicinal Food, 2010, 13(2): 415-419.
[4] Nitha B, Fijesh P V,Janardhanan K K. Hepatoprotective activity of cultured mycelium ofMorelmushroom,Morchellaesculenta[J]. Experimental & Toxicologic Pathology, 2013, 65: 105-112.
[5] Emile Jacquetant. Les Morilles: The morels[M]. Lausanne, Switzerland: Piantanida, 1984.
[6] Du X H, Qi Z, O'Donnell K, et al. Multigene molecular phylogenetics reveals true morels (Morchella) are especially species-rich in China[J]. Fungal Genetics & Biology, 2012, 49(6): 455-469.
[7] 王波, 鲜灵. 人工栽培羊肚菌的鉴定[J]. 西南农业学报, 2013, 26(5): 1988-1991.
[8] Carrieri R, Carotenuto G, Lahoz E. Characterization and pathogenicity ofPestalotiopsisuvicolacausing black leaf spot on carob (CeratoniasiliquaL.) in Italy[J]. European Journal of Plant Pathology, 2013, 137(4): 655-661.
[9] 陈剑山, 郑服丛. ITS序列分析在真菌分类鉴定中的应用 [J]. 安徽农业科学, 2007, 35(13): 3785-3786.
[10]Xiang Q P, Xiang Q Y, Liston A, et al. Length Variation of the Nuclear Ribosomal DNA Internal Transcribed Spacer in the Genus Abies with Reference to Its Systematic Utility in Pinaceae[J]. Acta Botanica Sinica, 2000, 42(9): 946-951.
[12]Gupta V, Natarajan C, Chaudhary V, et al. Analyses of diversity among fungicidal Anabaena strains[J].Journal of Applied Phycology, 2012, 24(6): 1395-1405.
[13]贾定洪, 王波, 彭卫红, 等. 19个药用茯苓菌株的ITS序列分析[J].中国食用菌, 2011, 1(1): 42-44.
[14]Jeewon R, Liew E C Y, Hyde K D. Phylogenetic relationships of Pestalotiopsis and allied genera inferred from ribosomal DNA sequences and morphological characters[J].Molecular Phylogenetics & Evolution, 2002, 25(3): 378-392.
[15]Wipf D, Fribourg A, Munch J C, et al. Diversity of the internal transcribed spacer of rDNA in morels[J]. Canadian Journal of Microbiology, 1999, 45(9): 769-778.
[16]李勇, 杨峰, 樊继德, 等. 徐州地区羊肚菌资源调查与分析[J]. 中国食用菌, 2010, 29(6): 15-17.
[17]何培新, 刘伟, 蔡英丽, 等. 我国人工栽培和野生黑色羊肚菌的菌种鉴定及系统发育分析[J].郑州轻工业学院学报(自然科学版), 2015, 30(3/4): 26-29.
[18]熊川, 李小林, 李强, 等. 羊肚菌生活史周期、人工栽培及功效研究进展[J].中国食用菌, 2015, 34(1): 7-12.
[19]White T J, Bruns T D, Lee S B, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[J]. PCR-Protocols : A guide to methods and applications, 1989, 38: 315-322.
[20]Taylor J W, Jacobson D J, Kroken S, et al. Phylogenetic species recognition and species concepts in fungi[J].Fungal Genetics & Biology, 2000, 31(1): 21-32.
[21]Bunyard B A. A Systematic Assessment of Morchella Using RFLP Analysis of the 28S ribosomal RNA gene[J].Mycologia, 1994, 86(6): 762-772.
[22]O’Donnell K, Rooney A P, Mills G L, et al. Phylogeny and historical biogeography of true morels (Morchella) reveals an early Cretaceous origin and high continental endemism and provincialism in the Holarctic[J]. Fungal Genetics & Biology, 2010, 48(3): 252-265.
[23]Taskin H, Buyukalaca S, Dogan H H, et al. A multigene molecular phylogenetic assessment of true morels (Morchella) in Turkey[J].Fungal Genetics & Biology, 2010, 47(8): 672-682.
[24]Taskin H, Büyükalaca S, Hansen K, et al. Multilocus phylogenetic analysis of true morels (Morchella) reveals high levels of endemics in Turkey relative to other regions of Europe[J].Mycologia, 2012, 104(2): 446-461.
[25]Michael Kuo, Damon R Dewsbury, Kerry O’Donnell, et al. Taxonomic revision of true morels (Morchella) in Canada and the United States[J].Mycologia,2012,104(5):1159-1177.
[26]陈立佼, 柴红梅, 黄兴奇, 等. 羊肚菌属真菌菌丝及菌核多态性研究进展[J]. 中国食用菌, 2011, 30(2): 3-7.
[27]肖锋, 王得贤, 杨冬梅. 温度pH值光照对羊肚菌菌丝生长的影响[J]. 中国食用菌, 2000, 19(5): 13-15.
[28]伊平昌,谢占玲, 毛成荣, 等. 青海省羊肚菌发生地的生态环境调查[J]. 中国食用菌, 2014, 33(2): 13-14.
[29]武冬梅, 谢宗铭, 李全胜, 等. 新疆伊犁野生羊肚菌种质资源调查及生境分析[J]. 中国食用菌, 2013, 32(3): 12-14.
[30]姜淑霞, 李超, 王庆华, 等. 泰山羊肚菌的种类调查与研究 [J]. 中国食用菌, 2008, 27(5): 12-15.
欢 迎 投 稿 欢 迎 订 阅
Analysis of WildMorchellaITS Sequence Identification & Habitat in Part of SW China
YAN Xiao-xue1, 2, SHI Xiao-dong1, 2, ZHANG Guo-zhen2, QIN Xiao-bo2, NING Hua2,CHEN Fang1, CHEN Hui-qun2, LIU Hong-yu2
(1.KeyLab.ofBio-Res. &Eco-Environm't,Minist.ofEduc.,Coll.ofLifeSci.,SichuanUni.,Chengdu610064; 2.Bio-TechCtr.,SichuanNat.Res.Inst.,Chengdu610015)
The ecological environment of wildMorchellafrom 18 sites’ in 7 counties of Sichuan and Chongqing was investigated, at the same time theMorchellaspecies were identified. The related data of ecological environment, including altitude, growth environment, soil physical indicators, organic matter, total nitrogen and total phosphorus were carried out factor analysis using SPSS. Each Morchella species sample of the sites was identified by the internal transcribed spacer (ITS) sequence analysis, combined with the characteristics observation ofMorchellaspecies. The ITS result indicated that the length of PCR fragments from each site’s samples collected was 1 200-1 800 bp and the 18 samples were similar to 7 kinds ofM.esculenta,M.conica,M.deliciosaetc through sequencing and BLAST analyses. There is a fairly large gap as compared with the result ofMorchellaclassified by morphological nomenclature. The key factors in the habitat were organic substances that ranged from 0.55% to 2.60%, followed by phosphorus and moisture content. The habitat similarity of wildMorchellain SW China is fairly high, and their variety is relatively concentrated. This study provides a reference foundation for artificial cultivation and the research of wildMorchellaresources in SW China.
SW China; wildMorchell; ITS sequences; ecological environment
四川省科技计划院所科研项目 (2016YSKY0022);四川省科技计划项目(2017NZ0030,2017SZ0162);成都市科技计划
闫晓雪 女,硕士研究生。研究方向为食品生物安全。E-mail: scu_0003@163.com
* 通讯作者。男,副研究员,博士。研究方向为植物与微生物资源。Tel: 028-68107840,E-mail: qxb_2003@163.com
2015-12-30;
2016-01-26
Q939
A
1005-7021(2016)06-0048-06
10.3969/j.issn.1005-7021.2016.06.008
项目(2015-CP03-00480-NC);成都市科技项目(2015-NY02-00001-NC)

