影响乳液中β-胡萝卜素生物可给率的因素研究
梁 蓉, 林全全, 陈 翰, 钟 芳*
影响乳液中β-胡萝卜素生物可给率的因素研究
梁 蓉1,2, 林全全1,3, 陈 翰1,3, 钟 芳*1,3
(1.江南大学 食品胶体与生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 化学与材料工程学院,江苏 无锡214122;3.江南大学 食品学院,江苏 无锡214122)
为了明确影响乳液体系中β-胡萝卜素生物可给率的因素,作者通过构建体外消化模型及体外淀粉消化酶、脂肪酶及胆盐缺失3种特殊消化模型,对以辛烯基琥珀酸(OSA)改性淀粉为乳化剂的β-胡萝卜素乳液的生物可给率进行研究。结果显示,不同消化模型中β-胡萝卜素生物可给率的大小顺序为:完整消化模型>淀粉消化酶缺失模型>胆盐缺失模型>脂肪酶缺失模型。因此,当乳化剂消化、油脂消化和胆盐胶束化中任一进程被抑制时,乳液中β-胡萝卜素的生物可给率均降低。且这三者对乳液中β-胡萝卜素生物可给率的影响程度如下:脂肪消化>胶束化>乳化剂消化。
乳液;OSA改性淀粉;乳化剂消化;脂肪消化;胶束化;β-胡萝卜素;生物可给率
脂溶性营养素,如:β-胡萝卜素、维生素E、辅酶Q10等,具有提高人体免疫力、延缓衰老、降低心脑血管疾病等保健功能[1],是人们广泛关注并青睐的一类食品营养强化剂。然而,此类营养素大多存在水相溶解度低、化学稳定性差的特点[1],大大限制了它们在食品体系中的添加。基于此,水包油型乳液,因其制备工艺简单,且成本低,被广泛应用于此类物质的保护和运输。大量研究已证明,乳液能有效改善脂溶性营养素的溶解性和稳定性[2-3]。此外,乳化体系还可显著提高营养素的体外生物可给率[3-4],但提高程度与乳液中乳化剂和油脂的消化行为以及营养素的胶束化进程有关。
Nik等人[5-6]分别以乳清分离蛋白和大豆分离蛋白为乳化剂制备了β-胡萝卜素乳液,并发现不同的蛋白质呈现出不同的消化特性,致使这两种乳液中β-胡萝卜素的生物可给率也不同。同时,油脂类型不同,载体中营养素的生物可给率往往不同[7-9];若采用同一类型油相,营养素的生物可给率还与油脂的消化程度相关[7,10]。胶束化被认为是脂溶性营养素被吸收的前提[11],胆盐作为混合胶束的主要组成,其含量对胶束化有重要影响,Yi[10]和Wang[12]的研究均表明,β-胡萝卜素的胶束化率随着胆盐含量的增大而增大。
但是,以上结论大都是针对以小分子表面活性剂或蛋白质为乳化剂的体系,当采用淀粉为乳化剂时,其作用机制如何目前尚无定论。因此,作者选用常见的辛烯基琥珀酸(OSA)改性淀粉为乳化剂,以β-胡萝卜素为脂溶性营养素的代表,制备水包油型乳液,通过构建完整体外消化模型和3种特殊体外消化模型(淀粉消化酶缺失模型,脂肪酶缺失模型和胆盐缺失模型),对比分析影响以淀粉为乳化剂的脂溶性营养素乳液生物可给率的因素,为构建高生物利用率脂溶性营养素的乳液提供指导。
1 材料与方法
1.1 材料与试剂
辛烯基琥珀酸 (OSA)改性淀粉 (取代度为1.9%):宜瑞安食品配料有限公司;中碳链甘油三酯(MCT):益海嘉里投资有限公司;口腔α-淀粉酶(29 U/mg)、胃蛋白酶(474 U/mg)、胰酶(8×USP)、淀粉葡糖苷酶(316 U/mL)、脂肪酶(来源于黑曲霉,约200 U/g)、胰淀粉酶(Type VI-B,≥10 U/mg):美国Sigma公司;猪胆盐提取物:美国Sigma公司;氯化钾、硫氰化钾、磷酸二氢钠、硫酸钠、氯化钠、碳酸氢钠、尿素、尿酸、硝酸钠,氢氧化钠:分析纯,国药集团化学试剂有限公司;葡聚糖标准品:低重均分子质量系列,美国Sigma公司。
1.2 仪器与设备
EL20实验室pH计:上海梅特勒-托利多有限公司;Allegra 25R台式高速冷冻离心机:美国贝克曼有限公司;凝胶渗透色谱仪(GPC):EcoSEC HLC-8320,配置双通道/双流路示差(RI)检测器,日本东曹株式会社;凝胶色谱柱:TSK gel super MultiporePW-M色谱柱,4 μm,6.0 mm×150 mm,日本东曹株式会社;高效液相色谱仪 (HPLC):配置Waters 1525二元输液泵,2996 PDA检测器,美国Waters公司;β-胡萝卜素测定色谱柱:C30色谱柱,5 μm,4.6 mm×250 mm,美国YMC公司。
1.3 方法
1.3.1 以OSA改性淀粉为乳化剂的β-胡萝卜素乳液的制备 称取占乳液总质量分数30%的OSA改性淀粉,溶于去离子水中,并搅拌过夜。将占油相质量分数为0.1%的β-胡萝卜素溶于MCT油相中,避光搅拌1 h。称取占乳液总质量分数为10%的MCT油相与OSA改性淀粉水溶液混合,并用高速分散机以18 000 r/min分散4 min,再使用微射流均质机在100 MPa下均质5次,制备得到β-胡萝卜素乳液,置于4℃避光保藏。
1.3.2 体外消化模型的构建 完整的体外消化模型共包括3个阶段,分别为:口腔、胃和小肠。消化液的组成及消化方法如下:
1)口腔阶段:根据Hur等人[13]的条件进行适当调整,配制口腔模拟液(SSF),具体组成见表1。将4 mL乳液与4 mL SSF混合,采用1 mol/L HCl调节体系pH至7.0,温度为37℃,并在100 r/min下搅拌3 min。
2)胃阶段:按照Salvia-Trujillo等人的方法[14],配制模拟胃液 (SGF)。取10 mL SGF加入乳液与SSF的混合物中,调节pH至2.0,在37℃下搅拌(100 r/min)60 min。
3)小肠阶段:胃阶段结束后,迅速使用(1.0 mol/ L)/(0.1 mol/L)氢氧化钠将体系的pH调节至7.0,再加入15 mL模拟小肠液(SIF),并采用pH-stat法,通过加入0.2 mol/L氢氧化钠维持体系的pH为7.0,记录消化进程2 h内消耗的氢氧化钠溶液的体积数。
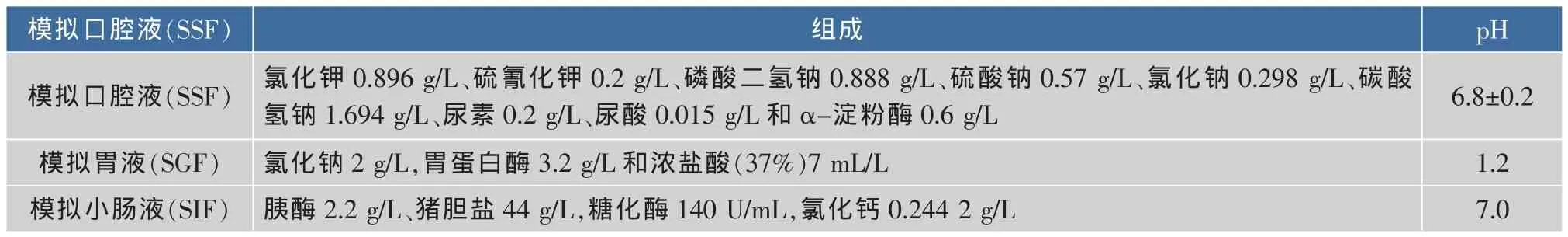
表1 模拟消化液的组成Table 1 Compositions of digestion juices
在完整消化模型的基础上,通过调整消化酶及胆盐的添加构建3种特殊消化模型。其中,淀粉酶缺失模型为:SSF中不添加α-淀粉酶,SIF中不添加淀粉葡糖苷酶,添加脂肪酶(活力与胰酶中的脂肪酶相当)代替胰酶;脂肪酶缺失模型为:SIF中添加淀粉酶(活力与胰酶中的淀粉酶相当)代替胰酶;胆盐缺失模型为:SIF中不添加胆盐。
1.3.3 消化过程中乳化剂(OSA改性淀粉)重均分子量的测定
1)重均分子量标准工作曲线的确定:将系列低重均分子量葡聚糖标准品溶于流动相 (0.1 mol/L NaNO3,含0.02%NaN3)中,质量浓度为2 mg/mL,并于10 000 r/min下离心5 min,取上层清液,过0.45 μm微孔滤膜。采用GPC系统,结合Super MultiporePW-M色谱柱测定标准品的重均分子量分布,流速为0.6 mL/min,柱温为35℃,进样量为20 μL。由EcoSEC数据分析作出重均分子量校正曲线为:lg Mw=-0.008 5t3+0.146 1t2-1.349 6t+10.827,相关系数R2=0.999 5,其中t为保留时间(min),Mw为重均分子量(g/mol)。
2)样品的测定:分别在口腔和胃消化后以及小肠消化5、20、120 min后取出200 μL样品,于95℃下灭酶5 min[15],并用流动相稀释样品,使其消化产物质量浓度为5 mg/mL,此后测定同标准品。仪器自动绘出样品重均分子量分布和Mw等结果,由此监测消化过程中乳化剂OSA改性淀粉重均分子量的变化。
1.3.4 油脂水解率的测定 一般认为一分子甘油三酯可水解产生两分子游离脂肪酸和一分子甘油单酯[16]。脂肪酸的产生导致pH值降低,通过监控体系消耗NaOH的量可推算出游离脂肪酸的生成量,以游离脂肪酸释放率表征油脂的消化程度。其中,游离脂肪酸(FFA)的释放率计算见公式(1)。
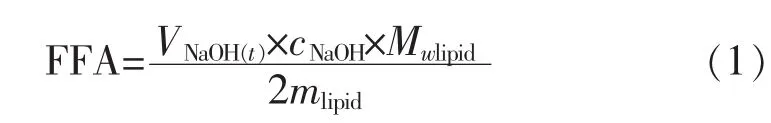
式中,FFA为游离脂肪酸的释放率(%);mlipid为样品中油脂的质量 (g);VNaOH为消化时间t时所消耗的NaOH溶液的体积 (mL);cNaOH为滴定时选用的NaOH溶液的浓度(mol/L);Mwlipid为油脂分子的重均分子量(g/moL)。
1.3.5 β-胡萝卜素生物可给率的测定 消化后取部分消化液在10 000 g条件下离心45 min,样品分成未消化的油相层、胶束层和沉淀层。用注射器取出混合胶束并过0.45 μm微孔滤膜,采用HPLC测定胶束中的β-胡萝卜素含量[6]。β-胡萝卜素的生物可给率计算如公式(2)所示。

式中,BA为β-胡萝卜素生物可给率 (%);cmicelles为胶束中β-胡萝卜素的质量浓度 (μg/mL);c0为乳液中β-胡萝卜素的质量浓度(μg/mL)。
1.3.6 数据统计 使用SPSS 17.0软件进行方差分析,采用Duncan检验法(p≤0.05)对实验数值进行差异显著性分析。
2 结果与分析
2.1 不同消化模型中β-胡萝卜素的生物可给率
首先对乳液经过不同消化模型后的β-胡萝卜素的生物可给率进行了测定,结果见图1。在完整消化模型中,乳液的β-胡萝卜素生物可给率为(31.0± 2.1)%。与之相对比,在脂肪酶缺失模型中,β-胡萝卜素的生物可给率几乎为0。在胆盐缺失模型中,营养素生物可给率低,这与Yi[10]和Wang[12]等人的研究结果一致。在淀粉酶缺失模型中,β-胡萝卜素的生物可给率也显著低于完全消化模型。总体来看,4种模型中β-胡萝卜素的生物可给率大小依次为:完整消化模型>淀粉酶缺失模型>胆盐缺失模型>脂肪酶缺失模型。
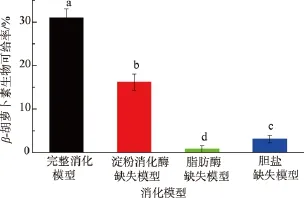
图1 4种消化模型中β-胡萝卜素的生物可给率Fig.1 Bioaccessibility of β-carotene in four digestion models
2.2 不同消化模型中乳化剂(OSA改性淀粉)的消化
为了分析引起三种特殊消化模型与完整消化模型后β-胡萝卜素生物可给率差异的原因,作者进一步对不同消化模型中乳化剂的消化情况进行了表征。图2显示了完整消化模型中OSA改性淀粉在不同消化阶段的示差信号曲线。由图2可知,原始OSA改性淀粉的重均分子量分布较宽,经过模拟口腔液(SSF)和胃液(SGF)消化后,OSA改性淀粉的重均分子量分布并没有发生明显变化。根据葡聚糖标准曲线,计算得到消化过程中OSA改性淀粉的重均分子量的数值,见表2。经过口腔消化后,OSA改性淀粉的重均分子量略微减小,但不显著,这可能与SSF中α-淀粉酶活力较低且作用时间短(3 min)有关。进入胃液消化后,淀粉的重均分子量几乎没有变化,说明OSA淀粉在酸性条件下较稳定,且未发生分解。但当样品进入模拟小肠(SIF)消化阶段后,淀粉的示差信号曲线发生了明显的变化。OSA改性淀粉在8~10.72 min左右的洗脱峰信号逐渐降低,且在11 min左右出现了一个新的洗脱峰,根据葡聚糖标准曲线可确定其重均分子量小于500 g/mol,应为淀粉水解的终产物——单糖或二糖。且随着乳液在SIF中消化时间的延长,该水解产物的洗脱峰强度也随之增强。为了比较淀粉在肠液消化进程中的水解情况,作者考察了SIF不同消化阶段后OSA淀粉分子中出峰时间小于10.72 min的重均分子量(命名为级分1)变化情况,结果见表3。
在完整消化模型中,当乳液进入小肠阶段5 min后,淀粉的重均分子量急剧下降,说明此时在胰淀粉酶和淀粉葡糖苷酶的作用下,OSA淀粉被迅速水解。此后,随着消化时间的延长,淀粉的重均分子量仍逐渐减小,但减小速度降低。在SIF中消化120 min后,淀粉的重均分子量为(2 378±90)g/mol,说明此时仍有部分淀粉片段未完全消化。这与文献报道的OSA淀粉是一种抗性淀粉[17]的消化结果一致。与完全消化模型对比,在脂肪酶缺失模型及胆盐缺失模型中,OSA淀粉重均分子量的变化与完整消化模型相似,说明在这两种消化模型中,淀粉的消化并未受到脂肪酶和胆盐缺失的影响。而在淀粉酶缺失模型中,OSA淀粉的重均分子量在整个小肠消化阶段均无显著变化,因此可推测在此模型中乳化剂的消化完全被抑制。
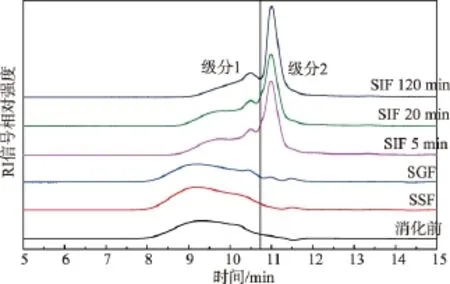
图2 完整消化模型中OSA改性淀粉在不同消化阶段的GPC色谱图Fig.2 Chromatograms of OSA modified starches at different stages during the complete digestion model

表2 完整消化模型中口腔、胃消化阶段OSA改性淀粉重均分子量变化Tab.2 Changes of weight-average molecular weight of OSA modified starches during digestion in mouth and stomach stages in the complete digestion model
2.3 不同消化模型中油脂的消化
除了乳化剂的消化特性外,油脂的消化情况也被认为是影响脂溶性营养素生物利用率的关键因素。作者考察了4种消化模型中乳液在小肠阶段游离脂肪酸的释放曲线,结果见图3。在完整消化模型中,乳液进入小肠阶段后,油脂迅速被水解,在20 min后油脂消化几乎达到平衡,最终消化率达到95.3%。与此相对应,在脂肪酶缺失模型中,消化液的pH值几乎没有变化,即没有游离脂肪酸生成,表明乳液中油脂的消化因为脂肪酶的缺失而完全被抑制。在胆盐缺失模型中,油脂的消化速率和程度均低于完整消化模型。这可能是由于胆盐的缺失会抑制混合胶束的形成,从而使油滴表面聚集了大量的油脂消化产物,进而对油脂的消化产生一定的抑制[18]。在淀粉酶缺失模型中,油脂的消化速率和程度也低于完整消化模型。这说明当乳化剂的消化受到抑制时,液滴表面的OSA淀粉分子可能会阻碍脂肪酶与油滴的接触,从而抑制脂肪的消化[19-20]。
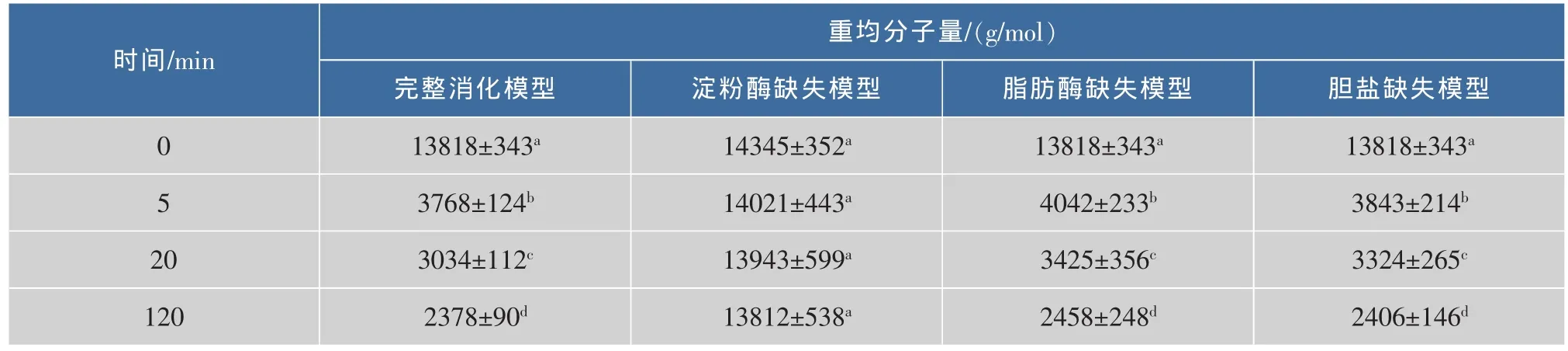
表3 4种消化模型的小肠阶段中OSA改性淀粉中级分1的重均分子量变化Table 3 Changes of weight-average molecular weight of fraction 1 in OSA modified starches during small intestine stage in the four digestion models
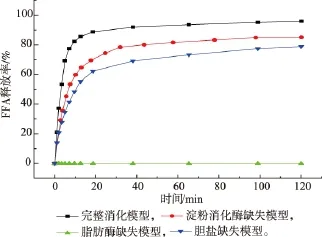
图3 4种消化模型中脂肪酸释放曲线Fig.3 Released of free fatty acids in the four digestion models
2.4 影响乳液中β-胡萝卜素生物可给率的机制分析
结合以上4种消化模型中β-胡萝卜素的生物可给率以及乳化剂和油脂的消化情况可得出,各因素对β-胡萝卜素生物可给率的影响程度如下:脂肪消化>胶束化>乳化剂消化。在脂肪酶缺失模型中,脂肪消化完全被抑制,直接导致β-胡萝卜素不能从油滴中释放,使得生物可给率几乎为零。在胆盐缺失模型中,胶束化进程受抑制,被释放的β-胡萝卜素因缺少胶束载体而结晶析出,生物可给率大大降低。然而,此时由于部分OSA改性淀粉水解产物可形成胶束,用于溶解少量β-胡萝卜素,使得此时生物可给率不为零。在淀粉消化酶缺失模型中,淀粉消化受到抑制,使得脂肪消化程度降低,β-胡萝卜素的释放量减少;同时,脂肪消化产物含量的减少,使得混合胶束对β-胡萝卜素的溶解能力降低,最终β-胡萝卜素的生物可给率显著低于完整消化模型。
基于以上各种条件对消化的抑制作用,可总结以OSA改性淀粉为乳化剂的脂溶性营养素乳液在小肠阶段的消化机制,见图4。具体可分为以下3个阶段:1)当油滴表面的乳化剂OSA改性淀粉在淀粉酶的作用下水解后,胆盐与部分淀粉发生竞争吸附至油水界面,从而减小界面空间位阻,使得脂肪酶更易与油滴接触,加快油脂水解进程;2)随着油脂的消化,油脂中的β-胡萝卜素被释放,脂肪水解产物(FFA、甘油单酯等)与胆盐、磷脂形成混合胶束,运载被释放的β-胡萝卜素;3)部分未完全消化的OSA改性淀粉发生自胶束化,运载少量β-胡萝卜素。根据以上消化机制,可以总结脂肪的消化直接控制营养素的释放;同时,脂肪的消化程度会影响混合胶束的组成,从而影响胶束对营养素的运载能力。而胶束化进程会影响营养素的转运,从而影响生物利用率。乳化剂的消化情况则是通过影响脂肪的消化,进而影响营养素的释放和转运。
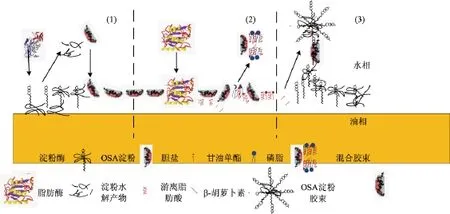
图4 小肠消化阶段中OSA淀粉乳液油水界面的消化机理示意图Fig.4 Digestion processes in the oil-water interface of emulsions stabilized by OSA modified starches in the small intestine stage
3 结语
作者通过对比3种特殊消化模型 (淀粉酶缺失、脂肪酶缺失及胆盐缺失)与完整消化模型中营养素的生物可给率以及乳化剂和油脂的消化进程结果,探究影响以OSA淀粉为乳化剂的乳液中β-胡萝卜素生物可给率的因素及机制,得到以下主要结论:乳化剂消化、脂肪消化和胶束化是影响营养素生物可给率的关键因素,抑制三者中任意一者,均可降低β-胡萝卜素的生物可给率;它们的作用机制分别为:脂肪通过控制营养素的释放和转运,影响营养素的生物可给率;胶束化通过控制混合胶束的形成,影响营养素的转运,从而作用于生物可给率;乳化剂通过影响脂肪的消化,从而影响营养素的生物可给率。3种因素对生物可给率的影响程度如下:脂肪消化>胶束化进程>乳化剂消化。本研究结论可为构建高效生物利用率的脂溶性营养素乳液,提供一定的指导和帮助。
[1]MCCLEMENTS D J,LI Y.Structured emulsion-based delivery systems:controlling the digestion and release of lipophilic food components[J].Advances in Colloid and Interface Science,2010,159(2):213-228.
[2]LEI F,LIU F,YUAN F,et al.Impact of chitosan-EGCG conjugates on physicochemical stability of β-carotene emulsion[J].Food Hydrocolloids,2014,39:163-170.
[3]LIANG R,SHOEMAKER C F,YANG X,et al.Stability and bioaccessibility of β-carotene in nanoemulsions stabilized by modified starches[J].Journal of Agricultural and Food Chemistry,2013,61(6):1249-1257.
[4]XIA Z,MCCLEMENTS D J,XIAO H.Influence of physical state of β-carotene (crystallized versus solubilized)on bioaccessibility[J].Journal of Agricultural and Food Chemistry,2015,63(3):990-997.
[5]NIK A M,CORREDIG M,WRIGHT A J.Changes in WPI-stabilized emulsion interfacial properties in relation to lipolysis and β-carotene transfer during exposure to simulated gastric-duodenal fluids of variable composition[J].Food Digestion,2010,1(1-2):14-27.
[6]NIK A M,WRIGHT A J,CORREDIG M.Micellization of beta-carotene from soy-protein stabilized oil-in-water emulsions under in vitro conditions of lipolysis[J].Journal of the American Oil Chemists Society,2011,88(9):1397-1407.
[7]RAO J,DECKER E A,XIAO H,et al.Nutraceutical nanoemulsions:influence of carrier oil composition(digestible versus indigestible oil)on β-carotene bioavailability[J].Journal of the Science of Food and Agriculture,2013,93(13):3175-3183.
[8]QIAN C,DECKER E A,XIAO H,et al.Nanoemulsion delivery systems:influence of carrier oil on β-carotene bioaccessibility[J]. Food Chemistry,2012,135(3):1440-1447.
[9]YANG Y,MCCLEMENTS D J.Vitamin E bioaccessibility:influence of carrier oil type on digestion and release of emulsified α-tocopherol acetate[J].Food Chemistry,2013,141(1):473-481.
[10]YI J,ZHONG F,ZHANG Y,et al.Effects of lipids on in vitro release and cellular uptake of β-Carotene in nanoemulsion-based delivery systems[J].Journal of Agricultural and Food Chemistry,2015,63(50):10831-10837.
[11]KOEPPEN B M,STANTON B A.Berne&Levy Physiology[M].Philadelphic,PA:Mosby Elsevier,2010:527.
[12]WANG P,LIU H J,MEI X Y,et al.Preliminary Study into the factors modulating β-carotene micelle formation in dispersions using an in vitro digestion model[J].Food Hydrocolloids,2012,26(2):427-433.
[13]HUR S J,DECKER E A,MCCLEMENTS D J.Influence of initial emulsifier type on microstructural changes occurring in emulsified lipids during in vitro digestion[J].Food Chemistry,2009,114(1):253-262.
[14]SALVIA-TRUJILLO L,QIANG C,MARTIN-BELLOSO O,et al.Influence of particle size on lipid digestion and β-carotene bioaccessibility in emulsions and nanoemulsions[J].Food Chemistry,2013,141(2):1472-1480.
[15]姚兴存,舒留泉,贾维宝,等.紫菜藻胆蛋白的制备及其体外模拟消化研究[J].食品与生物技术学报,2014,33(4):403-408. YAO Xingcun,SHU Liuquan,JIA Weibao et al.Study on preparation of the laver phycobiliprotein and its digestion in vitro[J]. Journal of Food Science and Biotechnology,2014,33(4):403-408.(in Chinese)
[16]梁蓉.以OSA变性淀粉为乳化剂的纳米乳液制备及特性研究[D].无锡:江南大学,2013.
[17]HAN J A,BEMILLER J N.Preparation and physical characteristics of slowly digesting modified food starches[J].Carbohydrate Polymers,2007,67(3):366-374.
[18]SALVIA-TRUJILLO L,QIAN C,MARTIN-BELLOSO O,et al.Modulating β-carotene bioaccessibility by controlling oil composition and concentration in edible nanoemulsions[J].Food Chemistry,2013,139(1):878-884.
[19]GOLDING M,WOOSTER T J.The Influence of emulsion structure and stability on lipid digestion[J].Current Opinion in Colloid &Interface Science,2010,15(1):90-101.
[20]梁蓉,麻建国,钟芳.纳米乳液包埋技术在功能食品中的研究进展[J].食品与生物技术学报,2013,32(6):561-568. LIANG Rong,MA Jianguo,ZHONG Fang.Research progress of nanoemulsion delivery system in functional food[J].Journal of Food Science and Biotechnology,2013,32(6):561-568.(in Chinese)
Study on the Factors Affecting the Bioaccessibility of β-Carotene in Emulsions
LIANG Rong1,2, LIN Quanquan1,3, CHEN Han1,3, ZHONG Fang*1,3
(1.Key Laboratory of Food Colloids and Biotechnology,Ministry of Education,Wuxi 214122,China;2.School of chemical and material engineering,Wuxi 214122,China;3.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
In order to investigate the parameters affecting the bioaccessibility of β-carotene in emulsion system,in vitro digestion model and three special digestion models(one without starch hydrolases,one without lipase and one without bile salts)were established to investigate the bioaccessibility of β-carotene emulsions stabilized by octenyl succinic anhydride(OSA)modified starches.The results showed that the bioaccessibility of β-carotene in four digestion models reduced in the following order:the complete model>the model without starch hydrolases>the model without bile salts>the model without lipase.It could be concluded that the bioaccessibility of β-carotene would decrease when one of the three processes of starch digestion,lipolysis or micellization of bile salts was inhibited.And the influence degree of these three factors on β-carotene bioaccessibility decreased in the following order:lipolysis>micellization>digestion of emulsifiers. Keywords: emulsion,OSA modified starches,digestion of emulsifier,lipolysis,micellization,β-carotene,bioaccessibility
TS 201.7
A
1673—1689(2016)12—1278—07
2015-07-14
国家自然科学基金项目(31401533;31571891)。
梁 蓉(1983—),女,湖北孝感人,工学博士,副教授,主要从事营养素运载体系方面的研究。E-mail:rongliang@jiangnan.edu.cn
*通信作者:钟 芳(1972—),女,河南新乡人,工学博士,教授,博士研究生导师,主要从事食品化学和食品胶体方面的研究。E-mail:fzhong@jiangnan.edu.cn

