新辅助化疗治疗进展期食管癌的近期疗效及安全性评估
张正文,卢志娟,蔡晓君
(上海交通大学医学院附属苏州九龙医院放疗科,江苏 苏州 215120)
新辅助化疗治疗进展期食管癌的近期疗效及安全性评估
张正文,卢志娟,蔡晓君
(上海交通大学医学院附属苏州九龙医院放疗科,江苏 苏州 215120)
目的 观察新辅助化疗治疗进展期食管癌患者的近期疗效及不良反应。方法选择2014年2月至2015年4月在我院放疗科治疗的96例进展期食管癌患者,依据简单数字随机表法将患者分为观察组和对照组,每组各48例,观察组患者实施基于铂类药物的综合性化疗联合放疗,而对照组患者予以单纯的放疗。随访1年,比较两组患者的近期疗效、生存率、治疗后的不良反应,以及治疗前后的免疫功能指标(T淋巴细胞亚群CD3+、CD4+、CD8+及CD3+/CD8+)。结果随访1年,观察组患者的局部复发率为8.33%(4/48),远处转移率为14.58%(7/48),均低于对照组的22.92%(11/48)和33.33%(16/48),差异均有统计学意义(P<0.05);观察组患者6个月的生存率为83.33% (40/48),12个月的生存率为75.00%(36/48),均高于对照组的64.58%(31/48)和50.00%(24/48),差异均有统计学意义(P<0.05);观察组患者治疗后的不良反应总发生率为20.83%(10/48),与对照组的18.75%(9/48)比较,差异无统计学意义(P>0.05);治疗前后,两组患者的CD3+、CD4+、CD8+及CD3+/CD8+水平比较,差异均无统计学意义(P>0.05),但治疗后观察组与对照组患者的CD3+、CD4+及CD3+/CD8+水平均明显低于治疗前,CD8+明显高于治疗前,差异均有统计学意义(P<0.05)。结论新辅助化疗联合放疗有利于提升进展期食管癌患者的临床近期疗效,同时不会增加不良反应,安全性较好,值得推广应用。
新辅助化疗;放疗;进展期食管癌;近期疗效;不良反应
食管癌是一种十分典型的消化道肿瘤,其具有高发病率以及高死亡率等特点。我国属于食管癌的高发地区,发病率呈上升趋势,目前每年有超过15万人因食管癌而死亡,对人们的生命健康造成了严重威胁[1]。因此,有关食管癌的临床治疗方法以及疗效均已受到临床医务工作者的高度关注,并投入了大量精力来研究,旨在找出新的治疗方法,降低患者的死亡率以延长其生存期。由于食管癌的早期临床症状不明显,多数患者就医时已发展到进展期阶段,其远期疗效常不理想[2]。伴随化疗技术的不断进步,新辅助化疗作为新型化疗模式被提出,且有研究发现,对进展期食管癌患者首先实施新辅助化疗联合放疗后,患者的疗效以及远期生存率均得到了显著提高,值得深入研究以及推广应用[3]。本文通过分析新辅助化疗联合放疗治疗进展期食管癌患者的近期疗效及不良反应,目的在于寻找最佳治疗措施,现报道如下:
1 资料与方法
1.1 一般资料 选择2014年2月至2015年4月在我院放疗科治疗的96例进展期食管癌患者。入选标准:(1)经组织学证实未发生远处转移且处于局部进展期的食管胃结合部腺癌;(2)通过会诊后结果表明无法进行手术或者手术的难度较大;(3)具有完整的患者随访信息数据;(4)同意新辅助化疗的治疗方案;(5)患者的卡氏评分均≥80分;(6)依照实体瘤的疗效评价标准(RECIST)评价后发现存在≥1个的可评价疗效的肿瘤病灶。排除标准:(1)患者合并有其他种类的恶性肿瘤或严重的心、肺疾病;(2)患者近期已接受过放化疗或其他抗肿瘤药物治疗;(3)新辅助化疗过程中疾病恶化或复发者;(4)患者存在长期幽门梗阻和完全吞咽障碍等症状,亦或是需进行空肠造瘘术治疗者。依据简单数字随机表法将患者分为观察组和对照组,每组48例,其中观察组中男性29例,女性19例;年龄32~68岁,平均(52.34±1.57)岁。对照组中男性30例,女性18例;年龄33~70岁,平均(52.50±1.48)岁。两组患者的临床基线资料比较差异均无统计学意义(P>0.05),具有可比性。本研究已获得患者的签字知情同意,并报送医院的伦理委员会审批通过。
1.2 治疗方法 观察组患者予以基于铂类药物的联合性化疗,其中顺铂30 mg/m2,氟尿嘧啶300 mg/m2,d1-5,为患者连续化疗1~3个周期,针对骨髓抑制及肝肾功能存在损伤者予以对症治疗。随后给予三野中心照射行常规分割照射,总量64 Gy/6~7周。通过模拟机定位设野,参照化疗胸部CT和食管吞钡所得X线片设野,其中前野宽为6~7 cm,后二野宽为5~6 cm,其上下界应超过病灶两端3~4 cm。其中颈段和胸上段食管癌的照射剂量之比是前野:二后野为1:1:1。而胸中段和胸下段之比为4:3:3。在放化疗过程当中,需每周为患者检查2次血常规,并每2周给予食管吞钡X线片检查,同时需定期复查肝肾功能。对照组患者予以单纯的放疗方案,方法同观察组。随访1年,评价疗效。
1.3 观察指标 比较两组患者的近期疗效,近期生存率,治疗后的不良反应,以及治疗前后的免疫功能指标(T淋巴细胞亚群CD3+、CD4+、CD8+及CD3+/CD8+)。
1.4 统计学方法 应用SPSS20.0统计软件进行数据分析,计数数据比较采用χ2检验,计量数据以均数±标准差(±s)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者的近期疗效比较 观察组患者的局部复发率和远处转移率均低于对照组,差异均有统计学意义(P<0.05),见表1。

表1 两组患者的近期疗效比较[例(%)]
2.2 两组患者的近期生存率比较 两组患者3个月的生存率比较差异无统计学意义(P>0.05);观察组患者6个月和12个月的生存率均高于对照组,差异均有统计学意义(P<0.05),见表2。

表2 两组患者的近期生存率比较[例(%)]
2.3 两组患者治疗后的不良反应比较 观察组患者治疗后的不良反应总发生率为20.83%(10/48),与对照组的18.75%(9/48)比较,差异无统计学意义(χ2= 0.066,P=0.798),见表3。

表3 两组患者治疗后的不良反应比较(例)
2.4 两组患者治疗前后的免疫功能指标比较 治疗前与治疗后两组患者的CD3+、CD4+、CD8+及CD3+/ CD8+分别比较,差异均无统计学意义(P>0.05)。但治疗后观察组与对照组的CD3+、CD4+及CD3+/CD8+分别明显低于治疗前,CD8+明显高于治疗前,差异均有统计学意义(P<0.05),见表4。
表4 两组患者治疗前后的免疫功能指标比较(±s,%)
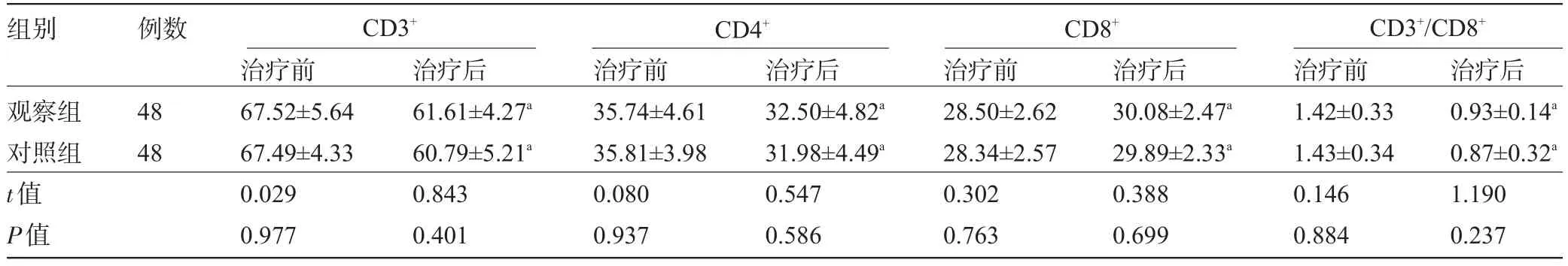
表4 两组患者治疗前后的免疫功能指标比较(±s,%)
注:与治疗前比较,aP<0.05。
组别 例数CD3+CD4+CD8+CD3+/CD8+观察组对照组t值P值治疗后0.93±0.14a0.87±0.32a1.190 0.237 48 48治疗前67.52±5.64 67.49±4.33 0.029 0.977治疗后61.61±4.27a60.79±5.21a0.843 0.401治疗前35.74±4.61 35.81±3.98 0.080 0.937治疗后32.50±4.82a31.98±4.49a0.547 0.586治疗前28.50±2.62 28.34±2.57 0.302 0.763治疗后30.08±2.47a29.89±2.33a0.388 0.699治疗前1.42±0.33 1.43±0.34 0.146 0.884
3 讨 论
手术治疗为目前公认的治疗食管癌的最佳方法,如患者身体状况较好,未发生显著性远处转移,并具备良好心肺功能储备,临床建议进行手术治疗,并通常患者术后的恢复效果较好,远期生存率较高[5]。但对于初诊时已进入进展期的患者,如立即给予手术治疗,则在后期易出现复发现象,且其5年生存率甚至低于20%,患者术后生活质量以及生存期均无法得到保障。因此,如何寻找出新型治疗方法,提高患者的疗效,延长其生存期,已成为目前研究重点。有学者提出,在进展期食管癌患者手术前进行必要的新辅助化疗,可达到帮助提高生存率和延长生存期的重要效果[6-7]。而新辅助化疗主要是在进行手术或者放疗等局部治疗手段之前所实施的一种全身性化疗,其目的在于缩小肿块范围、及时杀伤细小不易察觉的转移性肿瘤细胞,进而促进后续治疗工作的顺利进行。多项研究均表明,新辅助化疗联合放疗对于进展期食管癌患者的临床治疗发挥了一定积极意义,可帮助降低术后并发症以及复发等风险[8-9]。
本研究显示,观察组的局部复发率为8.33%,远处转移率为14.58%,均分别低于对照组的22.92%及33.33%,而观察组6个月的生存率为83.33%,12个月的生存率为75.00%,均高于对照组的64.58%及50.00%,与Tao等[10]的报道一致。提示应用新辅助化疗联合放疗的患者具有更低的局部复发率以及远处转移率,同时还可促使患者获得更高的近期生存率。究其原因,笔者认为可能与两者的协同增效作用有关。新辅助化疗通常用于部分进展期肿瘤,首先对患者进行化疗治疗,使其肿瘤范围得以缩小,然后再给予放疗等后续治疗,进而提高其临床疗效和预后效果。为进展期食管癌患者给予新辅助化疗,有利于后期治疗的顺利进行和提高预后效果[11]。这主要是因为新辅助化疗能够帮助患者病灶维持有效血药浓度以及氧浓度,并可帮助患者降低临床分期,利于肿瘤根除。同时,新辅助化疗还具有灭杀亚临床类型转移病灶和防止肿瘤术中发生种植性转移的优点,更利于改善患者的预后。本文还显示,观察组治疗后的不良反应总发生率为20.83%,与对照组的18.75%相比,差异无统计学意义,这表明观察组应用的新辅助化疗联合放疗不会增加患者围手术期内的并发症发生率。原因可能在于新辅助化疗可同时提升肿瘤对相关化疗药物的敏感度,同时还可促使患者得到更加全面的治疗,而与放疗配合更有利于促进患者的预后康复。
此外,在免疫功能的变化方面,治疗后观察组与对照组的CD3+、CD4+及CD3+/CD8+分别明显低于治疗前,CD8+明显高于治疗前,但两组之间差异无统计学意义,这表明观察组应用新辅助化疗联合放疗后,并未直接影响到患者的免疫功能。虽然有相关报道指出,新辅助化疗可能在一定程度上损害患者的免疫功能[12-14],但本文并未发现类似结果。笔者认为其原因可能在于新辅助化疗对食管癌和区域性淋巴结转移癌均起到有效杀伤作用,使得患者肿瘤分期得到显著下降,联合放疗后可避免术中出现肿瘤种植转移等情况,而此种治疗措施在清除肿瘤细胞的同时也随之改善患者的机体免疫功能,因此未出现明显的免疫功能异常。
综上所述,新辅助化疗联合放疗有利于提升进展期食管癌患者的临床近期疗效,同时不会增加不良反应,安全性较好,值得临床推广应用。
[1]陈赛华,许广照,沈飚,等.新辅助化疗联合手术与单纯手术治疗局部晚期食管癌的疗效比较[J].山西医药杂志,2013,42(9):558-560.
[2]Fan M,Lin Y,Pan J,et al.Survival after neoadjuvant chemotherapy versus neoadjuvant chemoradiotherapy for resectable esophageal carcinoma:Ameta-analysis[J].Thorac Cancer,2016,7(2):173-181.
[3]杨冉,韩金利,张卫民,等.新辅助化疗在进展期食管癌中的疗效分析[J].中国肿瘤临床,2014,41(2):119-122.
[4]Behrens A,Ell C,Lordick F,et al.Perioperative and palliative chemotherapy for esophageal cancer[J].Viszeralmedizin,2015,31(5): 341-346.
[5]Okada K,Ebisui C,Nushijima Y,et al.A case of lymph node metastases from esophageal cancer successfully treated with weekly paclitaxel chemotherapy[J].Gan To Kagaku Ryoho,2015,42(12): 1926-1928.
[6]Tani Y,Nakajima M,Kikuchi M,et al.18F-fluorodeoxyglucose positron emission tomography for evaluating the response to neoadjuvant chemotherapy in advanced esophageal cancer[J].Anticancer Res, 2016,36(1):367-373.
[7]张春来,高俊峰,洪俊,等.新辅助化疗对进展期食管癌患者生存状况的影响[J].实用癌症杂志,2015,30(2):214-216.
[8]Blum Murphy MA,Elimova E,Ajani JA,et al.Current concepts and future potential in neoadjuvant chemotherapy for esophageal cancer [J].Expert Rev Gastroenterol Hepatol,2016,10(3):383-392.
[9] Lim B,Jiang Y.Current and emerging systemic therapy in gastro-esophageal cancer"the old and new therapy for metastatic disease,the role of adjuvant and neoadjuvant therapy for localized disease"[J].Curr Clin Pharmacol,2015,10(4):267-278.
[10]Tao CJ,Lin G,Xu YP,et al.Predicting the response of neoadjuvant therapy for patients with esophageal carcinoma:an in-depth literature review[J].J Cancer,2015,6(11):1179-1186.
[11]周建华.参一胶囊联合新辅助化疗对进展期食管癌患者手术风险及预后的影响[J].中国药业,2015,24(10):32-33.
[12]Lu SL,Hsu FM,Tsai CL,et al.Serum transforming growth factor-β1 change after neoadjuvant chemoradiation therapy is associated with postoperative pulmonary complications in esophageal cancer patients undergoing combined modality therapy[J].Int J Radiat Oncol Biol Phys,2015,93(5):1023-1031.
[13]吴建忠,陈琳,王莎飞,等.新辅助化疗对乳腺癌患者ER、PR、Her2表达的影响[J].海南医学,2013,24(24):3654-3656.
[14]Bollschweiler E,Hölscher AH,Schmidt M,et al.Neoadjuvant treatment for advanced esophageal cancer:response assessment before surgery and how to predict response to chemoradiation before starting treatment[J].Chin J Cancer Res,2015,27(3):221-230.
Effect of neoadjuvant chemotherapy on the short-term efficacy and safety of patients with advanced esophageal cancer.
ZHANG Zheng-wen,LU Zhi-juan,CAI Xiao-jun.Department of Radiotherapy,Suzhou Kowloon Hospital Affiliated to Shanghai Jiaotong University School of Medicine,Suzhou 215120,Jiangsu,CHINA
ObjectiveTo observe the effect of neoadjuvant chemotherapy on the short-term efficacy and adverse reactions in the treatment of patients with advanced esophageal cancer.MethodsThe study included 96 cases of advanced esophageal cancer patients in Department of Radiotherapy in our hospital from February 2014 to April 2015. The patients were divided into the observation group and the control group according to simple random number table, with 48 cases in each group.The patients in the observation group were treated with platinum based comprehensive chemotherapy and radiotherapy,while the patients in the control group were given radiotherapy alone.The patients were followed up for 1 year,and curative effect,the short-term survival rate,adverse reactions after treatment,and the immune function indexes before and after treatment(T lymphocyte subsets CD3+,CD4+,CD8+and CD3+/CD8+)were compared between the two groups.ResultsAfter one year of follow-up,the local recurrence rate and the distant metastasis rate in the observation group were 8.33%(4/48)and 14.58%(7/48),which were significantly lower than those in control group of 22.92%(11/48)and 33.33%(16/48),P<0.05.The 6-month survival rate and 12-month survival rate in the observation group were 83.33%(40/48)and 75.00%(36/48),which were significantly higher than those in the control group of 64.58%(31/48)and 50.00%(24/48),P<0.05.The total incidence of adverse reactions was 20.83%(10/48)in the observation group and 18.75%(9/48)in the control group,with no statistically significant difference(P>0.05).CD3+,CD4+,CD8+and CD3+/CD8+levels showed no statistically significant between the two groups before and after treatment(P>0.05).After treatment,CD3+,CD4+and CD3+/CD8+levels in observation group and control group were significantly lower than that before treatment,and CD8+level was significantly higher than that before treatment(P<0.05).ConclusionPlatinum based on chemotherapy and radiotherapy can improve the clinical efficacy of advanced esophageal cancer patients,with good safety and without increasing adverse reactions,which is worthy of promotion and application.
Neoadjuvant chemotherapy;Radiotherapy;Advanced esophageal cancer;Short-term efficacy;Adverse reactions
R735.1
A
1003—6350(2016)22—3640—03
10.3969/j.issn.1003-6350.2016.22.009
2016-05-31)
张正文。E-mail:849299779@qq.com

