大豆多肽对酵母细胞增殖及耐冻性的影响
刘梦兰,李游,张健,刘新旗
(北京工商大学食品学院,北京 100048)
大豆多肽对酵母细胞增殖及耐冻性的影响
刘梦兰,李游,张健,刘新旗*
(北京工商大学食品学院,北京 100048)
编者按:蛋白质多肽研究是食品研究的热点之一,但大多数的研究是集中在多肽的制备工艺方面。蛋白肽的加工和酶解技术比较难以控制,在不影响其原有的营养特性的基础上提高产品的转化率,并要保证其生理活性物质的存在是必须重视的研究内容。然而,蛋白质多肽在食品中的应用也需要扩展和探讨,制备和应用是相辅相成的,明确了应用和效果才能真正推动多肽在食品行业的发展。上期专题内容为多肽制备研究,本期以多肽在食品中的应用为主题,探讨了大豆多肽在面包发酵过程中的应用,以及贻贝蛋白中制备的多肽在功能食品开发中的应用,以期为多肽产品的开发利用提供一些可参考的研究及推广的途径和思路。(主持人:刘新旗教授)
酵母细胞的活性和耐冻融性对于发酵制品和冷冻面团技术具有十分重要的影响。将大豆多肽、酪蛋白胨、酵母氮源三种不同的氮源加入培养基培养酵母细胞,通过对生长曲线、细胞湿重、面团发酵和冷冻后面团发酵及细胞存活率的比较,评价大豆多肽对酵母细胞活性及耐冻能力的影响。结果表明,随着培养基中大豆多肽量的增加,所得的酵母细胞生物量增加,添加量超过25 g/L以后,酵母细胞生物量不再有明显增加,25 g/L是大豆多肽的最适添加量。与相同量的其他氮源相比,大豆多肽作为培养基氮源得到的酵母细胞在冷冻后存活率更高,其发酵面团仍能够保持较好的发酵力。大豆多肽能够促进酵母细胞增殖、增强酵母细胞的耐冻性、提高面团的发酵效果。
大豆多肽;酵母细胞;面团发酵;耐冻性
大豆多肽是大豆分离蛋白经过水解之后得到的小分子多肽混合物,氨基酸平衡良好且含量丰富,组成与大豆蛋白几乎相同,由于其分子量较小,更容易被机体吸收,生理功能、营养特性和加工性能都要比大豆蛋白更为优越。
大豆多肽丰富的生理功能在人和动物中已得到了广泛证实和应用。研究表明,大豆多肽还可以作为优良的氮源改性食品微生物,在酸奶发酵中促进乳酸菌增殖、增加活菌数[1];在啤酒发酵中抑制酵母脂质体形成,改性代谢过程[2];在酵母发酵啤酒过程中添加大豆多肽作为外源氮源可以促进起始降糖,维持较高酵母数,缩短发酵周期,改善啤酒风味[3];在面包酵母的应用中,可以增强面包酵母的耐冻融性,提高面包酵母质量,得到的面包体积和质构更为优良[4-5]。
冷冻面团技术是指运用冷冻的原理与技术低温保存发酵面团,使面团的品质能够满足最终生产的要求,为消费者提供最新鲜的发酵产品,节省面点师的劳动时间。酵母是冷冻面团工艺中的一项核心因素,酵母耐冻融性差和产气持气能力低是目前冷冻面团技术中存在的重要问题,由于冷冻冷藏过程会造成大量酵母失活和死亡,影响面团发酵效果,因此,对于酵母细胞耐冻融性的增强和活性的保护成为冷冻面团研究的主要问题[6]。
酵母细胞利用氮源合成自身繁殖所需的蛋白质、酶并生成其他代谢产物,培养基中氮源的含量、种类及组成都会对酵母细胞的生长代谢产生影响。酪蛋白胨和酵母氮源都是营养丰富的发酵培养基氮源,本研究以葡萄糖作为碳源,在酵母培养基中用大豆多肽、酪蛋白胨以及酵母氮源作为氮源进行比较,研究大豆多肽对酵母增殖、发酵活性以及耐冻融特性的影响。
1 材料与方法
1.1 材料与仪器
大豆多肽(soy peptides,SP)由诺利如一(北京)生物科技有限公司提供,编号EH-01;酪蛋白胨(casein peptone,CP),Solarbio Life Sciences公司;酵母氮源(yeast nitrogen base,YNB),Sigma-Aldrich公司;葡萄糖(分析纯),西陇化工股份有限公司;高活性干酵母,安琪酵母股份有限公司;酵母浸粉、蛋白胨及琼脂粉(生物试剂),北京奥博兴生物科技有限责任公司。
ALLEGRA X-15R型离心机,美国贝克曼库尔特有限公司;CDW-FL270型低温冰箱,中科美菱低温科技有限责任公司;NanoDrop 2000C型超微量可见/紫外分光光度计,Thermo scientific公司;THZ-92B型气浴恒温振荡器、立式压力蒸汽灭菌器、超净工作台,上海博迅实业有限公司医疗设备厂;生化培养箱,上海一恒科学仪器有限公司。
1.2 实验方法
1.2.1 培养基及培养条件的确定
YNB培养基:20 g/L葡萄糖、6.7 g/L YNB、pH值5.5;SP培养基:20 g/L葡萄糖、10~30 g/L SP、pH值5.5;25 g/L CP培养基:20 g/L葡萄糖、25 g/L CP、pH值5.5;yeast extract peptone dextrose medium (YPD)培养基:10 g/L酵母浸粉、20 g/L葡萄糖、20 g/L蛋白胨(固体培养基加20 g/L琼脂粉)。YNB培养基用0.22 μm滤膜过滤除菌,其他培养基121℃、15 min高温高压灭菌;酵母细胞培养在80 mL培养基中,安琪酵母经2代活化后以1%接种量接菌于培养基,30℃、120 r/min培养24 h。
1.2.2 酵母细胞的收集及湿重测定
将培养结束后的菌液4 000 r/min、4℃、10 min离心,下层沉淀即为酵母细胞,弃上清液并用蒸馏水洗涤2次,收集酵母细胞称重得湿重。
1.2.3 发酵面团制备、发酵过程测定及蒸制
将离心后得到的酵母细胞与42 g去离子水、75 g面粉混合成面团,每份50 g于100 mL相同规格的小烧杯中压平表面,一份于37℃直接发酵,另一份置于-40℃低温冰箱储存5 d,取出常温解冻1 h后37℃发酵。面团发酵过程中每隔15 min用直尺测面团高度并记录,发酵结束后,将发酵面团沸水入锅2 100 W汽蒸20 min,5 min后开锅取出放凉后从中间切开,观察并拍照。
1.2.4 生长曲线的测定
用比浊法在波长600 nm处分别测定不同培养液的OD600值,分别在0,1,2,3,4,5,6,7,8,9,10,11,12,24,30,36,48,72 h时进行测定,绘制生长曲线。
1.2.5 酵母细胞存活率的测定
培养结束后用稀释涂布平板法对所得菌液进行平板培养计数,同时将菌液置于-40℃低温冰箱储存5 d,取出解冻1 h后用同样的方法进行平板培养计数,得到冷冻前后培养液中酵母细胞的浓度,计算存活率。
存活率=lg(冷冻后培养液中酵母细胞的浓度)/lg(未冷冻时培养液中酵母细胞的浓度)× 100%。
2 结果与分析
2.1 大豆多肽作为培养基氮源对面团中酵母细胞发酵活性的影响
发酵面团的膨胀体积可以表示面团中酵母细胞的发酵力[7],在相同內径的小烧杯中,高度的增长可以代表体积的增加。用25 g/L SP培养基、25 g/L CP培养基、YNB培养基三种不同氮源的培养基来培养酵母细胞,将所得的酵母细胞应用到发酵面团,发酵面团高度变化如图1。

图1 不同氮源培养所得酵母细胞和成面团的发酵高度Fig.1Height of fermentation dough from different nitrogen sources’yeast cells
由图1可见,与25 g/L CP培养基中所得酵母细胞发酵的面团(25 g/L CP面团)及YNB培养基中所得酵母细胞发酵的面团(YNB面团)相比,25 g/L SP培养基中培养所得酵母细胞发酵的面团(25 g/L SP面团)发酵启动最快,最先达到发酵终点,约在45 min时,不同面团之间的差异最大,此时25 g/L SP面团的增长高度约是YNB面团的3.6倍,25 g/L CP面团的2倍,表明以25 g/L大豆多肽作为培养基氮源培养酵母细胞在面团中具有更好的发酵力。
为了研究大豆多肽在冷冻面团中应用的可行性,我们将相同的面团在-40℃储存5 d后再进行发酵,发现冷冻后不同发酵面团发酵力差距更大。25 g/L SP面团能更快进入发酵状态,发酵力保持仍然很好,195 min时25 g/L SP面团的增长高度约是YNB面团的5倍,25 g/L CP面团的1.2倍(图1)。实验表明,大豆多肽培养得到的酵母细胞在冷冻后的发酵面团中能够更好地保持发酵力。
图2是不同时间发酵面团的照片记录,可以看出,60 min时面团的发酵程度相差明显,未冷冻的发酵面团随发酵的进行高度差距逐渐减小,而冷冻后25 g/L SP面团的发酵高度始终明显高于其他两种面团。结合图1,冷冻后面团发酵过程中的高度变化表明,冷冻后25 g/L SP培养基培养的酵母细胞(25 g/L SP细胞)在面团中能够保持较高的发酵力,用大豆多肽作为培养基氮源培养酵母细胞在面团冷冻过程中发酵力的损失较少。
发酵结束面团蒸制后切面照片如图3。由图3可见,未冷冻的面团在汽蒸后体积大小几乎相同,而冷冻过的25 g/L SP面团蒸制后体积最大,在表观品质方面(如气孔的大小和数量等)也与未冷冻时相似。
2.2 发酵面团中添加大豆多肽对酵母细胞发酵活性的影响
大豆多肽作为培养基氮源培养酵母细胞在普通面团和冷冻面团中都有显著效果,我们又将大豆多肽直接添加到发酵面团的制备中,发酵面团高度变化曲线如图4。由图4可见,冷冻前后面团高度均无显著差异,表明直接在面团中添加大豆多肽不会对面团的发酵产生显著影响。

图2 不同发酵面团在不同发酵时间的记录Fig.2Status from different fermentation dough’s fermentation process

图3 发酵结束的面团蒸制后的记录Fig.3Status from different fermentation dough after steamed
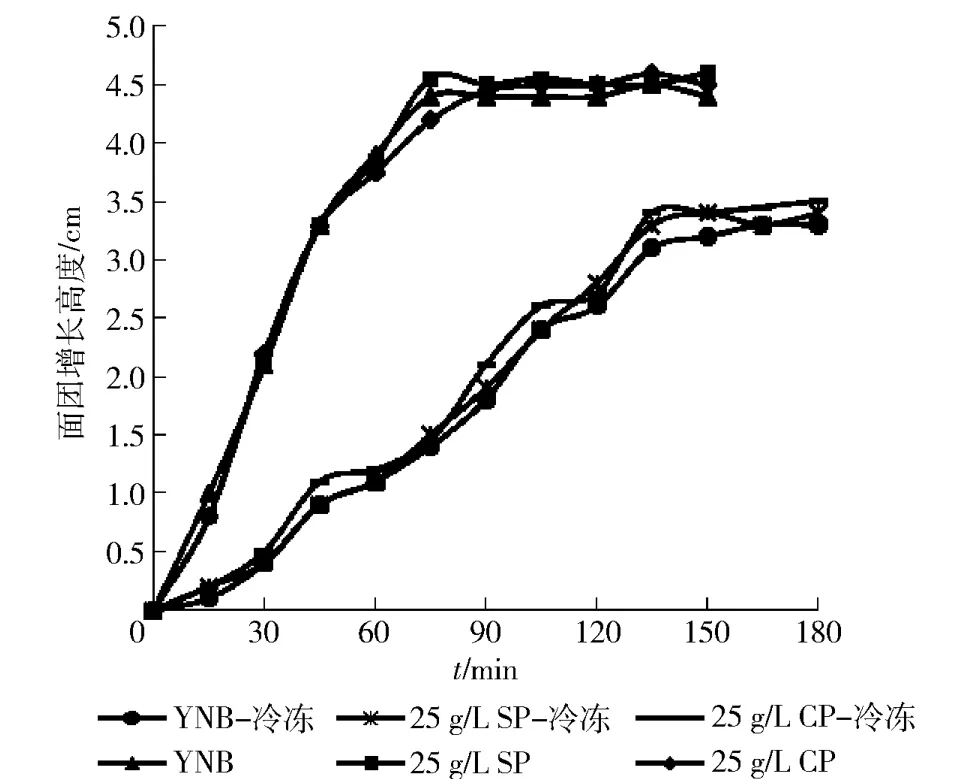
图4 发酵面团中添加不同氮源的面团发酵高度变化Fig.4Height of fermentation dough with different nitrogen sources
2.3 不同氮源对酵母细胞培养过程的影响
OD600值与菌液中的细胞密度呈正比,对不同氮源培养基中酵母细胞的生长曲线进行测定,结果如图5。由图5可见,在以25 g/L SP作为氮源的培养基中,菌液的OD600值增加更快,稳定期后OD600值也保持最大。表1为不同氮源培养基中所得的酵母湿重。表1数据显示,25 g/L SP培养基中得到的酵母细胞量也比其他两种培养基中得到的酵母细胞量更多,大约是YNB培养基的1.66倍,25 g/L CP培养基的1.34倍,证明大豆多肽可以促进酵母细胞的增殖。
关于大豆多肽添加量对所得酵母细胞量的影响,湿重结果如表2。表2中,在10~25 g/L的大豆多肽添加量时,所得酵母细胞生物量会随大豆多肽添加量的增加而增加,超过25 g/L后增加量不再显著,表明培养基中25 g/L的大豆多肽添加量可以获得较佳的培养效率。
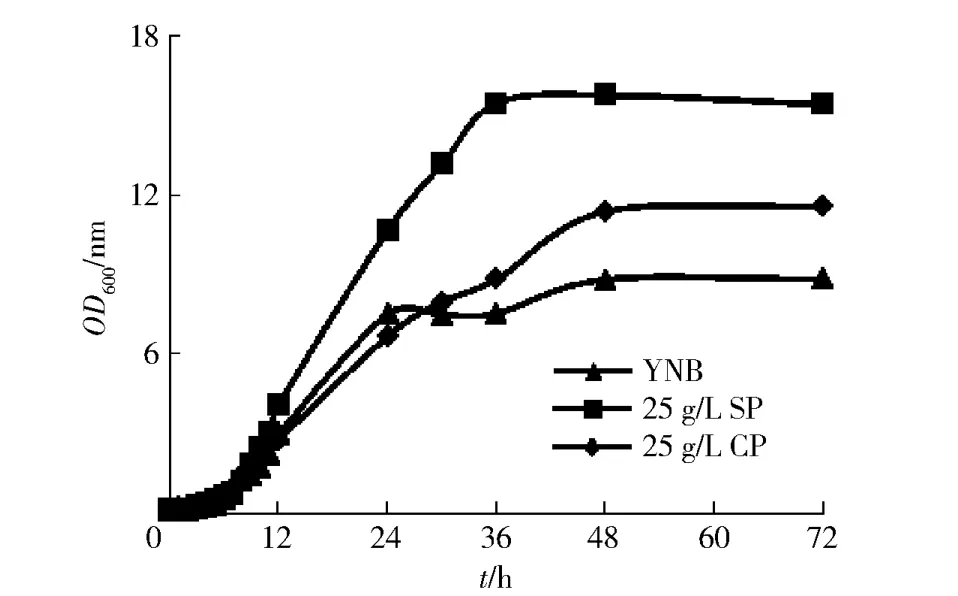
图5 不同氮源培养基中酵母细胞的生长曲线Fig.5Growth curve of yeast cells from different nitrogen sources’culture medium

表1 不同氮源培养基中所得酵母湿重Tab.1Wet weight of yeast cells from different nitrogen sources culture medium

表2 酵母细胞在不同SP添加量培养基中生长后的湿重Tab.2Wet weight of yeast cells from different medium with additional amount of SP
2.4 不同氮源培养对酵母细胞耐冻性的影响
为了研究大豆多肽培养对酵母细胞耐冻性的影响,不同培养基中酵母细胞冷冻前后的细胞浓度及存活率如图6。图6中,25 g/L SP细胞冷冻后存活率明显高于YNB培养基培养的酵母细胞(YNB细胞)和25 g/L CP培养基培养的酵母细胞(25 g/L CP细胞),比YNB细胞高约15%,比25 g/L CP细胞高约10%,表明大豆多肽可以增强酵母细胞的耐冻性,减少冷冻导致的细胞失活。
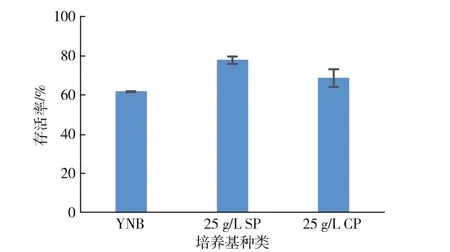
图6 冷冻前后不同培养基中的酵母细胞密度及存活率Fig.6Survival rate of yeast cells in different culture medium after frozen
3 讨论
本研究首先证明,与酵母氮源及酪蛋白胨相比,以大豆多肽作为氮源的培养基培养酵母细胞,在普通发酵面团及冷冻发酵面团中具有更好的发酵力(图1)。其冷冻面团与未冷冻面团所得发酵产品的质量无明显差异(图3),而在面团中直接添加大豆多肽对普通面团及冷冻面团都没有显著效果(图4),因此我们认为大豆多肽主要作用于酵母细胞的培养过程。大豆多肽的作用可能体现在3个方面,一是促进酵母细胞的增殖,最终得到更多的酵母细胞;二是提高酵母细胞的发酵活性,单位数量酵母细胞的发酵产气能力提高;三是增强酵母细胞的耐冻性,减少冷冻导致的细胞失活。在大豆多肽作为氮源的培养基中,菌液的OD600值增加更快(图5),最终得到的酵母细胞湿重最多(表1),表明大豆多肽能够促进酵母细胞的增殖;在大豆多肽作为氮源的培养基中,冷冻后酵母细胞的存活率最高(图6),表明大豆多肽培养可以增强酵母细胞的耐冻性,在未冷冻面团及冷冻面团中,其发酵面团的体积增长速度也最快(图1),大豆多肽培养的酵母细胞在冷冻后能够保持较高的发酵力,在冷冻面团中保证较好的发酵效率和产品品质,为在冷冻面团技术中的应用提供了依据。
在我们的研究中,大豆多肽作为培养基氮源培养酵母细胞在冷冻面团及未冷冻面团中都表现出了更好的发酵力(图1)。Izawa等[5]对大豆多肽在酵母细胞培养中的作用进行研究,发现大豆多肽作为培养基氮源培养得到了更多的酵母细胞,同时这些酵母细胞还具有更好的耐冻性;将酵母细胞应用于发酵面团,与其他不同氮源培养基培养得到的酵母细胞相比,冷冻前发酵力与其他发酵面团相同,冷冻后则表现出了更好的发酵力。
本研究及Izawa等[5]研究中,将大豆多肽直接添加到发酵面团,发现冷冻前后发酵面团的发酵状况均无明显差异(图4),而大豆多肽作为培养基原料培养酵母细胞都能够使酵母细胞繁殖量增加(图5)、耐冻融性增强(图6)。Park等[8]提出,细胞的耐冻融性与冷冻前的生理状态有关,说明大豆多肽主要在培养过程中作用于酵母细胞,改变酵母细胞的生理状态,而不是直接作用于发酵面团。Liu等[7]将大豆多肽直接添加到发酵面团中,其发酵速度更快,馒头品质提高,他们认为大豆多肽中含有大量的氨基酸和多肽,可以快速促进酵母细胞的生长代谢,促进面团发酵。我们认为,液体培养基中大豆多肽更容易在酵母细胞的生长繁殖过程中影响其代谢过程,促进细胞增殖并使细胞的发酵活性及耐冻融性等生理特性改变,而在面团制备这一物质交换吸收较难又相对短暂的过程中,大豆多肽很难对酵母细胞产生显著的增殖效果和耐冻融性等生理特性上的改变。目前已报道的大豆多肽对于微生物影响的研究也大都作用于培养过程,比如大豆多肽促进酸奶中乳酸菌的增殖[1],改善啤酒酿造中啤酒酵母的生长和发酵性能[9-10],低温培养中促进酵母细胞生长[4]。许多基因手段改性微生物的研究也都是对培养过程进行研究[11-14]。此外,Kumio等[15]研究在面团中直接添加多聚谷氨酸可以改善面团的耐冻融性,表明大豆多肽对酵母细胞耐冻融性影响的作用机制也可能来自于其他方面,可能与多聚谷氨酸的胞外作用机制相似。
氮源对于细胞的结构和功能有重要影响,细胞活性在很大程度上与氮源的获取和吸收有关[16],培养基中的氮源组成会影响细胞的特殊代谢过程,进而影响酵母细胞的生长及发酵活性。培养基中一些含氮化合物的吸收需要特定酶的参与,而某些细胞优先利用的含氮化合物能够不受特定酶限制而直接被细胞吸收[17];分子量较小、含亲水性氨基酸多的大豆多肽能够更好地促进酵母细胞的生长和发酵[10],我们推测在大豆多肽中,其他化合物与细胞优先利用的含氮化合物或亲水性氨基酸结合成小分子多肽后,可以作为一个完整的分子同时被酵母细胞吸收,提高氮源的吸收利用效率,促进酵母细胞增殖。其他研究也表明,大豆多肽比相同组成的氨基酸混合物更能促进酵母细胞的生长和发酵[8]。
目前多项研究对影响酵母细胞耐冻融性的因素进行了报道,主要有细胞内海藻糖含量[11]、细胞内甘油含量[13]、水通道蛋白的表达[14]、细胞膜的脂质组成[18]、细胞所处的生长期[8,19]、细胞生长基质的组成等[20-22]。在动物体及人体中取得的效果[22-23]表明,大豆多肽中可能含有特殊的生理活性肽,可以提高酵母细胞的发酵活性及耐冻融性;大豆多肽中某些多肽能与细胞膜表面的黏多糖结合保护细胞[24],增强酵母细胞的耐冻融性。我们认为大豆多肽在酵母细胞的培养过程中可能通过某些方式对酵母细胞的耐冻融性提高产生作用。
我们的研究结果表明,大豆多肽在酵母细胞的培养过程中,促进了酵母细胞的增殖,使酵母细胞的耐冻融性增强,改善了冷冻面团的发酵性能。大豆多肽作为一种本身可食用的功能性营养物质应用于培养基,对酵母细胞的促增殖和改性作用与基因手段等方法相比更加简便高效且安全,应用于酵母细胞制备和冷冻面团中也更容易被消费者所接受。目前,关于大豆多肽对酵母细胞的作用机理仍没有得出能够被广泛认可的确切机制,相关的深入研究对于大豆多肽在发酵食品工业中的广泛应用具有重要的理论价值,也是我们下一步的研究方向。
[1]张爱琳,樊秀花,何新益.大豆多肽对乳酸菌增殖作用的影响研究[J].食品与机械,2010,26(1):89-91.
ZHANG A L,FAN X H,HE X Y.Studied on hyperplasia of Lactobacillus in milk supplemented with soybean peptides[J].Food and Machinery,2010,26(1):89-91.
[2]KAYO I,KITAGAWA S,TADA T,et al.Modification of yeast characteristics by soy peptides:cultivation with soy peptides represses the formation of lipid bodies[J].Applied Microbiology and Biotechnology,2011,89(6): 1971-1977.
[3]赵海峰,熊丹,何士雯.外源多肽对酵母发酵性能影响的探讨[J].啤酒科技,2012,10:23-25.
ZHAO H F,XIONG D,HE S W.Effects of exogenous peptides on the fermentation performance of yeast[J].Beer Science and Technology,2012,10:23-25.
[4]SAYURI K,SUGIYAMA M,MOTOYAMA T,et al.Soy peptides enhance yeast cell growth at low temperatures[J].Biotechnology Letters,2013,35(3):375-382.
[5]IZAWA S,IKEDA K,TAKAHASHI N,et al.Improvement of tolerance to freeze-thaw stress of baker's yeast by cultivation with soy peptides[J].Applied Microbiology and Biotechnology,2007,75(3):533-537.
[6]黄敏胜,李汴生,叶久东,等.影响冷冻面团质量的因素[J].食品工业科技,2006,27(3):188-191.
HUANG M S,LI B S,YE J D,et al.Factors influencing the quality of frozen dough[J].Science and Technology of Food Industry,2006,27(3):188-191.
[7]LIU X,LI T,LIU B,et al.An external addition of soy protein isolate hydrolysate to sourdough as a new strategy to improve the quality of Chinese steamed bread:soy protein isolate hydrolysate to sourdough[J].Journal of Food Quality,2016,39(1):3-12.
[8]PARK J I,GRANT C M,ATTFIELD P V,et al.The freeze-thaw stress response of the yeast saccharomyces cerevisiae is growth phase specific and is controlled by nutritional state via the RAS-Cyclic AMP signal transduction pathway[J].Applied and Environmental Microbiology,1997,63(10):3818-3824.
[9]SAYURI K,MUKAI N,FURUKAWA Y,et al.Effect of soy peptide on brewing beer[J].Journal of Bioscience and Bioengineering,2008,105(4):360-366.
[10]ZHAO Haifeng,WAN Chunyan,ZHAO Mouming,et al.Effects of soy protein hydrolysates on the growth and fermentation performances of brewer's yeast[J].International Journal of Food Science and Technology,2014,49(9):2015-2022.
[11]TAN H G,DONG J,WANG G L,et al.Enhanced freeze tolerance of baker's yeast by overexpressed trehalose-6-phosphate synthase gene(TPS1)and deleted trehalase genes in frozen dough[J].Journal of Industrial Microbiology and Biotechnology,2014,41(8):1275-1285.
[12]JUN S,SAKATA-TSUDA Y,SUZUKI Y,et al.Disruption of the CAR1 gene encoding arginase enhances freeze tolerance of the commercial baker's yeast saccharomyces cerevisia[J].Applied and Environmental Microbiology,2003,69(1):715-718.
[13]SHINGO I,SATO M,YOKOIGAWA K,et al.Intracellular glycerol influences resistance to freeze stress in saccharomyces cerevisiae:analysis of a quadruple mutant in glycerol dehydrogenase genes and glycerol-enriched cells[J].Applied Microbiology and Biotechnology,2004,66 (1):108-114.
[14]AN T,VAN DIJCK P,DUMORTIER F,et al.Aquaporin expression correlates with freeze tolerance in baker's yeast,and overexpression improves freeze tolerance in industrial strains[J].Applied and Environmental Microbiology,2002,68(12):5981-5989.
[15]KUMIO Y,SATO M,SODA K.Simple improvement in freeze-tolerance of bakers'yeast with poly-γ-glutamate[J].Journal of Bioscience and Bioengineering,2006,102(3):215-219.
[16]JOHANSSON N,PERSSON K O,QUEHL P,et al.Ethylene production in relation to nitrogen metabolism in saccharomyces cerevisiae[J].FEMS Yeast Research,2014,14:1110-1118.
[17]DA CRUZ S H,CILLI E M,ERNANDES J R.Structural complexity of the nitrogen source and influence on yeast growth and fermentation[J].Journal of the Institute of Brewing,2002,108(1):54-61.
[18]MURAKAMI Y,YOKOIGAWA K,KAWAI F,et al.Lipid composition of commercial bakers'yeasts having different freeze-tolerance in frozen dough[J].Bioscience Biotechnology and Biochemistry,1996,60(11): 1874-1876.
[19]LEWIS J G,LEARMONTH R P,WATSON K.Role of growth phase and ethanol in freeze-thaw stress resistance of saccharomyces cerevisiae[J].Applied and Environmental Microbiology,1993,59(4):1065-1071.
[20]万春艳.大豆活性肽对酵母增殖代谢及啤酒发酵的影响研究[D].广州:华南理工大学,2012.
[21]师广波,辛寒晓,马艳芳,等.固定化风味蛋白酶水解法生产高水解度大豆肽[J].食品科学技术学报,2015,33(6):51-56.
SHI G B,XIN H X,MA Y F,et al.Production of soybean peptide with high degree of hydrolysis by immobilized flavourzyme[J].Journal of Food Science and Technology,2015,33(6):51-56.
[22]NAGAOKA S,MIWA K,ETO M,et al.Soy protein peptic hydrolysate with bound phospholipids decreases micellar solubility and cholesterol absorption in rats and caco-2 cells[J].Journal of Nutrition,1999,129(9): 1725-1730.
[23]MOTOHIRO M,SAMOTO M,KOHNO M,et al.Improvement in the intestinal absorption of soy protein by enzymatic digestion to oligopeptide in healthy adult men[J].Food Science and Technology Research,2007,13 (1):45-53.
[24]ZIEGLER A,BLATTER X L,SEELIG A,et al.Protein transduction domains of HIV-1 and SIV TAT interact with charged lipid vesicles:binding mechanism and thermodynamic analysis[J].Biochemistry,2003,42 (30):9185-9194.
Influence of Soy Peptides on Yeast Cells'Proliferation and Tolerance to Freeze-thaw Stress
LIU Menglan,LI You,ZHANG Jian,LIU Xinqi*
(School of Food and Chemical Engineering,Beijing Technology and Business University,Beijing 100048,China)
Yeast cells’activity and tolerance to freeze-thaw stress has an important influence on fermented products and frozen-dough technology.Soy peptides,casein peptone,and yeast nitrogen base were used as different yeast medium nitrogen sources to culture yeast cells.The effects of soy peptide on yeast cells’activity and the tolerance to freeze-thaw stress were evaluated based on the growth curves,survival rates after freezing,cell wet weights,and dough fermentation.The results showed that the more soy peptides were added,the more yeast biomass was obtained,which did not increase when soy peptides reached 25 g/L or higher.Therefore,the optimum amount of soy peptides was 25 g/L.Yeast cells had a higher survival rate when they were incubated in media containing soy peptides,and the corresponding dough also retained better fermenting capability after freeze-thaw steps.Compared with other nitrogen sources,soy peptides increased the cell biomass and improved the cell tolerance to freeze-thaw stress and the fermentation effect.
soy peptides;yeast cell;dough fermentation;tolerance to freeze-thaw stress
叶红波)
TS201.4;TS214;Q514
A
10.3969/j.issn.2095-6002.2016.06. 004
2095-6002(2016)06-0017- 07
2016-11- 02
“十三五”国家重点研发计划项目(2016YFD0400401)。
刘梦兰,女,硕士研究生,研究方向为功能性食品添加剂;
*刘新旗,男,教授,博士,主要从事蛋白质功能开发与功能食品研究。
。
刘梦兰,李游,张健,等.大豆多肽对酵母细胞增殖及耐冻性的影响[J].食品科学技术学报,2016,34(6):17-23.LIU Menglan,LI You,ZHANG Jian,et al.Influence of soy peptides on yeast cells'proliferation and tolerance to freezethaw stress[J].Journal of Food Science and Technology,2016,34(6):17-23.

