莲子红衣多酚对α-葡萄糖苷酶的抑制作用
高航,单雪玉,高延芬,徐虹,*
(1.北京工商大学北京市食品添加剂工程技术研究中心/北京食品营养与人类健康高精尖创新中心,北京 100048;2.深圳市航天食品分析测试中心有限公司,广东深圳 518040)
莲子红衣多酚对α-葡萄糖苷酶的抑制作用
高航1,单雪玉1,高延芬2,徐虹1,*
(1.北京工商大学北京市食品添加剂工程技术研究中心/北京食品营养与人类健康高精尖创新中心,北京 100048;2.深圳市航天食品分析测试中心有限公司,广东深圳 518040)
采用分光光度法测定了不同条件下莲子红衣多酚对α-葡萄糖苷酶活性抑制作用的影响,在单因素实验基础上运用L9(34)正交法得到莲子红衣多酚对α-葡萄糖苷酶活性抑制作用的优化条件。研究结果显示,在pH值为6.8,质量浓度为1.50 g/L,反应时间为20 min时,莲子红衣多酚对α-葡萄糖苷酶活性的抑制率最高,可达67.99%±1.79%。莲子红衣多酚对α-葡萄糖苷酶的抑制作用类型为反竞争性抑制,抑制常数为0.24 g/L。
莲子红衣多酚;α-葡萄糖苷酶;活性抑制;抑制类型
研究发现,降低餐后血糖可有效控制糖尿病及其并发症的发展[1]。α-葡萄糖苷酶是小肠绒毛上皮细胞刷状缘膜上存在的寡糖水解酶,可催化α-1,4糖苷键水解。α-葡萄糖苷酶可将碳水化合物分解为葡萄糖,因此抑制α-葡萄糖苷酶活性,并可延缓及阻碍葡萄糖的生成及吸收,降低餐后血糖峰值,达到控制及预防糖尿病的效果[2]。众多研究已表明,植物多酚对α-葡萄糖苷酶具有很强的抑制作用,并且具有来源广泛、毒副作用小等特点。目前,植物源α-葡萄糖苷酶抑制剂的筛选已经成为天然产物研究领域的热点[3-5]。
莲子红衣为莲子壳与莲子果实中间包裹的一层红褐色种皮,《本草纲目》和《中华药典》记载其味苦而涩、性凉无毒,入心、脾二经,且具有清热利湿、收敛,治湿热泻痢等作用[6]。在莲子加工过程中,这层红衣一般通过机械打磨去除,我国每年在白莲加工过程中会产生约1万t莲子红衣粉。目前这些加工副产物尚无有效利用方式,且因其味涩甚至不能作为牲畜饲料,因而常被大量废弃并造成环境污染。本课题组前期研究已经对莲子红衣中的活性成分进行了初步探索,其中活性多酚类物质含量较高,且具有显著的抗氧化和抗苹果褐变活性[7-8]。为更好地开发利用莲子工业加工中的副产物,本研究从莲子红衣粉中提取获得其中的多酚物质,探讨其对α-葡萄糖苷酶活性的抑制作用。希望本研究成果能够为糖尿病人群功能食品的研发提供科学依据。
1 材料与方法
1.1 材料与试剂
莲子红衣粉,三湘贸易公司;α-葡萄糖苷酶(BR),上海源叶生物科技有限公司;4-硝基苯-β-D-半乳吡喃糖苷(pNPG)、4-硝基苯酚(PNP),美国Sigma公司;Na2CO3、K2HPO4、KH2PO4、Na2CO3(均为化学纯),国药集团化学试剂有限公司;没食子酸(分析纯),天津市光复科技发展有限公司;福林酚(化学纯),北京普博欣生物科技有限责任公司。
1.2 仪器与设备
JA2003C型电子天平,上海越平科学仪器有限公司;FE20型实验室pH计,梅特勒-托利多仪器(上海)有限公司;HH-501型超级恒温水浴(数显),常州国华电器有限公司;DHG-9246A型电热恒温鼓风干燥箱,上海精密实验设备有限公司; 22PCO2435型可见分光光度计、SpectrumLab 53型紫外-可见分光光度计,上海棱光技术有限公司;QL -901 VORTEX型漩涡混匀器,海门市其林贝尔仪器制造有限公司;MODULYOD-230型真空冷冻干燥机,美国热电公司。
1.3 实验方法
1.3.1 莲子红衣多酚的提取
莲子红衣(日照晒干,含水量为8.5%)粉碎过筛至80目,按料(g)液(L)比1∶1.8加入体积分数为60%的乙醇,在49℃下300 W微波提取9.5 min,提取液10000 r/min离心10 min,上清液旋蒸后真空冷冻干燥,4℃保存,备用。
1.3.2 莲子红衣多酚的质谱分析
采用Thermo的TSQ质谱定量分析莲子红衣多酚可能含有的多酚类物质。通过与芦丁、表儿茶素等8种标准品进行比对,根据出峰情况来确定莲子红衣多酚中各种标品的含量。色谱柱,C18(30 mm ×3.0 mm);进样量7 μL,流速200 μL/min;流动相A,0.1%甲酸-氰化氢;流动相B,0.1%甲酸-水,梯度洗脱条件见表1。
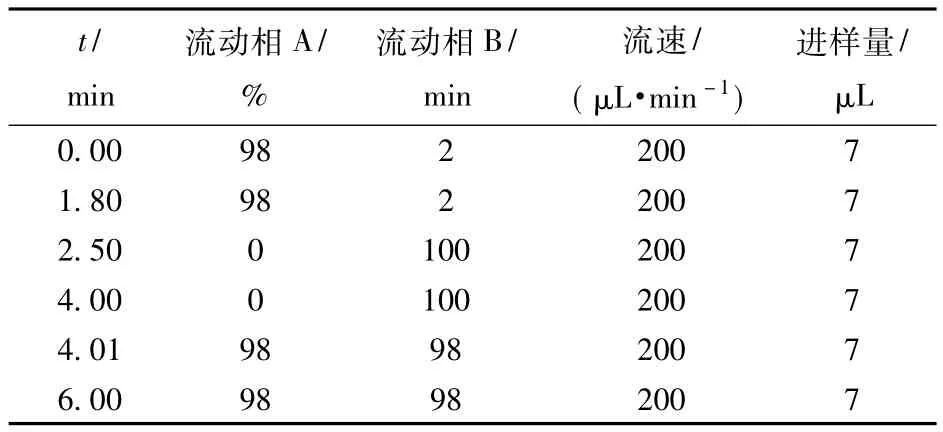
表1 梯度洗脱莲子红衣多酚成分的条件Tab.1Gradient elution for determination of compounds
1.3.3 莲子红衣多酚提取物含量的测定
1)标准曲线的建立[9]。准确称取没食子酸0.10 g,蒸馏水溶解并定容至100 mL,分别移取0,20,40,60,80,100,120 μL到7个具塞试管中并用蒸馏水定容至1 mL,即得到不同质量浓度的没食子酸标准溶液;分别加入2 mL质量浓度为20 g/L的 Na2CO3,2 min后,将1 mL的福林酚试剂(按体积比1∶1与水稀释)加入到混合物中,反应30 min后在750 nm波长处测定吸光度;以没食子酸质量浓度为横坐标,吸光度为纵坐标绘制标准曲线。
2)样品测定。加入适当质量浓度样品,具体步骤同上,通过回归方程得出等价没食子酸含量。
1.3.4 α-葡萄糖苷酶活力的测定[10]
α-葡萄糖苷酶活力单位定义:37℃,在pH值为6.8条件下,每分钟水解底物释放1.0 μmol对硝基苯酚规定为一个酶活力单位(U)。
莲子红衣多酚对α-葡萄糖苷酶活性的抑制率计算公式,见式(1)。

1.3.5 反应时间对α-葡萄糖苷酶活性抑制作用的影响实验
将α-葡萄糖苷酶溶液与600 μL莲子红衣多酚溶液混匀后在37℃预热5 min,加入200 μL、pNPG启动反应,分别在10,15,20,25,30 min时终止反应,测定不同时间剩余酶活力,计算抑制率。
1.3.6 莲子红衣多酚浓度对α-葡萄糖苷酶活性抑制作用的影响实验
在pH值为6.8时,将α-葡萄糖苷酶溶液分别与质量浓度为0.10,0.50,1.00,1.50,2.00 g/L的莲子红衣多酚溶液混匀,并在37℃预热5 min,加入pNPG启动反应。20 min后终止反应,测定加入不同浓度多酚溶液后的酶活力,并计算抑制率。
1.3.7 缓冲液pH值对α-葡萄糖苷酶活性抑制作用的影响实验
以pH值为6.4,6.6,6.8,7.0,7.2的缓冲液为溶剂,分别配制1.0 U/mL α-葡萄糖苷酶溶液和1.0 mmol/L pNPG底物溶液。将1.0 U/mL α-葡萄糖苷酶600 μL与1.00 g/L莲子红衣多酚溶液600 μL混匀,于37℃水浴中预热5 min,加入1.0 mmol/L pNPG 200 μL,20 min后终止反应,测定不同pH值缓冲液条件下的酶活力,计算抑制率。
1.3.8 莲子红衣多酚抑制α-葡萄糖苷酶活力的条件优化实验
为了综合考虑各因素对α-葡萄糖苷酶抑制作用的影响,综合单因素实验结果,选择反应时间(A)、抑制剂质量浓度(B)、pH值(C)三个因素,采用L9(34)正交试验法对抑制α-葡萄糖苷酶活性的条件进行优化,正交试验因素水平,见表2。1.3.9抑制作用类型的测定

表2 正交试验因素水平Tab.2Factors and levels of orthogonal experiments
将α-葡萄糖苷酶分别与质量浓度为1.00,1.50,2.00 g/L的莲子红衣多酚混匀,预热5 min后加入不同浓度的pNPG溶液反应20 min,加入0.5 mol/L Na2CO31.0 mL。以底物质量浓度的倒数1/[S]为横坐标,反应速度的倒数1/v为纵坐标,绘制莲子红衣多酚对α-葡萄糖苷酶抑制作用的双倒数图,根据双倒数方程计算其抑制常数Ki。
2 结果与分析
2.1 莲子红衣多酚中成分及含量分析
莲子红衣多酚组成和含量分析结果见表3。据表3可知,莲子红衣多酚中儿茶素的质量分数最高,占28.05%,表儿茶素和没食子酸次之,分别为23.24%和16.36%。根皮苷、芦丁、阿魏酸、槲皮素和咖啡酸的含量都较少,且依次减少。根据标准曲线的制作方法,得回归方程,见式(2)。
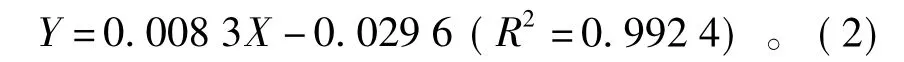
通过回归方程得出每克莲子红衣提取物中多酚质量为(237.91±11.28)mg。
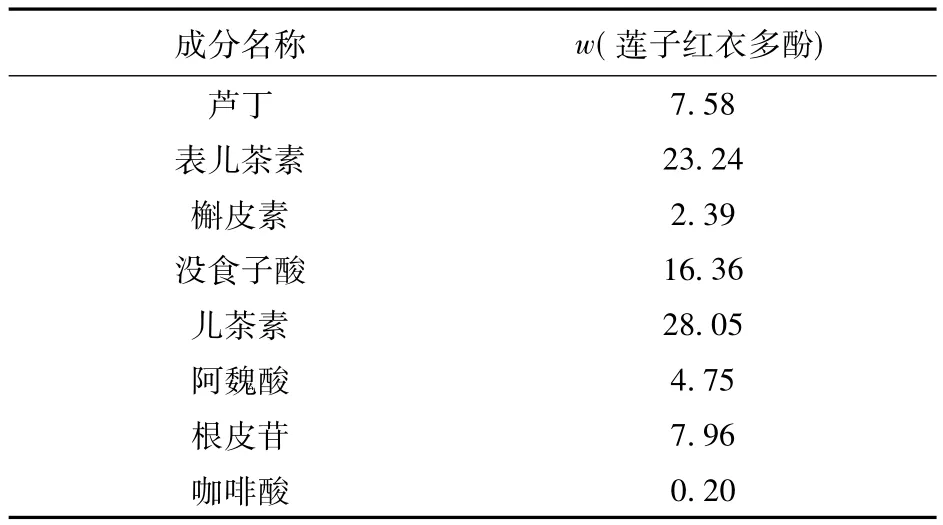
表3 莲子红衣多酚组成和含量分析结果Tab.3Content analysis results of lotus red polyphenol %
2.2 反应时间对α-葡萄糖苷酶活性抑制作用的影响
按照1.3.5方法,在酶与底物反应时间分别为10,15,20,25,30 min时终止反应,计算莲子红衣多酚对α-葡萄糖苷酶活性的抑制率,变化趋势如图1。

图1 反应时间与α-葡萄糖苷酶活性抑制作用的关系Fig.1Effect of different reaction time on activity of α-glucosidase
从图1可以看出,在反应时间小于20 min时,莲子红衣多酚对α-葡萄糖苷酶的抑制效果不佳,抑制率较低。随着反应时间的延长,莲子红衣多酚对α-葡萄糖苷酶的抑制率呈现出先升高后降低的趋势,且在加入底物反应20 min时,抑制率达到最大。
2.3 莲子红衣多酚质量浓度对α-葡萄糖苷酶活性抑制作用的影响
按照1.3.6方法,将质量浓度分别为0.10,0.50,1.00,1.50,2.00 g/L的莲子红衣多酚溶液加入到反应体系当中,终止反应后计算莲子红衣多酚对α-葡萄糖苷酶活性的抑制率,结果见图2。
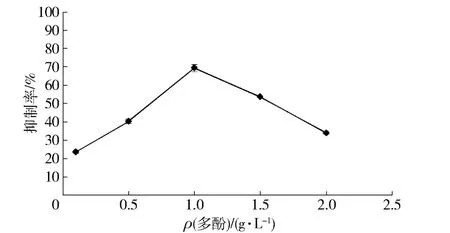
图2 莲子红衣多酚质量浓度与α-葡萄糖苷酶活性抑制作用的关系Fig.2Effect of lotus seed skin concentrations on activity of α-glucosidase
图2显示,莲子红衣多酚在较低浓度范围内即可达到较高的抑制效果。莲子红衣多酚质量浓度为1.00 g/L时,抑制作用接近70%。然而并非多酚质量浓度越大,抑制效果越好,当多酚质量浓度在2.00 g/L时,抑制率迅速下降,很可能是多酚达到一定浓度后会改变酶的构象。
2.4 缓冲液pH值对α-葡萄糖苷酶活性抑制作用的影响
按照1.3.7方法,在pH值为6.6,6.8,7.0,7.2的缓冲液体系中启动反应,计算莲子红衣多酚对α-葡萄糖苷酶活性的抑制率,变化曲线见图3。
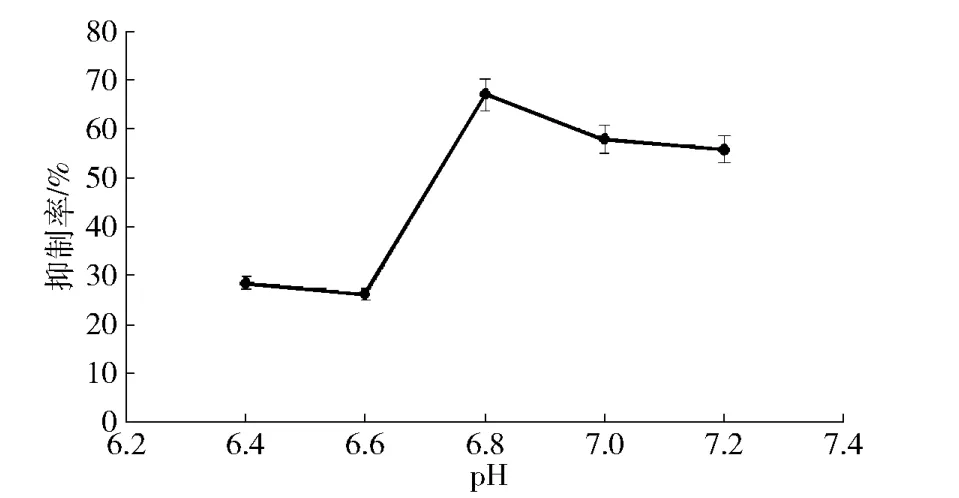
图3 缓冲液pH值与α-葡萄糖苷酶活性抑制作用的关系Fig.3Effect of pH on activity of α-glucosidase
由图3可见,在实验范围内(pH值为7.0~7.8),α-葡萄糖苷酶抑制率先随pH值增加而迅速升高,随后随着pH值增加而逐渐下降。在pH值为6.8时,α-葡萄糖苷酶的抑制率达到最高。
2.5 莲子红衣多酚抑制α-葡萄糖苷酶活力的条件优化
采用正交试验法对莲子红衣多酚抑制α-葡萄糖苷酶活性作用进行优化,结果见表4。
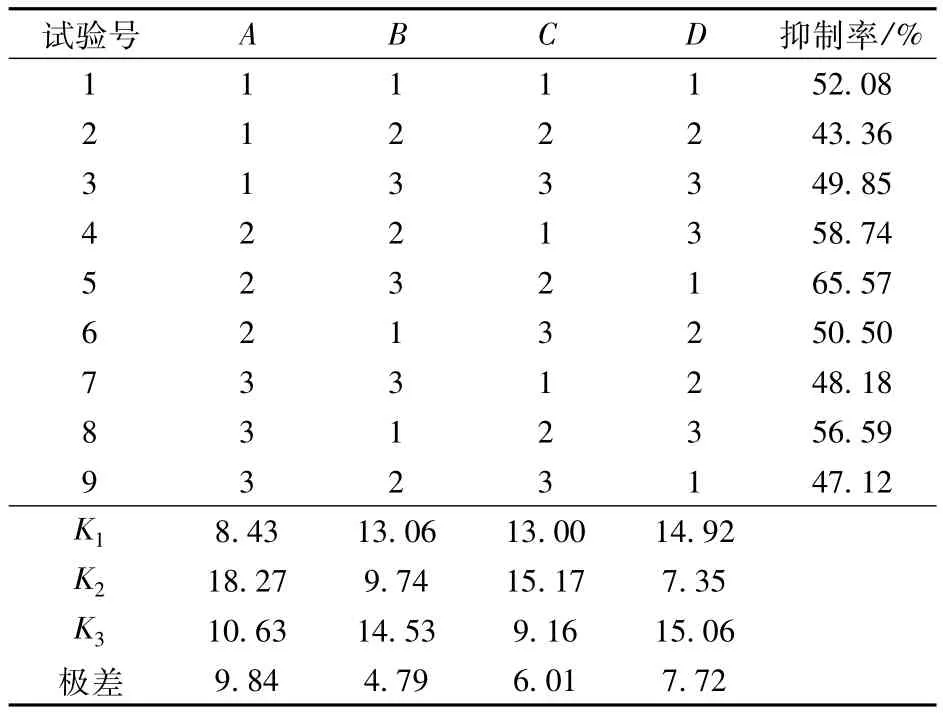
表4 正交试验结果Tab.4Results of orthogonal design
表4中,通过K值大小可得出各因素对抑制α-葡萄糖苷酶活性的影响效果,从大到小顺序为:反应时间、pH值、抑制剂质量浓度。综合分析结果可知,抑制效果较佳时反应条件为A2B3C2,即在pH值为6.8条件下,使用抑制剂质量浓度为1.50 g/L,反应时间为20 min时,莲子红衣多酚对α-葡萄糖苷酶活性抑制率可达到最高。
2.6 验证实验结果分析
按照A2B2C3的条件进行验证实验,结果显示,A2B2C3的抑制率为67.99%±1.70%。因此,最终确定优化反应条件为pH值6.8,抑制剂质量浓度1.50 g/L,反应时间为20 min。
2.7 抑制作用类型的确定
按照1.3.9方法,测定不同条件下的酶活力,采用双倒数作图法,求解抑制常数并确定抑制类型,结果见图4。

图4 莲子红衣多酚抑制α-葡萄糖苷酶的Lineweaver-Burk曲线Fig.4Lineweaver-Burk figure of polyphenols from lotus seed skin on α-glucosidase
从图4可以看出,莲子红衣多酚对α-葡萄糖苷酶的抑制作用与其质量浓度存在剂量-效应关系。随着莲子红衣多酚质量浓度的增大,其对α-葡萄糖苷酶抑制作用逐渐增强。α-葡萄糖苷酶动力学曲线vmax值变小,Km值也变小,而vmax/Km值不变。这表明了莲子红衣多酚是α-葡萄糖苷酶的反竞争性抑制剂,即抑制剂只与酶-底物复合物结合,而不与游离酶结合。当莲子红衣多酚质量浓度为1.00 g/L时,其对α-葡萄糖苷酶的抑制常数Ki为0.24 g/L。
3 讨论与结论
我国为产莲大国,莲子在加工过程中打磨出的大量红衣粉,目前仅被作为废弃物浪费,至今没有得到很好应用。研究发现,这些废弃物中不乏丰富的营养物质和活性成分[8],若能从中分离获得有效的功能性成分并在保健食品中得以应用,将会大大提高莲子红衣副产物的利用率,并有助于提升莲子的综合利用价值和经济价值,同时希望为新资源的开发利用提供更多的理论依据。
大量研究显示,多种植物中所含的多酚类物质具有α-葡萄糖苷酶的活性抑制作用,从而延缓人体对食物中葡萄糖的吸收,降低餐后血糖。比较近年来多篇研究报道,可知不同植物源α-葡萄糖苷酶抑制剂的抑制作用差别很大,如石榴花多酚对体外α-葡萄糖苷酶的抑制率可达90.79%[11],而溪黄草多酚对α-葡萄糖苷酶的抑制率为44.15%[12]。本研究结果显示,莲子红衣多酚对体外α-葡萄糖苷酶的抑制率可达67.99%±1.79%,其抑制类型为反竞争性抑制,抑制常数Ki为0.24 g/L。从目前研究来看,酚类提取物对α-葡萄糖苷酶的抑制作用类型包括非竞争性抑制、竞争性抑制和反竞争性抑制,这可能与其主要抑制酶活性成分的组成与结构以及与酶活性中心的结合部位和结合方式等的不同有关[13-14]。后期我们将进一步对莲子红衣多酚进行分级分离,以期更深入研究各多酚组分与α-葡萄糖苷酶之间的构效关系。此外,我们还将进行动物实验,从体内到体外综合评价莲子红衣多酚对α-葡萄糖苷酶的抑制机制,发挥其辅助治疗糖尿病的功效。
综上所述,不良饮食是导致糖尿病的主要原因之一,如能有效控制体内α-葡萄糖苷酶的活性,便可减少食物中糖类物质的消化吸收,达到预防和治疗糖尿病的效果。从本研究结果可知,莲子红衣多酚对α-葡萄糖苷酶的抑制效果显著,且原料资源丰富、价格极其低廉,具有良好的开发和应用前景。
[1]张洁.老年糖尿病患者餐后低血压发生机制及药物干预的研究[D].北京:北京协和医学院,2014.
[2]LEE S H,KANG S M,KO S C,et al.Octaphlorethol A: a potent α-glucosidase inhibitor isolated from Ishige foliacea shows an anti-hyperglycemic effect in mice with streptozotocin-induced diabetes[J].Food and Function,2014,5(10):2602-2608.
[3]KANG S J,PARK J H Y,CHOI H N,et al.α-Glucosidase inhibitory activities of myricetin in animal models of diabetes mellitus[J].Food Science and Biotechnology,2015,24(5):1897-1900.
[4]GONDI M,PRASADA RAO U J S.Ethanol extract of mango(Mangifera indica L.)peel inhibits α-amylase and α-glucosidase activities,and ameliorates diabetes related biochemical parameters in streptozotocin(STZ)-induced diabetic rats[J].Journal of Food Science and Technology,2015,52(12):7883-7893.
[5]DONG H Q,LI M,ZHU F,et al.Inhibitory potential of trilobatin from Lithocarpus polystachyus Rehd against αglucosidase and α-amylase linked to type 2 diabetes[J].Food Chemistry,2012,130(2):261-266.
[6]郑宝东,郑金贵,曾绍校.我国主要莲子品种中三种功效成分的研究[J].营养学报,2004,26(2):158-160.
ZHENG B D,ZHENG J G,ZENG S J.Study on three functional components of Chinese main lotus seed varieties[J].Acta Nutrimenta Sinica,2004,26(2):158-160.
[7]高航,高延芬,徐虹.莲子红衣醇提物的抗氧化和抗褐变活性[J].食品科学,2013,34(11):83-87.
GAO H,GAO Y F,XU H.Antioxidant and anti-browning activities of ethanol extract from lotus seed skin[J].Food Science,2013,34(11):83-87.
[8]徐虹,朱雨薇,曹杨,等.莲子红皮多糖提取工艺研究[J].食品工业科技,2011,33(2):266-268.
XU H,ZHU Y W,CAO Y,et al.Study on extraction technology of polysaccharides from red skin of locus seed[J].Science and Technology of Food Industry,2011,33 (2):266-268.
[9]朱彩平,夏德水.Folin-Ciocalteu比色法测定石榴皮提取物中的多酚[J].光谱实验室,2012,29(3):1356-1360.
ZHU C P,XIA D S.Determination of polyphenols in pomegranate peel extracts by Folin-Ciocalteu colorimetry[J].Chinese Journal of Spectroscopy Laboratory,2012,29 (3):1356-1360.
[10]张蓉,刘利娥,杨卫红.芝麻叶多酚对α-葡萄糖苷酶的抑制作用研究[J].医药论坛杂志,2014,35(1): 69-72.
ZHANG R,LIU L E,YANG W H.Inhibitory effect of total on alpha-glucosidase polyphenols from sesame leaf[J].Journal of Medical Forum,2014,35(1):69-72.
[11]阿依仙木·加帕尔,闫冬,何雯,等.维药石榴花多酚提取物对α-葡萄糖苷酶和α-淀粉酶抑制作用的研究[J].新疆医科大学学报,2013,36(5):581-583.
AYXAN·Jappar,YAN D,HE W,et al.Inhibitory effects of pomegranate polyphenol extracts on α-glucosidase and α-amylase[J].Journal of Xinjiang Medical University,2013,36(5):581-583.
[12]费群勤,秦一禾,杨孟伽,等.乌龙茶粗多酚、EGCG和EGCG3″Me体外抑α-葡萄糖苷酶活性[J].食品科学,2014,35(21):10-15.
FEI Q Q,QIN Y H,YANG M G,et al.In vitro inhibitory effects of oolong tea polyphenols,EGCG and EGCG3"me on α-glucosidase activity[J].Food Science,2014,35(21):10-15.
[13]林恋竹.溪黄草有效成分分离纯化、结构鉴定及活性评价[D].广州:华南理工大学,2013.
[14]KANG Wenyi,ZHANG Li.α-Glucosidase inhibitory activity of extracts of five genera of gesneriaceae[J].Natural Product Research and Development,2010,22:122 -125.
Inhibitory Effect on α-Glucosidase Activity of Polyphenol from Red-skin of Lotus Seed
GAO Hang1,SHAN Xueyu1,GAO Yanfen2,XU Hong1,*
(1.Beijing Engineering and Technology Research Center of Food Additives/Beijing Advanced Innovation Center for Food Nutrition and Human Health,Beijing Technology and Business University,Beijing 100048,China; 2.Shenzhen Space Food Analysis and Test Center Limited Company,Shenzhen 518040,China)
The aim of the research was to discuss the inhibitory effect of polyphenol from lotus seed redskin on α-glucosidase activity.It was designed to measure the α-glucosidase activity in different conditions using spectrophotometry.With the inhibitory effect on α-glucosidase activity as the index,the inhibitory conditions were optimized by the L9(34)orthogonal optimization method.The results revealed that the optimal inhibition rate was 67.99%±1.79%at pH 6.8,1.50 g/L of polyphenol concentration and 20 min of reaction time.In addition,polyphenol was an anti-competitive inhibition type of inhibitor on αglucosidase,and its inhibition constant was 0.24 g/L.
polyphenol from lotus seed red-skin;α-glucosidase;activity inhibition;inhibitor type
叶红波)
TS201.2
A
10.3969/j.issn.2095-6002.2016.06. 007
2095-6002(2016)06-0036- 05
2016-03- 01
北京市自然科学基金资助项目(6162003);北京市属高等学校创新团队建设与教师职业发展计划项目(IDHT20130506)。
高航,女,硕士研究生,研究方向为功能性食品;
*徐虹,女,副教授,博士,主要从事食品营养与安全方面的研究。
。
高航,单雪玉,高延芬,等.莲子红衣多酚对α-葡萄糖苷酶的抑制作用[J].食品科学技术学报,2016,34(6):36-40.
GAO Hang,SHAN Xueyu,GAO Yanfen,et al.Inhibitory effect on α-glucosidase activity of polyphenol from red-skin of lotus seed[J].Journal of Food Science and Technology,2016,34(6):36-40.

