宁肾颗粒对LPS诱导大鼠系膜细胞增殖及凋亡的影响*
赵 林,李安源,齐芳华,王志学,牟林茂
(山东大学附属省立医院 济南 250021)
宁肾颗粒对LPS诱导大鼠系膜细胞增殖及凋亡的影响*
赵 林,李安源**,齐芳华,王志学,牟林茂
(山东大学附属省立医院 济南 250021)
目的:本研究旨在探讨宁肾颗粒对脂多糖(LPS)诱导大鼠系膜细胞(MCs)增殖及凋亡的影响。方法:采用MTT法、细胞流式技术、Western bolt法检测不同剂量宁肾颗粒中药血清对LPS诱导大鼠系膜细胞增殖、凋亡及血小板源生长因子-BB(PDGF-BB)蛋白表达的作用。结果:含药血清能抑制LPS诱导大鼠MCs增殖、促进MCs凋亡,下调PDGF-BB蛋白的过度表达。结论:宁肾颗粒可抑制LPS诱导的MCs异常增殖、促进MCs凋亡,其分子机制可能与抑制PDGF-BB蛋白的过度表达有关。
宁肾颗粒 系膜细胞 增殖 凋亡 血小板源生长因子-BB
肾小球系膜细胞(Mesangial cells,MCs)异常增殖是多种肾小球疾病的基本病理改变。MCs异常增殖可引起细胞外基质的过量生成和聚集,参与肾小球炎症的发展,最终可导致肾小球硬化、肾脏纤维化及终末期肾功能衰竭;抑制MCs异常增殖在延缓慢性肾脏疾病进展的过程中起到重要作用[1]。宁肾颗粒在治疗难治性肾病综合征取得了较好的临床疗效[2],但其作用机制尚不明确。本研究旨在通过体外实验,观察宁肾颗粒对脂多糖(Lipopolysaccharide,LPS)诱导增殖的大鼠MCs异常增殖及凋亡的影响,探讨宁肾颗粒治疗难治性肾病综合征的作用机制。
1 材料与方法
1.1 试剂与仪器
杜尔伯科改良伊格尔(Dulbecco modified Eagle medium,DMEM)培养基系美国Gibco公司;四甲基偶氮唑蓝(MTT)和二甲基亚砜(Dimethyl Sulphoxide,DMSO)系美国Sigma公司生产;PDGFBB(ab16829) 、GAPDH(ab9485) 多克隆抗体由英国Abcam公司生产;辣根过氧化物酶标记的山羊抗兔二抗由北京中杉公司生产。Annexin V-FITC凋亡检测试剂盒、流式细胞仪FACSCan均由美国BD公司产。计算机凝胶成像分析系统Alphaimager 2200型(美国Pharmacia Biotech公司),酶标仪Spectra Max M2型(美国Molecular Devices公司),蛋白垂直电泳槽(美国Bio-Rad公司),电转膜设备(美国Bio-Rad公司),EC250-90恒流/恒压电泳仪(英国Hybaid,IEC仪器公司 ),低温高速台式离心机IEC Micranax RF型(德国Beckman公司)。
1.2 药物
宁肾颗粒的组成是仙茅、生地黄、黄芪、仙灵脾、金樱子、覆盆子、白花蛇舌草、萆薢、益母草(药物应用三九免煎中药颗粒,批号:20081016)。
1.3 含药血清的制备
实验含药血清的制备采用清洁级雄性Wister大鼠,体质量180-220 g,购自山东大学实验动物中心。将20只大鼠随机分为3组。正常血清组(10只),灌服0.9%氯化钠注射液;含药低剂量血清组(5只),每日灌服宁肾颗粒12 g·kg-1;含药高剂量血清组(5只),每日灌服宁肾颗粒24 g·kg-1。每日灌药2次,灌胃3日;第4日,2次服药时间间隔2 h;采血在末次给药后2 h后,采血前禁食12 h。采血后分离血清,56℃灭活30 min,-20℃保存,备用。
1.4 细胞培养
大鼠系膜细胞株(HBZY-1)购自武汉大学中国典型培养物保藏中心。MCs常规培养于含有10%小牛血清的DMEM完全培养液(含100 U·mL-1青霉素,100 μg·mL-1链霉素,3 mmol·L-1L-谷氨酰氨)中,置于37℃、5%CO2培养箱中培养,每2-3 日换培养液。在系膜细胞生长贴壁约80%时,经缓冲液冲洗2次,25 mg·L-1胰蛋白酶消化细胞后,悬浮细胞,常规传代。实验选用第4-5代传代对数生长期细胞。
1.5 细胞毒性试验
按照每孔总体积200 μL、细胞数4×103个的标准,接种MCs于96孔板。置37℃、5%CO2培养箱中培养24 h后,换成无血清DMEM培养液进行同步化培养24 h后,分4组换液。正常对照组(Con组):正常大鼠血清。LPS组:正常大鼠血清+LPS(10 μg·mL-1)。含药低剂量组(NSL组):含药低剂量血清+LPS(10 μg·mL-1)。含药高剂量组(NSH组):含药高剂量血清+LPS(10 μg·mL-1)。每孔200 μL,每组设5个复孔,继续培养48 h后,弃上清。用25 mg·L 1的胰蛋白酶消化细胞,取待测细胞悬液0.1 mL 加D-Hanks液0.8 mL及0.3%台盼兰0.1 mL,混悬后滴入血球计数板中,相差显微镜下计数细胞数,死细胞着色而活细胞不着色,计算活细胞比率(活细胞比率=活细胞数/总细胞数×100%)[2]。
1.6 MTT法检测MCs增殖情况
将MCs种于96孔板中,4×103细胞/孔,总体积200 μL,含有10%小牛血清的DMEM完全培养液中培养24 h,同步化24 h后分组,分组及干预方式同“细胞毒性试验”。每组设5个复孔,继续培养48 h。分别于培养结束前2 h加入MTT(四甲基偶氮唑蓝)20 μL/孔(5 mg·mL-1),继续37℃、5%CO2培养箱中培养2 h,弃上清后加入DMSO 150 μL,震荡10 min,酶标仪波长设定为570 nm,检测OD570。实验重复3次,均纳入统计。
1.7 流式细胞术检测MCs细胞凋亡率
将MCs种于培养皿中,5×104细胞/皿。24 h后镜下观察细胞生长良好,部分融合,换成无血清DMEM培养液以同步化。将同步化24 h后的细胞,分为4组(分组及干预方式同上),每组设3个复孔,培养48 h后。将细胞悬浮后收集到离心管中,1 000 r·min-1离心5 min。用PBS重悬浮,并按1:10比例加入细胞裂解液,室温轻振荡后,1 000 r·min-1离心5 min。去上清,用PBS打散细胞,加入500 μL Annexin V染色缓冲液重悬细胞,加入4 μL Annexin V FITC、4 uL PI,混匀。避光,室温反应10 min。上流式细胞仪分析。实验重复3次,均纳入统计。
1.8 Western bolt检测PDGF-BB蛋白表达
按照细胞数4×105个/孔的标准,接种MCs于6孔板中,分组及培养方法同“细胞毒性试验”中所述。每组设2个复孔。含药血清干预48 h后,收集各组细胞,加裂解液并超声碎裂后提取细胞总蛋白。按照BCA试剂盒说明书步骤,配置BCA工作液,设定标准空及样品孔并加样,37℃反应30 min,应用酶标仪检测 ,波长调至562 nm测得吸光度,拟合标准曲线,根据标准曲线计算样品蛋白浓度。每样本取总蛋白20 μg,加等量样本处理液,煮沸10 min,在SDS-PAGE胶上样 ,常规电泳、转膜,血小板源性生长 因 子-BB(Platelet-Derived Growth Factor-BB,PDGF-BB)、GAPDH分别为一抗,浓度为1:2000,4℃下反应,过夜。次日,洗膜3次后加入二抗,室温下反应2 h,洗膜3次。于暗室进行显色、曝光成像。利用图像分析系统扫描、分析胶片上条带的相对吸光度值(内参GAPDH的蛋白印记条带的吸光度值为相对值1)。实验重复3次,均纳入统计。
1.9 统计学处理
2 结果
2.1 细胞毒性试验
干预48h后,含药血清对细胞活力无影响,各组活细胞比率均在95%以上。
2.2 宁肾颗粒对LPS诱导MCs增殖的影响
与Con组(对照组)比较,干预48 h后,LPS组MCs增殖率明显提高( P<0.01)。与LPS组对比,NSL和NSH组MCs增殖率均明显降低(P<0.01),且与NSL组比较,NSH组MCs增殖进一步受到抑制。(P<0.01)如图1所示。
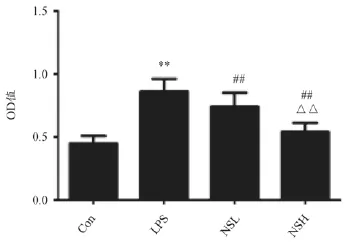
图1 干预48 h后MTT法检测各组OD值比较
2.3 宁肾颗粒对MCs凋亡率的影响
干预48 h后,与Con组相比,LPS组凋亡率明显降低(P<0.01)。与LPS组比较,NSH组凋亡率明显提高(P<0.05 ),而NSL组凋亡率无明显差异。如图2 所示。
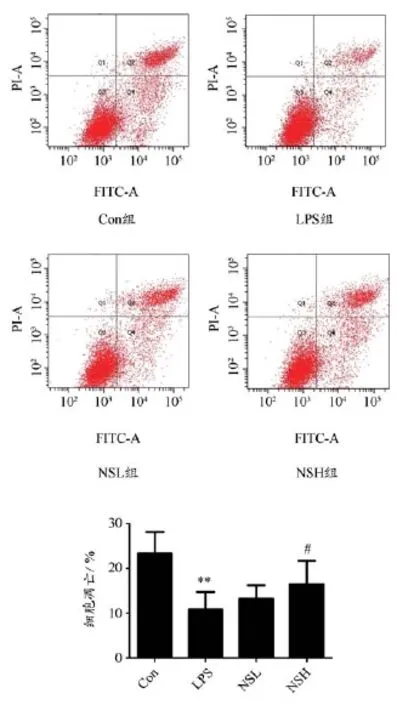
图2 干预48 h后各组凋亡率比较
2.4 宁肾颗粒对PDGF-BB蛋白表达的影响
干预48 h后,与Con组比较,LPS组PDGF-BB蛋白上调,差异具有统计学意义(P<0.01)。NSH组PDGF-BB蛋白表达较LPS组明显降低,差异具有统计学意义(P<0.01),而NSL组较LPS组无显著差异。且NSH组PDGF-BB蛋白表较NSL组明显降低(P<0.05)。如图3所示。

图3 干预48 h后各组PDGF-BB蛋白表达相对灰度
3 讨论
难治性肾病综合征是一种小儿常见病,在我国患病率亦呈快速增长趋势[3],常缠绵不愈,临床治疗棘手。本病可归入中医学“水肿”、“虚劳”的范畴。本课题组认为本虚标实是难治性肾病综合征的病机关键,以脾肾亏虚为本、湿热邪毒炽盛为标。故以“健脾益肾、清热利湿”为治则拟定宁肾颗粒。方中君药黄芪、仙茅、仙灵脾,功在温补脾肾;臣药白花蛇舌草、萆薢、益母草、生地,功在清热解毒、利水消肿;金樱子、覆盆子益肾固精是为佐药。全方攻补兼施、寒温并用,共奏健脾益肾、清热利湿之功。宁肾颗粒在临床上治疗难治性肾病综合征已取得一定疗效[4]。
MCs是肾小球内非常活跃的固有细胞,在生理状态下不发生明显的增殖活动,而在病理状态下,MCs过度增殖并分泌大量的细胞外基质及炎症因子,导致肾小球硬化,造成肾脏功能进行性损害[5-7]。因而有效地抑制MCs的增殖将会在很大程度上减缓慢性肾炎、肾小球硬化的进展[8]。LPS是革兰氏阴性菌细胞壁外膜的主要成分,可以引起免疫刺激的级联反应和机体的毒性病理生理活动,促进细胞因子的释放,是诱导MCs异常增殖的常用刺激物。在本实验中,应用LPS干预MCs后,MCs较正常对照组确有明显增殖。宁肾颗粒含药血清干预后,LPS诱导的大鼠MCs异常增殖得到有效抑制,且抑制率随药物剂量增加进一步提高。
细胞凋亡是机体是一种由基因控制的细胞自主性死亡方式。细胞凋亡能清除体内不需要的或有害的细胞,控制细胞数量,是维持自身稳定状态的一个重要机制。近年来,有研究资料显示MCs凋亡也是防止MCs过度增殖的重要机制,是肾小球增生性疾病进展得以控制或消除的方式之一[9,10]。本实验结果表明,高剂量的宁肾颗粒能显著提高MCs的凋亡率。
PDGF是目前已知多肽生长因子中最强的有丝分裂原之一,具有多生物学效应、参与多组织器官生理活动与病理损伤过程的重要细胞因子,其过度表达可导致多种疾病的产生。目前已知的PDGF家族成员,包括PDGF-A、B、C、D,它们都含有一个高度保守的PDGF/血管内皮生长因子同源结构域,通过二硫键连接形成同型或异型二聚体,其中PDGF-BB参与了多种肾病发生发展的病理过程[11-12]。它可以促进MCs增殖,并且还参与系膜细胞收缩、趋化、分泌细胞外基质以及分泌其他细胞因子的病理过程,从而可以进一步诱导肾脏损害[13-16]。有效抑制PDGF的过度表达、阻断其对MCs的异常刺激作用是有效防治肾病发展的重要环节[17,18]。本实验结果表明,大剂量的宁肾颗粒可以抑制PDGF的过度表达,这可能是宁肾颗粒能抑制MCs异常增殖的分子机制之一。
综上,宁肾颗粒可以抑制LPS诱导的大鼠MCs增殖、促进MCs凋亡,这可能与其抑制PDGF的过度表达有关。
1 Hughes J,Savill J S. Apoptosis in glomerulonephritis. Current opinion innephrology and hypertension,2005,14(4): 389-395.
2 Zu N,Li P,Li N,et al. Mechanism of saikosaponind in the regulation of rat mesangial cell proliferation and synthesis of extracellular matrix proteins. Biochem Cell Biol,2007,85(2): 169-174.
3 Zhang L,Wang F,Wang L,et al. Prevalence of chronic kidney disease in China: A cross-sectional survey. Lancet,2012,379(9818): 815-822.
4 赵林,李安源,王志学,等.宁肾颗粒治疗小儿难治性原发性肾病综合征疗效观察.中国中西医结合杂志,2009,29(8): 758-760.
5 Zoja C,Abbate M,Remuzzi G. Progression of renal injury toward interstitial inflammation and glomerular sclerosis is dependent on abnormal protein filtration. Nephrol Dial Transplant,2015,30(5): 706-712.
6 del Nogal M,Troyano N,Calleros L,et al. Hyperosmolarity induced by high glucose promotes senescence in human glomerular mesangial cells. Int J Biochem Cell Biol,2014,54(9): 98-110.
7 Miller C G,Pozzi A,Zent R,et al. Effects of high glucose on integrin activity and fibronectin matrix assembly by mesangial cells. Mol Biol Cell,2014,25(16): 2342-2350.
8 Kaur H,Chien A,Jialal I. Hyperglycemia induces Toll like receptor 4 expression and activity in mouse mesangial cells:relevance to diabetic nephropathy. Am J Physiol Renal Physiol,2012,303(8): F1145-F1150.
9 Duann P,Ho T Y,Desai B D,et al. Mesangial cell apoptosis induced by stimulation of the adenosine A3 receptor: Signaling and apoptotic events. J Invest Med,2005,53(1): 37-43.
10 Watson S,Cailhier J F,Hughes J,et al. Apoptosis and glomerulonephritis. Curr Dir Autoimmun,2006,9(2): 188-204.
11 Nakagawa H,Sasahara M.Immunohistochemical characterization of glomerular PDGF B-chain and PDGF beta-receptor expression in diabetic rats. Diabetes Res Clin Pract,2000,48(2): 87-98.
12 Kelly D J,Gilbert R E. Aminoguanidine ameliorates overexpression of prosclerotic growth factors and collagen deposition experimental diabetic in nephropathy. J Am Soc Nephrol,2001,12(10): 2098-2107.
13 Chaudhary N I,Roth G J,Hilberg F,et al. Inhibition of PDGF,VEGF and FGF signalling attenuates fibrosis. EurRespir J,2007,29(5): 976-985.
14 Distler J H,Jüngel A,Huber L C,et al. Imatinibmesylate reduces production of extracellular matrix and prevents development of experimental dermal fibrosis. Arthritis Rheum,2007,56(1): 311-322.
15 张伟栋,刘雨清,李洪利,等.肿瘤坏死因子和血小板源生长因子在人膜增生性肾小球肾炎中的表达.中国医药导报,2008,5(4)︰23-25.
16 Nakata S,Fujita N,Kitagawa Y,et al. Regulation of platelet-derived growth factor receptor activation by afadin through SHP-2: Implications for cellular morphology. J Biol Chem,2007,282(52): 37815-37825.
17 Floege J,Eitner F,Alpers C E. A new look at platelet-derived growth factor in renal disease. J Am SocNephrol,2008,19(1): 12-23.
18 Boor P,Ostendorf T,Floege J. PDGF and the progression of renal disease. Nephrol Dial Transplant,2014,29(2): i45-i54.
Effects of Ningshen Granule on the Proliferation and Apoptosis of Rats’ Glomerular Mesangial Cells Induced by LPS
Zhao lin,Li Anyuan,Qi Fanghua,Wang Zhixue,Mu Linmao
(Shandong Provincial Hospital Affiliated to Shandong University,Jinan 250021,China)
This study aimed to evaluate the effects of Ningshen granule on the proliferation and apoptosis of glomerular mesangial cells (MCs) induced by lipopolysaccharide (LPS),and the expression of platelet-derived growth factor-BB (PDGF-BB). The drug-contained serum of model rats were prepared and used for intervention of LPS-stimulated glomerular MCs. The proliferation of LPS-stimulated MCs was measured by the MTT assay. Cell apoptosis rate was detected by flow cytometry,while the expression of PDGF-BB protein was semi-quantified by western bolt. It was found that the proliferation of MCs was inhibited by the Ningshen granule-contained serum,while the apoptosis of LPS-stimulated MCs. Besides,the overexpression of PDGF-BB was reversed. It was concluded that Ningshen granule inhibited the proliferation and promoted the apoptosis of LPS-stimulated MCs of rats,which may connect with the inhibition of overexpression of PDGF-BB.
Ningshen granule,nephropathy,glomerular mesangial cells,apoptosis,PDGF-BB
10.11842/wst.2016.05.023
R2-03
A
(责任编辑:朱黎婷,责任译审:朱黎婷)
2016-02-17
修回日期:2016-03-29
* 山东省中医药管理局中医药科技发展计划课题(2007-124):宁肾颗粒对IgA肾病系膜细胞凋亡的影响及其机制,负责人:李安源。
** 通讯作者:李安源,主任医师,博士生导师,主要研究方向:小儿疾病的中西医结合临床与实验研究。

