意大利生菜组织培养体系的建立
邓 莹,罗 雯
(南昌师范学院生物系,江西南昌 330032)
意大利生菜组织培养体系的建立
邓 莹,罗 雯*
(南昌师范学院生物系,江西南昌 330032)
摘要[目的]建立意大利生菜组织培养体系。[方法]以意大利生菜(LactucasativaL. var.ramosaHort.)种子为试验材料,用不同有效氯含量(0、0.5%、1.0%、2.0%、4.0%)的漂白水灭菌,于MS培养基上培养无菌苗。取4~5 d苗龄的无菌幼苗子叶,在添加不同浓度激素的MS培养基上诱导愈伤组织,并进一步诱导生芽、生根,筛选最佳诱导激素配比及激素浓度。[结果]意大利生菜种子经有效氯含量1.0%的漂白水处理,于MS培养基上培养可获得意大利生菜无菌苗。无菌幼苗子叶在MS+0.5 mg/L 6-BA+0.20 mg/L NAA+30 g/L蔗糖+7 g/L琼脂的培养基上,可以得到理想的意大利生菜愈伤组织;在MS+0.25 mg/L 6-BA+0.20 mg/L NAA+30 g/L蔗糖+7 g/L琼脂的培养基上,最有利于意大利生菜愈伤组织不定芽的发生且对后期生根有良好的诱导作用。[结论]配合使用一定浓度的6-BA和NAA可有效建立意大利生菜组织培养再生体系,为进一步建立意大利生菜遗传转化体系奠定基础。
关键词意大利生菜;子叶;组织培养
生菜属于菊科Compostiae莴苣属Lactuca,是一种含有多种营养元素,不经加工即可食用的蔬菜[1]。同时,生菜组培再生率和转化率均较高,可以作为一种良好的植物生物反应器[2-3]。借助转基因技术,能将生菜开发成一种有利的功能性蔬菜[4]。转基因生菜最早于1987年获得,而建立高效的生菜转基因遗传转化体系的前提条件是建立生菜组织培养再生体系[5]。笔者以生长周期更短的意大利生菜(LactucasativaL.var.ramosaHort.),为试验材料,对其愈伤组织诱导和不定芽发生的最适激素配比进行了筛选,建立意大利生菜组织培养体系,为进一步建立意大利生菜遗传转化体系奠定基础。
1材料与方法
1.1材料意大利生菜种子广西横县子龙种业有限公司。
1.2试剂蓝月亮漂白水(有效氯含量4.0%);植物生长调节激素6-BA、NAA(国药集团化学试剂有限公司产品);MS培养基。
1.3方法
1.3.1无菌苗培养条件的筛选。将适量的意大利生菜种子用75%乙醇消毒30 s,无菌蒸馏水冲洗2次,每次3 min。将种子分别放入不同浓度的漂白水(有效氯含量分别为0、0.5%、1.0%、2.0%、4.0%)消毒15 min,再用无菌蒸馏水冲洗3次,每次3~4 min,沥干水分后点种于MS培养基上,于光照培养室中培养,温度(25±1)℃,光照强度2 000 lx,光照周期16 h/d,5 d后观察种子萌发情况。
1.3.2愈伤组织诱导条件的筛选。愈伤组织诱导培养基为MS基本培养基,添加30 g/L蔗糖,7 g/L琼脂及不同浓度配比的6-BA和NAA,pH 5.8,121 ℃灭菌30 min。6-BA浓度分别为0.1、0.2、0.3、0.4、0.5 mg/L,NAA浓度分别为0.05、0.10、0.15、0.20 mg/L。取苗龄5 d的生菜无菌苗,沿分生点处切取生菜的两片子叶,分别接种于附加不同浓度激素的愈伤组织诱导培养基上,叶片正面朝上,保证切口与培养基充分接触,于光照培养室中培养,温度(25±1)℃,光照强度2 000 lx,光照周期16 h/d,14 d后记录愈伤组织形成情况并统计其诱导率。
1.3.3愈伤组织分化产生不定芽的诱导条件筛选。挑选健康的愈伤组织从外植体上切下,转移至不定芽诱导培养基上。诱导培养基为MS基本培养基,添加30 g/L蔗糖,7 g/L琼脂及不同浓度配比的6-BA和NAA,pH 5.8,121 ℃灭菌30 min。6-BA浓度分别为0.15、0.25、0.35、0.45 mg/L,NAA浓度分别为0.10、0.15、0.20 mg/L。不定芽诱导在光照培养室中进行,温度(25±1)℃,光照强度2 000 lx,光照周期16 h/d,14 d后统计不定芽数目和诱导率。
1.3.4再生苗生根培养。将长势良好的再生芽接种于MS基本培养基上,于光照培养室中培养,温度(25±1)℃,光照强度2 000 lx,光照周期16 h/d。6~12 d后观察意大利生菜再生苗生根情况。
2结果与分析
2.1无菌苗培养条件由表1可知,意大利生菜种子萌发率随着漂白水有效氯含量的升高先升高后降低。当有效氯含量低于1.0%时,由于消毒不彻底,杂菌的污染也会抑制种子的萌发。当有效氯含量高于1.0%时,有效氯含量越高对种子萌发的抑制作用越明显。因此,使用有效氯含量为1.0%的漂白水处理种子,消毒效果良好且无杂菌生长,种子的萌发率最高(达10.7%)。
表1培养5 d后意大利生菜无菌苗生长情况
Table 1The growth of lettuce aseptic seedlings after 5 days of culture
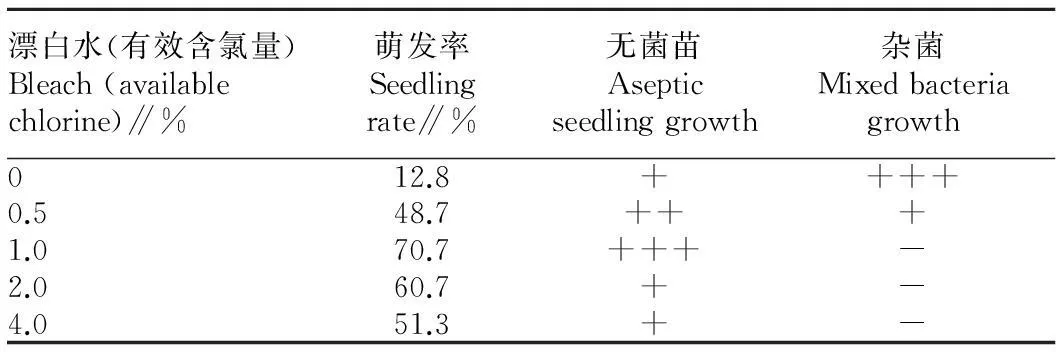
漂白水(有效含氯量)Bleach(availablechlorine)∥%萌发率Seedlingrate∥%无菌苗Asepticseedlinggrowth杂菌Mixedbacteriagrowth012.8++++0.548.7+++1.070.7+++-2.060.7+-4.051.3+-
注 :-无生长;+生长数量较少; ++生长数量中等 ;+++生长数量较多。
Note: -,+,++,+++ stand for no growth,small growth quantity,medium growth quantity and more growth quantity,respectively.
2.2愈伤组织诱导条件由表2可知,当6-BA浓度为0.5 mg/L、NAA浓度为0.20 mg/L时,愈伤组织出愈率达100.0%,愈伤组织高等发生,无褐化和玻璃化现象,是愈伤组织诱导的最适培养基。部分愈伤组织诱导结果见图1。
2.3愈伤组织分化产生不定芽的培养条件由表3可知,在所选浓度范围内,当6-BA和NAA浓度较低时,对不定芽的发生影响不大,发生频率均较低;而含有0.25 mg/L 6-BA和0.20 mg/L NAA的培养基,以及含有0.35 mg/L 6-BA和0.15 mg/L NAA的培养基对不定芽的诱导作用均较强,不定芽的发生频率高,生长迅速,无玻璃化发生,是不定芽分化诱导的最适培养基。部分不定芽分化诱导结果见图2。
表2不同浓度6-BA和NAA配比对意大利生菜愈伤组织诱导的影响
Table 2Effects of different concentrations of 6-BA and NAA ratio on lettuce callus
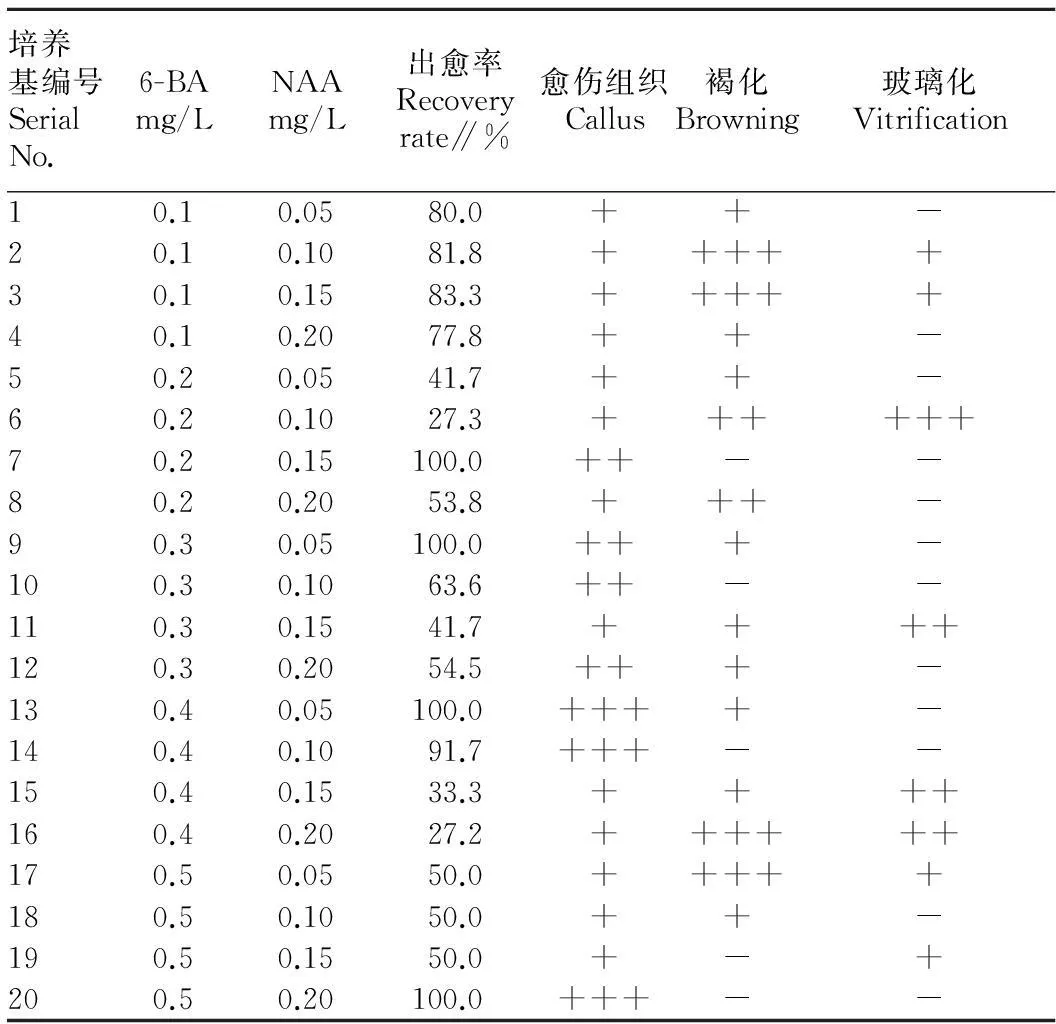
培养基编号SerialNo.6-BAmg/LNAAmg/L出愈率Recoveryrate∥%愈伤组织Callus褐化Browning玻璃化Vitrification10.10.0580.0++-20.10.1081.8+++++30.10.1583.3+++++40.10.2077.8++-50.20.0541.7++-60.20.1027.3++++++70.20.15100.0++--80.20.2053.8+++-90.30.05100.0+++-100.30.1063.6++--110.30.1541.7++++120.30.2054.5+++-130.40.05100.0++++-140.40.1091.7+++--150.40.1533.3++++160.40.2027.2++++++170.50.0550.0+++++180.50.1050.0++-190.50.1550.0+-+200.50.20100.0+++--
注:-不发生;+低等发生;++中等发生;+++高等发生。
Note:-,+,++ and +++ stand for no occurrence,low occurrence,medium occurrence and higher occurrence,respectively.
2.4再生苗生根培养条件在MS基本培养基上培养6~12 d后,生根较早、生根数量较多的是添加0.25 mg/L 6-BA和0.2 mg/L NAA培养基的诱导芽,其次是添加0.35 mg/L 6-BA和0.15 mg/L NAA培养基的诱导芽。说明前期芽的诱导培养基激素浓度对后期生根有一定影响。

图1 愈伤组织诱导结果Fig.1 The induction results of callus

培养基编号SerialNo.6-BAmg/LNAAmg/L不定芽Sprouting玻璃化Vitrification培养基编号SerialNo.6-BAmg/LNAAmg/L不定芽Sprouting玻璃化Vitrification10.150.10+-70.350.10+-20.150.15+-80.350.15+++-30.150.20+-90.350.20++40.250.10++-100.450.10+-50.250.15++110.450.15++-60.250.20+++-120.450.20+-
注:-不发生;+低等发生;++中等发生;+++高等发生。
Note:-,+,++ and +++ stand for no occurrence,low occurrence,medium occurrence and higher occurrence,respectively.

图2 不定芽诱导结果Fig.2 The induction results of adventitious buds
3结论与讨论
在植物基因转化方式中,以农杆菌介导的细胞核基因转化技术最为成熟。生菜属于菊科植物,是农杆菌的天然宿主。研究者对多种基因型生菜进行了诱导、分化及成苗最适条件研究。以散叶生菜大速生(LactucasativavarcapatataL.)子叶为试材,不同研究者获得的最适诱导激素浓度不同,赵吉强等[2]在附加0.10 mg/L 6-BA及0.05 mg/L NAA的MS培养基上获得了最佳诱导生芽效果;而其他研究者则分别在附加1.5 mg/L 6-BA及0.2 mg/L IAA或0.5 mg/L 6-BA及0.5 mg/L IAA的MS培养基上获得了最佳诱导生芽效果[1,3]。可见,在不同试验条件下,即便是同种基因型的生菜分化诱导的最适激素浓度也会有明显差异。与其他基因型生菜相比,意大利生菜具有生长周期短,一年可收获四季的优点。该研究以意大利生菜为试材,研究了愈伤组织诱导和不定芽发生的最佳条件,建立了意大利生菜组织培养再生体系,与其他研究获得的最佳诱导条件显著不同[5]。该研究表明,意大利生菜愈伤组织诱导激素条件为0.5 mg/L 6-BA及0.20 mg/L NAA;不定芽诱导激素条件为0.25 mg/L 6-BA和0.20 mg/L NAA。在此基础上,可进一步研究农杆菌介导叶盘法转化意大利生菜的最佳条件,为构建功能性生菜提供可行途径。
参考文献
[1] 朱春燕,雷建军,周浩,等.优化皱叶生菜高频率再生体系的研究[J].现代预防医学,2008,35(5):870-878.
[2] 赵吉强,李霞,李丽霞,等.生菜遗传转化受体系统的建立及鲑鱼降钙素基因的导入[J].烟台大学学报(自然科学与工程版),2004,17(2):116-121.
[3] 邓小莉,周岩,常景玲.生菜遗传转化体系的建立及转基因研究[J].云南植物研究, 2007,29(1):98-102.
[4] 刘思言,姚丹,关淑艳,等.生菜遗传转化受体体系的建立[J].吉林蔬菜,2011(6):98-99.

Establishment of Tissue Culture System ofLactucasativaL. var.ramosaHort.
DENG Ying,LUO Wen*(Biology Department,Nanchang Normal University,Nanchang,Jiangxi 330032)
Abstract[Objective] To establish the tissue culture system forLactucasativaL. var.ramosaHort. [Method]LactucasativaL. var.ramosaHort. seeds were disposed with different concentration javelle (0,0.5%,1.0%,2.0%,4.0%)for sterilization,and aseptic seedlings were cultured on MS medium. Taking cotyledons from the 4-5 days of seedlings as explants,the ideal sorts and concentrations of plant hormones were tested for induction of calluses,buds and roots seperately. [Result]LactucasativaL. var.ramosaHort. seeds were disposed with 1.0% available chlorine javelle and aseptic seedlings were gotten on MS culture medium. Taking cotyledons from the 4-5 days of seedlings as explants,the ideal calluses were induced and generated on the medium of MS medium supplied with 0.5 mg/L 6-BA,0.20 mg/L NAA,30 g/L sucrose and 7 g/L agar. The most in favor medium for bud differentiation from calluses were MS medium supplied with 0.25 mg/L 6-BA,0.20 mg/L NAA,30 g/L sucrose and 7 g/L agar,which was also beneficial for rooting subsequently. [Conclusion] The appropriate concentration of 6-BA and NAA was effective forLactucasativatissue culture,and lay a foundation for establishing geetic transformation system ofLactucaSativeL. var.ramosaHort.
Key wordsLactucasativaL. var.ramosaHort.; Cotyledon; Tissue culture
收稿日期2015-12-18
作者简介邓莹(1992- ),女,江西赣州人,本科生,专业:生物科学。*通讯作者,教授,博士,从事微生物学研究。
基金项目江西省自然科学基金项目(20151BAB205063)。
中图分类号S 636.2
文献标识码A
文章编号0517-6611(2016)02-181-03

