c-myc基因与急性髓性白血病的相关性研究
c-myc基因与急性髓性白血病的相关性研究
目的检测c-myc基因在急性髓性白血病(AML)不同临床阶段的表达情况, 探讨c-myc基因与AML的关系。方法20 例初诊AML患者作为初诊AML组, 16 例复发AML患者作为复发AML组, 10例外周血造血干细胞移植治疗的AML患者作为对照组。检测三组骨髓单个核细胞中c-myc基因的表达水平, 分析c-myc基因与AML不同临床阶段之间的关系。结果初诊AML组与复发AML组治疗前骨髓中单个核细胞的c-myc基因表达(1.12±0.26)、(0.97±0.18)高于对照组(0.27±0.08)(P<0.05);治疗后达CR患者骨髓中单个核细胞的c-myc基因表达(0.38±0.24)、(0.49±0.12)较治疗前下降(P<0.05);治疗后未达CR患者骨髓中单个核细胞的c-myc基因表达(0.91±0.23)、(1.02±0.25)高于对照组(P<0.05);复发AML组再诱导治疗后达CR患者骨髓中单个核细胞的c-myc基因表达(0.49±0.12)高于初诊AML组诱导治疗后达CR患者(0.38±0.24)和对照组(0.27±0.08)(P<0.05)。结论c-myc基因高表达可能是AML发生与复发的机制之一, 其表达水平在AML患者病程监测与预后判断中具有重要意义。
c-myc基因;急性髓性白血病;逆转录-聚合酶链反应;预后
急性白血病是因造血干细胞异常克隆性增生为表现的一类恶性肿瘤性疾病, 其主要病因在于各种因素导致造血干细胞失去往成熟血细胞分化的能力而停滞在细胞发育的某个阶段不断增殖。现阶段多项研究已证实特定的分子生物学异常对AML具有临床意义。c-myc基因是1982年Neel等[1]发现的一种癌基因, 具有刺激细胞增殖和凋亡的双向调节作用。近年来研究表明在多种肿瘤细胞中, c-myc基因存在异常表达[2,3]。本研究应用RT-PCR技术检测不同阶段的AML骨髓单个核细胞的c-myc基因表达水平, 探讨c-myc基因作为细胞生长周期的主要调控基因与AML的关系, 报告如下。
1 资料与方法
1.1 一般资料 选取 2012 年 1 月~2014 年 10 月江西省人民医院血液内科住院的初诊AML患者 20 例作为初诊AML组。根据FAB分型, M1型5例、M2型8例、M4型5例、M5型2例。男11例, 女9例, 平均年龄(37.4±5.6)岁。选取2012年 4月~2014 年 11 月该院复发AML患者 16 例作为复发AML组。根据FAB分型, M1型5例、M2型2例、M4型5例、M5型4例。男7例, 女9例, 平均年龄(32.2±7.6)岁。选取2010年1月~2014年5月该院外周血造血干细胞移植治疗的AML患者10例作为对照组。男3例, 女7例, 平均年龄(27.8±8.3)岁。研究对象均为染色体核型分析正常者,诊断符合《血液病诊断及疗效标准》[4]。三组一般资料比较差异无统计学意义(P>0.05), 具有可比性。
1.2 实验仪器与试剂 总RNA提取试剂为北京康为世纪生物科技有限公司生产;Taq DNA合成酶与美国Proega公司产品;M-MLV逆转录酶与缓冲液为美国Promega公司产品;c-myc基因与actin引物的PCR扩增引物由南京金斯瑞生物科技有限公司合成;PCR仪、紫外分光光度仪、低温离心机为美国 BIO-RAD公司生产;-80℃冰箱为Forma Scientific公司生产;水平电泳仪为英国Amersham Pharmarcia Biotech公司生产。
1.3 实验方法
1.3.1 标本提取 所有研究对象在无菌条件下抽取骨髓2 ml注入EDTA抗凝试管中, 用Hypague-Ficoll液密度梯度离心分离去除血清后计数, 获得的骨髓单个核细胞。取(1~2)×106个骨髓单个核细胞, PBS洗涤两遍后加1 ml Trizol液, -80℃保存。
1.3.2 mRNA制备 按照TRIZOL试剂盒说明书提取细胞总RNA, 应用微量核酸蛋白测定仪测定从各标本中提取RNA的OD260/OD280值, 并计算RNA溶液的浓度, 比值在1.8~2.0之间的标本进行逆转录反应。取RNA 2 μg采用逆转录-聚合酶链反应(RT-PCR)技术进行cDNA合成及反转录产品扩增, 并用β-actin作为参照, 引物序列为:c-myc基因:上游序列:5’-ACAGCAAACCTCCTCACAG-3’, 下游序列:5’-CGCAACAAGTCCTCTTCAG-3’, 扩增条带为403bp;β-actin:上游引物:5’-ATGGCACCGTCAAGGCTGAG-3’;下游引物:5’-GCAGTGATGGCATGGACTGT -3’;扩增条带为379bp。反应条件:95℃孵育10 min后; 以95℃孵育30 s, 退火至58℃孵育30 s, 72℃延伸30 s为1个循环, c-myc反应35个循环, β-actin反应25个循环, 扩增后72℃延伸10 min。反应产物4℃保存。
1.3.3 PCR产物分析 制备2%浓度的含溴化乙锭琼脂糖凝胶, 并取10 μl实验所得PCR产物和DNA MarkerІ上样至琼脂糖凝胶中, 120 V稳压电泳40 min后用拍照并应用Image J软件进行灰度值测定。结果判断以同时扩增的内参actin的表达强度为基准, c-myc的表达强度=c-myc基因灰度值/内参actin灰度值。
1.4 统计学方法 采用SPSS19.0统计学软件对数据进行统计分析。计量资料以均数±标准差(±s)表示, 采用t检验;计数资料采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
初诊AML组与复发AML组治疗前骨髓中单个核细胞的c-myc基因表达(1.12±0.26)、(0.97±0.18)高于对照组(0.27±0.08), 差异具有统计学意义 (P<0.05);治疗后达CR患者骨髓中单个核细胞的c-myc基因表达(0.38±0.24)、(0.49±0.12)较治疗前下降, 差异具有统计学意义 (P<0.05);治疗后未达CR患者骨髓中单个核细胞的c-myc基因表达(0.91±0.23)、(1.02±0.25)高于对照组, 差异具有统计学意义(P<0.05);复发AML组再诱导治疗后达CR患者骨髓中单个核细胞的c-myc基因表达(0.49±0.12)高于初诊AML组诱导治疗后达CR患者的(0.38±0.24)和对照组的(0.27±0.08), 差异具有统计学意义 (P<0.05)。见表1, 2。
表1 初诊AML组c-myc基因RT-PCR结果(±s)
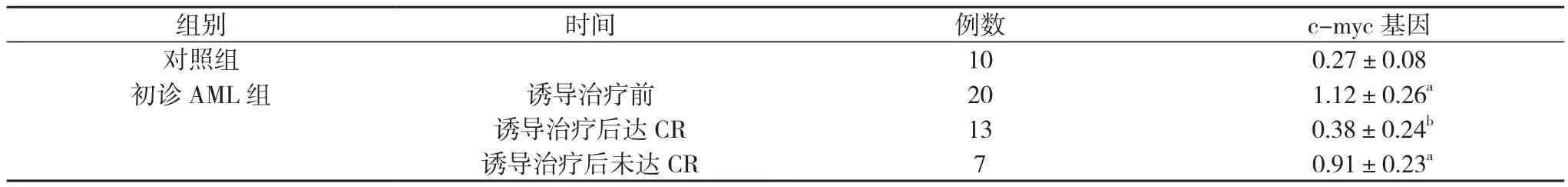
表1 初诊AML组c-myc基因RT-PCR结果(±s)
注:与对照组比较,aP<0.05;与治疗前比较,bP<0.05
组别 时间 例数 c-myc基因对照组 10 0.27±0.08初诊AML组 诱导治疗前 20 1.12±0.26a诱导治疗后达CR 13 0.38±0.24b诱导治疗后未达CR 7 0.91±0.23a
表2 复发AML组c-myc基因RT-PCR结果(±s)

表2 复发AML组c-myc基因RT-PCR结果(±s)
注:与对照组比较,aP<0.05;与治疗前比较,bP<0.05
组别 时间 例数 c-myc基因对照组 10 0.27±0.08复发AML组 再诱导治疗前 16 0.97±0.18a再诱导治疗后达CR 9 0.49±0.12b再诱导治疗后未达CR 7 1.02±0.25a
3 讨论
AML是一类造血干细胞异常克隆性增生为表现的恶性疾病, 可发生于各个年龄阶段, 是青少年与儿童最常见的恶性肿瘤之一。急性白血病是因造血干细胞异常克隆性增生为表现的一类恶性肿瘤性疾病, 其主要病因在于各种因素导致造血干细胞失去往成熟血细胞分化的能力而停滞在细胞发育的某个阶段不断增殖。目前的资料显示急性白血病约占肿瘤总发病率的3%左右。近年来得益于化疗方案与支持治疗的改进和干细胞移植技术的进展, AML的预后明显得到改善, CR率明显提高[5]。目前证实AML特定的分子生物学异常具有临床意义, 对于预后不良的分子生物学异常, 采取特定的靶向治疗, 是AML治疗进一步取得突破的一个重要方向。
c-myc基因是近年来医疗工作者研究最广泛的癌基因之一, 其定位于人染色体8q24, 由3个外显子组成, 属核内蛋白。c-myc基因通过其编码的c-Myc蛋白, 广泛作用于细胞生长、增殖、分化和凋亡等各个阶段[6,7], 是细胞生长周期重要的调控基因之一, 其异常表达与多种恶性肿瘤的发生有关[8-10]。Guo 等[11]研究发现经过c-myc基因敲除的小鼠出现明显的造血异常, 其有核细胞如中性粒细胞、单核细胞与淋巴细胞明显减少, 并伴有严重贫血和血小板增多, 证实了c-myc基因在髓系造血细胞分化中的作用。Delgado[12]等研究证实c-myc基因异常表达在白血病的发病和疾病进程中起着重要作用。
Rice等[13]运用染色体免疫沉淀启动基因阵列和基因表达谱分析相结合, 发现PLZF-RARa可促使小鼠造血干细胞的生长, 并抑制Dusp6和Cdkn2d, 同时诱导c-myc表达, 解释了c-myc基因在AML中表达增高的机制。陈萍等[14]发现AML与急性淋巴细胞白血病(ALL)的初诊患者, c-myc基因表达均明显高于健康对照, 且在AML初诊患者中, c-myc基因的表达与FAB分型无相关性, 而与初诊是外周血细胞数和骨髓中原始细胞比例呈正相关, 在诱导化疗后未达CR的患者明显高于CR组。
在本次研究使用RT-PCR半定量的实验方法, 结果显示, 初诊AML组与复发AML组治疗前骨髓中单个核细胞的c-myc基因表达(1.12±0.26)、(0.97±0.18)高于对照组(0.27±0.08), 差异具有统计学意义 (P<0.05);治疗后达CR患者骨髓中单个核细胞的c-myc基因表达(0.38±0.24)、(0.49±0.12)较治疗前下降, 差异具有统计学意义 (P<0.05);治疗后未达CR患者骨髓中单个核细胞的c-myc基因表达(0.91±0.23)、(1.02±0.25)高于对照组, 差异具有统计学意义(P<0.05);复发AML组再诱导治疗后达CR患者骨髓中单个核细胞的c-myc基因表达(0.49±0.12)高于初诊AML组诱导治疗后达CR患者(0.38±0.24)和对照组(0.27±0.08), 差异具有统计学意义 (P<0.05)。c-myc基因在急性髓性白血病初次诊断时和复发时的表达明显升高, 提示c-myc基因高表达可能是急性髓性白血病的发生与复发的机制之一。治疗后完全缓解者c-myc基因表达水平下降, 复发患者c-myc基因表达水平再次升高, 且复发患者经治疗缓解后其c-myc基因表达水平虽有所下降但仍高于对照组和初治患者缓解后c-myc基因表达水平, 提示 c-myc基因表达水平在急性髓性白血病患者病程监测与预后判断中具有重要意义。
Lin等[15]研究发现, c-myc基因抑制剂在临床研究中显现出良好的抗肿瘤效果。Roderick等[16]报道, 抑制c-myc基因能够阻止白血病的发生, 并改善常规治疗失败的急性T淋巴细胞白血病患者的预后。
综上所述, 随着医学研究的进一步开展, 采用针对抑制c-myc基因的治疗策略, 并动态监测AML患者的c-myc基因水平, 有可能改善AML患者的预后, 进一步提高AML患者的缓解率与治愈率。
[1]Neel BG, Jhanwar SC, Chaganti RSK, et al.Two human c-onc genes are located on the long arm of chromosome 8.Proc Natl Acad Sci, 1982, 79(24):7842-7846.
[2]Dang CV.c-Myc target genes involved in cell growth, apoptosis, and metabolism.Mol Cell Biol , 1999, 19(1):1-11.
[3]吴一飞, 李灼日.原癌基因c-Myc与恶性肿瘤.医学临床研究, 2008, 25(9):1698-1700.
[4]张之南, 沈悌.血液病诊断及疗效标准.第3版.北京:科学出版社, 2008: 232..
[5]沈志祥, 王建祥, 金洁.急性髓系白血病治疗专家共识.中华血液学杂志, 2010, 31(1):69-70.
[6]Cassimere EK, Pyndiah S, Sakamuro D.The c-MYC-interacting proapoptotic tumor suppressor BIN1 is a transcriptional target for E2F1 in response to DNA damage.Cell Death Differ, 2009, 16(12):1641-1653.
[7]Acehan D, Jiang X, Morgan DG, et al.Three-dimensional structure of the apoptosome: implications for assembly, procaspaseations for assembly, procaspase-9 binding, and activation.Mol Cell, 2002, 9(2):423-432.
[8]Malempati S, Tibbitts D, Cunningham M, et al.Aberrant stabilization of c-Myc protein in some lymphoblastic leukemias.Leukemia, 2006, 20(9):1572-1581.
[9]Scandurra M, Rossi D, Deambrogi C, et al.Genomic profiling of Richter's syndrome: recurrent lesions and differences with de novo, diffuse large B-cell lymphomas.Hematol Oncol, 2010, 28(2):62-67.
[10]毕慧, 王亚军, 何勤.急性白血病细胞C-myc基因表达的研究.白血病:淋巴瘤, 2003, 12(2):73-75.
[11]Guo Y, Niu C, Breslin P, et al.c-Myc-mediated control of cell fate in megakaryocyte-erythrocyte progenitors.Blood, 2009, 114(10): 2097-2106.
[12]Delgado MD, Albajar M, Gomez-Casares MT, et al.MYC oncogene in myeloid neoplasias.Clin Transl oncol, 2013, 15(2):87-94.
[13]Rice KL, Hormaeche I, Doulatov S, et al.Comprehensive genomic screens identify a role for PLZF-RARalpha as a positive regulator of cell proliferation via direct regulation of c-MYC.Blood, 2009, 114(27):5499-5511.
[14]陈萍, 丛雅琴, 王昭, 等.急性白血病患者垂体瘤转化基因和c-myc基因表达的研究.中华血液学杂志, 2005, 26(7):427-428.
[15]Lin CP, Liu JD, Chow JM, et al.Small-molecule c-Myc inhibitor, 10058-F4, inhibits proliferation, downregulates human telomerase reverse transcriptase and enhances chemosensitivity in human hepatocellular carcinoma cells.Anticancer Drugs, 2007, 18(2):161-170.
[16]Roderick JE, Tesell J, Shultz LD, et al.c-Myc inhibition prevents leukemia initiantion in mice and impairs the growth of relapsed and induction failure pediatric T-ALL cells.Blood, 2014, 123(7):1040-1050.
Research of correlation between c-myc gene and acute myeloid leukemia
WEI Yu-jing, PAN Jie, LIU Ting-ting, et al.
School of Basic Medicine, Wuhan University, Wuhan 430071, China
ObjectiveTo detect expression of c-myc gene in different clinical stages of acute myeloid leukemia (AML), and to investigate relationship between c-myc gene and AML.MethodsThere were 20 preliminarily diagnosed AML patients as preliminarily diagnosed AML group, 16 recurrent AML patients as recurrent AML group, and 10 AML patients in peripheral blood stem cell transplantation treatment as control group.Expression levels of c-myc gene in bone marrow mononuclear cells were detected in all three groups, and their relationship between c-myc gene and different clinical stages of AML were analyzed.ResultsThe preliminarily diagnosed AML group and the recurrent AML group all had higher expression of c-myc gene in bone marrow mononuclear cells as (1.12±0.26) and (0.97±0.18) than (0.27±0.08) in the control group (P<0.05).Expression of c-myc gene in bone marrow mononuclear cells was lower as (0.38±0.24) in complete remission (CR) cases after treatment than (0.49±0.12) in those before treatment (P<0.05).They had higher expression of c-myc gene in bone marrow mononuclear cells as (0.91±0.23) and (1.02±0.25) in non-CR cases after treatment than the control group (P<0.05).The recurrent AML group had higher expression of c-myc gene in bone marrow mononuclear cells as (0.49±0.12) in CR cases after inductive treatment than (0.38±0.24) of CR cases in the preliminarily diagnosed AML group after inductive treatment and (0.27±0.08) of the control group (P<0.05).ConclusionHigh expression of c-myc gene may be one of mechanisms of occurrence and recurrence of AML, and it contains important significance in disease monitoring and prognosis judgment for AML patients.
c-myc gene; Acute myeloid leukemia; Reverse transcription-polymerase chain reaction; Prognosis
10.14164/j.cnki.cn11-5581/r.2016.15.001
2016-05-17]
430071 武汉大学基础医学院(魏宇靖);江西省人民医院血液科(魏宇靖 潘婕 刘婷婷 柯波 万才水 程洪波)

