女性尖锐湿疣和宫颈上皮内瘤变HPV16型E2、E6、E7基因突变及E6、E7抗原表达
黄灵,潘超,廉成翔,李晓霞,王官清,
(1.福建医科大学协和临床医学院,福州350001;2.厦门大学附属中山医院,厦门361004;3.上海交通大学附属第一人民医院,上海201620)
·论著·
女性尖锐湿疣和宫颈上皮内瘤变HPV16型E2、E6、E7基因突变及E6、E7抗原表达
黄灵1,潘超2,廉成翔2,李晓霞3,王官清2,3
(1.福建医科大学协和临床医学院,福州350001;2.厦门大学附属中山医院,厦门361004;3.上海交通大学附属第一人民医院,上海201620)
目的研究女性尖锐湿疣(CA)和宫颈上皮内瘤变(CIN)中人乳头瘤病毒(HPV)亚型分布,以及高危型HPV16的E2、E6、E7基因突变及致癌抗原E6、E7表达。方法从24例女性CA、11例2级CIN(CIN2)和23例3级CIN(CIN3)共58份石蜡包埋组织中提取HPV基因组DNA,用PCR-膜杂交法检测HPV亚型,DNA测序法检测HPV16型E2、E6、E7基因突变,免疫组化S-P法检测HPV16型E6、E7抗原表达。结果女性CA、CIN2和CIN3患者58份标本中共检出10个HPV亚型,高危型HPV检出率分别为20.8%、45.5%和60.9%,HPV16型检出率分别为12.5%、18.2%和34.8%。24例女性CA中高危型和低危型HPV检出率为20.8%和70.8%,宫颈CA高危型HPV检出率60.0%。HPV16型E2、E6、E7基因分别检出10、4和4个突变位点。首次在1例女性外阴CA和3例CIN3中一致检出HPV16型E2基因9个突变位点。HPV16型E6抗原在CA、CIN2和CIN3均有表达,但E7抗原仅在CIN3表达。结论女性宫颈CA和CIN多为高危型HPV感染,女性外阴CA的HPV16型E2基因突变可能与CIN3发生有一定关联。
人乳头瘤病毒;亚型;致癌抗原;基因突变
人乳头瘤病毒(Human papillomavirus,HPV)为小环状双链DNA病毒,对人体皮肤和黏膜有特殊亲和力。HPV基因组DNA长7 905 bp,由早期基因区、晚期基因区和长调控区组成。HPV早期基因包括E1、E2、E3、E4、E5、E6、E7和E8,分别编码E1、E2、E4、E5、E6和E7共6个蛋白(绝大多数HPV亚型不表达E3和E8)。其中,E2调节病毒DNA转录和复制、E6和E7与病毒感染细胞转化和致瘤性有关[1]。HPV E6使P53泛素化后降解,E7使E2F亚型转化因子从pRb中释放而致G1/S期转化活化、细胞周期进程异常,从而诱发肿瘤形成[2]。根据HPV在恶性肿瘤发生中的潜在作用,分为高危型(HRHPV,含HPVs 16、18、31、33、35、58等)、可能高危型(PR-HPV,含HPVs 26、53、66、68、73、82等)和低危型(LR-HPV,含HPVs 6、11、42、43等)。为探讨女性尖锐湿疣(CA)和高级别宫颈上皮内瘤变(CIN)中高危型HPV16基因突变与致癌抗原表达间关系,笔者分析了女性CA、2级CIN(CIN2)和3级CIN(CIN3)中HPV亚型分布,以及高危型HPV16型E2、E6、E7基因突变和E6、E7抗原表达,报告如下。
1 材料与方法
1.1 病例资料 从厦门大学附属中山医院病理科2007—2013年外检标本中收集24例女性CA、11例CIN2和23例CIN3的石蜡包埋组织共58份。24例女性CA年龄19~58岁(平均32岁);11例CIN2年龄27~51岁(平均41岁);23例CIN3年龄31~65岁(平均46岁)。所有病例病理诊断经2位病理科主任医师复核确定。
1.2 HPV基因分型 HPV亚型检测采用PCR-膜杂交法。切取8~10 μm厚石蜡切片5~8张,按DNA提取试剂盒(德国QIAGEN公司产品)操作说明提取HPV全基因组DNA后置4℃冰箱备用。HPV亚型检测试剂盒为深圳凯普生物技术有限公司产品,可检测HPVs 6、11、16、18、31、33、35、39、42、43、44、45、51、52、53、56、58、59、66、68和cp8304共21个亚型。PCR反应体系(25 μL):PCR mix(含HPV分型引物)23.25 μL、Taq DNA聚合酶0.75 μL、待检DNA 1.00 μL。PCR反应条件:95℃预变性9 min后,95℃20 s、55℃30 s和72℃30 s共40个循环,72℃延伸5 min。PCR产物经95℃变性5 min后立即置冰浴2 min,加杂交液杂交10 min,800 μL杂交液洗膜3次,分别加500 μL封阻液做预封阻和封阻各5 min,加500 μL酶标液3.5 min,用800 μL溶液A清洗4次,500 μL显色液显色3~5 min,用800 μL溶液B清洗3次,用蒸馏水清洗晾干后读取结果。
1.3 基因测序 以野生型HPV基因组(GenBank NC001526)为模板设计HPV16型E2、E6、E7基因测序引物,见表1。HPV测序PCR反应体系(25 μL):10×Buffer 2.5 μL、MgCl22.0 μL、dNTPs 0.2 μL、上下游引物各0.1 μL、H2O 14.35 μL、Taq DNA聚合酶0.75 μL和目的DNA模板5 μL。PCR反应条件:95℃预变性9 min,95℃20 s、55℃30 s和72℃30 s共40个循环,72℃延伸5 min。HPV DNA测序由上海英骏生物技术有限公司广州分公司完成。HPV DNA测序结果用BLAST软件与野生型HPV序列(GenBank NC001526)比对。
1.4 免疫组化染色 HPV16型E6和E7抗原检测采用链霉亲和素-过氧化酶法(S-P)免疫组化染色。主要步骤:石蜡切片经二甲苯脱蜡、梯度酒精水化,置柠檬酸抗原修复液(福州迈新生物技术有限公司产品)95℃~99℃修复抗原20 min,3%过氧化氢处理10 min阻断内源性过氧化酶,5%胎牛血清封闭10 min,加1∶100兔抗HPV16型E6 IgG抗体(美国Abbiotec公司产品)或1∶1 500鼠抗HPV16型E7 IgG抗体(英国Abcam公司产品)4℃冰箱过夜,PBS洗涤后加辣根过氧化物酶标记抗兔或抗鼠IgG抗体(武汉博士德公司产品)37℃孵育30 min,PBS洗涤后加DAB显色液显色约3 min,显微镜下观察染色结果。以凹空细胞、核分裂细胞或异形细胞的胞浆、胞核出现褐色颗粒为阳性,否则为阴性。以已知HPV16型E6或E7阳性的肺泡细胞癌做阳性对照、PBS替代一抗做空白对照。

表1 HPV16测序引物对*
2 结果
2.1 HPV基因分型 女性CA、CIN2和CIN3共58份标本中检出10个HPV亚型,其中HPV检出率分别为91.7%(22/24)、45.5%(5/11)和60.9%(14/23),HR-HPV检出率分别为20.8%(5/24)、45.5%(5/11)和60.9%(14/23),HPV16型检出率分别为12.5%(3/ 24)、18.2%(2/11)和34.8%(8/23),见表2。24例女性CA的HR-HPV、PR-HPV和LR-HPV检出率分别为20.8%(5/24)、0.0%(0/24)和70.8%(17/24),宫颈CA中HR-HPV检出率60.0%。CIN3中HRHPV和HPV16型检出率均略高于CIN2,但差异无统计学意义。
2.2 HPV16型E2、E6、E7基因突变 HPV16型DNA阳性的13份标本中1份CA和3份CIN3完成HPV16型E2、E6、E7基因测序。结果:HPV16型E2、E6、E7基因分别检出10、4和4个突变位点,见表2。其中2例CIN3中同时检出HPV16型E2、E6和E7基因突变位点。HPV16型E2基因置换突变中,G2827A(Asp→Asn)、C3158A(Thr→Lys)、G3248A(Arg→Gln)、T3383C(Ile→Thr)、C3409T(Pro→Ser)、G3448A(Glu→Lys)、C3683A(Thr→Lys)和C3786A(Asp→Gln)为错义突变,A2925G(Gln→Gln)和T3523C(Leu→Leu)为同义突变。1例女性外阴CA中检出了除A2925G(Gln→Gln)之外的HPV16型E2基因其余9个置换突变位点,在CA中检出HPV16型E2基因突变位点未见文献报道。而且,这些突变位点还分别在3例CIN3中检出,见图1。HPV16型E6基因G94A置换突变位于起始密码子之前并导致一个调节氨基酸改变[3],G132T(Arg→Ile)、T178G/A(Asp→Glu)和 C278G(Pro→Ala)为错义突变,其中G132T(Arg→Ile)和C278G(Pro→Ala)突变位点未见文献报道。HPV16型E7基因A647G(Asn→Ser)为错义突变,G666A(Glu→Glu)、T843C(Cys→Cys)和T846(Ser→Ser)为同义突变。
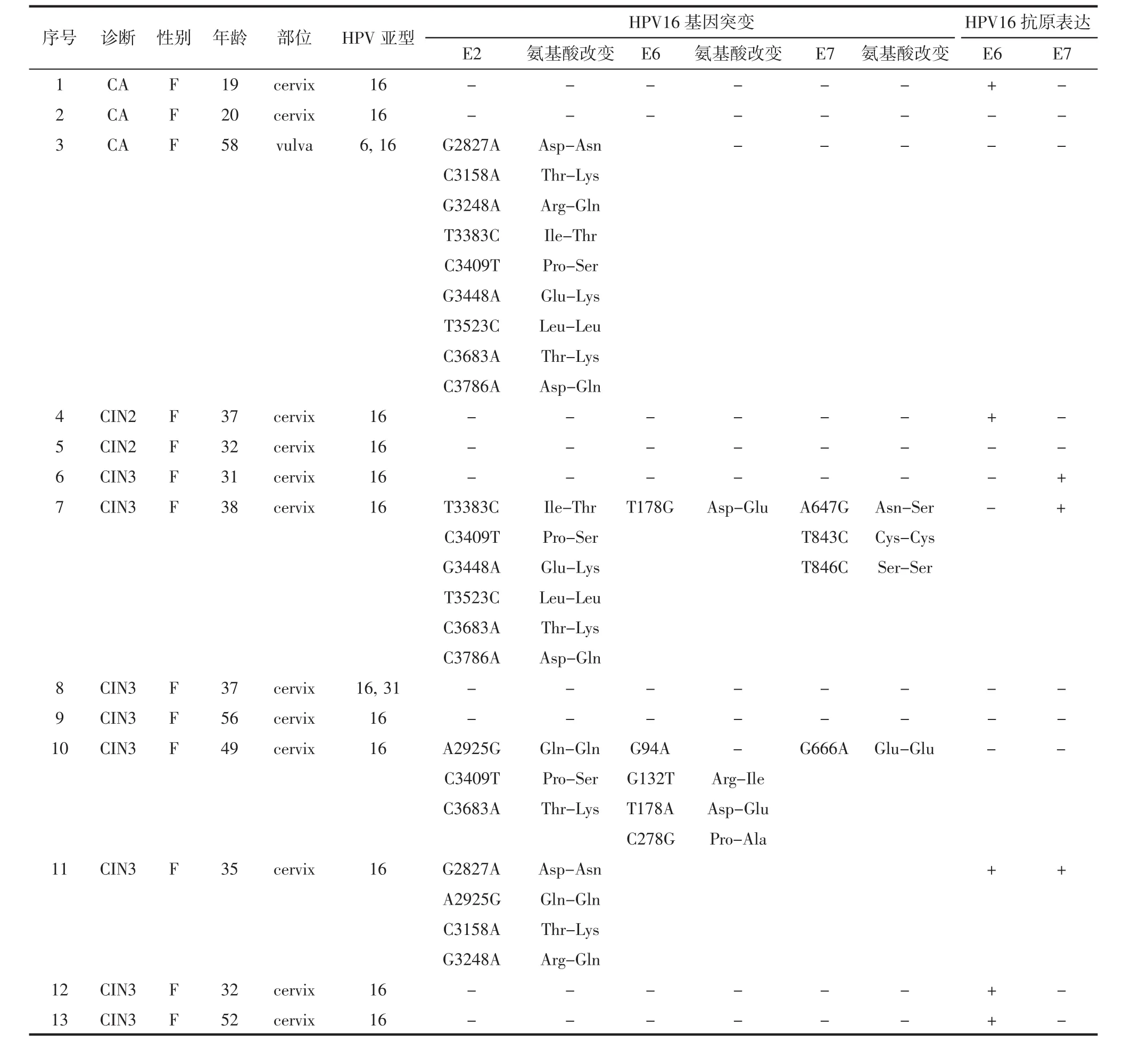
表2 CA和CIN中HPV16型E2、E6、E7基因突变及E6、E7抗原表达

图1 CA和CIN3中HPV16 E2基因部分位点与GenBank对比
2.3 HPV16型E6、E7抗原表达 HPV16型E6抗原呈细胞浆着色,E7抗原呈细胞核着色,见图2。HPV16型DNA阳性的13份标本中,HPV16型E6抗原分别在1例CA、1例CIN2和3例CIN3中表达,但HPV16型E7抗原仅在3例CIN3中表达,其中1例呈HPV16型E6和E7抗原共表达,表达HPV16型E7抗原的2例CIN3合并E2和E6/E7基因突变,见表2。
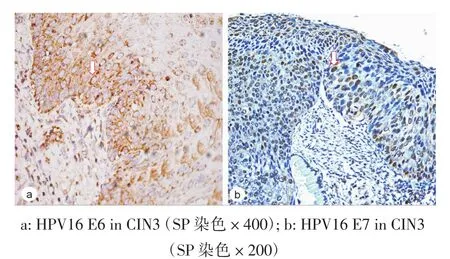
图2 CIN3中HPV16型E6和E7抗原表达
3 讨论
本研究24例女性CA中HPV、HR-HPV和HPV16型检出率分别达91.7%、20.8%和12.5%,且宫颈CA中HR-HPV检出率达60.0%,进一步提示女性CA存在HR-HPV和LR-HPV混合感染,对女性尤其是宫颈CA进行HR-HPV检测有助于预估癌变风险,并为早期干预治疗提供实验依据。但本研究中CA的HR-HPV检出率低于文献报道的34.9%[4],可能与所用标本为福尔马林固定-石蜡包埋的陈旧活检组织有关。在临床实际工作中,活检标本在固定过程中受福尔马林固定液浓度、固定时间,蜡块存放时间等因素影响,使HPV DNA完整性可能受损,从而增加PCR检测难度。
既往研究发现,CIN发生与某些特定型别HPV有密切关系,尤以HPV16型或HPV18型感染者持续时间更长、进展更快[5]。本研究在11例CIN2和23例 CIN3中检出包括 HPV16、HPV31、HPV35、HPV51等HR-HPV,但以HPV16型为主。因此,对CIN患者进行HPV尤其HR-HPV型别检测对于CIN治疗方法选择、预后评估等具有重要意义。本研究所有病例均未检出HPV18,原因尚不明。
宫颈CA中HR-HPV某些基因突变被认为是CIN发生的重要因素之一,因此分析CA和CIN患者HR-HPV基因突变是早期筛查宫颈肿瘤及预后判断的重要手段之一[6]。本研究在女性CA、CIN2和CIN3的HPV16型E2、E6和E7基因中分别检出10、4和4个碱基置换突变位点,首次在1例女性外阴CA和3例CIN3中一致检出HPV16型E2基因多位点突变,包括错义突变G2827A(Asp→Asn)、C3158A(Thr→Lys)、G3248A(Arg→Gln)、T3383C(Ile→Thr)、C3409T(Pro→Ser)、G3448A(Glu→Lys)、C3683A(Thr→Lys)和无义突变C3786A(Asp→Gln)、T3523C(Leu→Leu),提示女性非宫颈部位CA的HPV16型E2基因突变与CIN3发生可能存在一定关联性。但该例CA与3例CIN3非同一患者,且样本数量有限,非宫颈部位CA的HPV16型E2基因突变与CIN3发生的关系尚待进一步分析。此外,2例CIN3的HPV16型E2基因还检出一个无义突变A2925G(Gln→Gln),意义尚不明。HPV16型E6和E7基因突变被认为是CIN发生的另一重要因素,其E6和/或E7抗原表达可做为宫颈恶性肿瘤重要的预测指标之一[3]。本研究在2例CIN3的HPV16型E6基因中检出G94A、G132T(Arg→Ile)、T178G/A(Asp→Glu)和C278G(Pro→Ala)突变位点,E7基因中检出A647G(Asn→Ser)、G666A(Glu→Glu)、T843C(Cys→Cys)和T846C(Ser→Ser)突变位点。HPV16型E6基因起始密码之前的G94A置换突变导致一个调节氨基酸改变[3],HPV16型E6基因T178G/A(Asp→Glu)、E7基因A647G(Asn→Ser)和T846C(Ser→Ser)置换突变为高频率突变位点,与宫颈癌的发生和发展有高度相关性[7-8]。本研究在所检测的CIN3患者中HPV16型E6和E7基因也存在上述突变,但E6基因G132T(Arg→Ile)和C278G(Pro→Ala)置换突变未见文献报道,是否为E6基因单核苷多态性(SNP)位点尚待研究。HPV16型E6和E7抗原使HPV与感染上皮一起复制和分化,干扰机体免疫反应、参与宿主免疫逃逸[9]。本研究结果显示,HPV16型E6抗原在女性CA、CIN2和CIN3均有表达,但E7抗原仅表达于CIN3,是否提示HPV16型E7抗原可作为高级别CIN恶性指标尚需更多病例研究。
需要指出的是,本研究首次在女性非宫颈部位CA和CIN3中一致检出HPV16型E2基因多位点置换突变,并证实文献所报道的CIN3中存在HPV16型E6基因起始密码前G94A置换突变、E6基因T178G/A(Asp→Glu)置换突变和E7基因A647G(Asn→Ser)、T846C(Ser→Ser)置换突变,提示HR-HPV检测、HPV16型E2、E6、E7基因突变和E6、E7抗原表达监测对宫颈CA和CIN3患者预后评估等具有重要意义。但因本研究病例数不多,福尔马林固定石蜡包埋组织对分析结果有一定影响,尚有必要收集新鲜CA和CIN组织做进一步分析。
[1] Gagnon D,Joubert S,Senechal H,et al.Proteasomal degradation of the papillomavirus E2 protein is inhibited by overexpression of bromodomain-containing protein 4[J].J Virol,2009,83:4127-4139.
[2] Mii S,Niiyama S,Takasu H,et al.Detection of human papillomavirus type 16 in Bowen’s carcinoma of toe[J].Int J Dermatol, 2012,51:804-808.
[3] Ding T,Wang X,Ye F,et al.Distribution of human papillomavirus 16 E6/E7 variants in cervical cancer and intraepithelial neoplasia in Chinese women[J].Int J Gynecol Cancer,2010,20:1391-1398.
[4] Sturegard E,Johanna H,Ekstrom J,et al.Human papillomavirus typing in reporting of condyloma[J].Sex Transm Dis,2013,40:123-129.
[5] Grce M,Mravak-Stipetic M.Human papillomavirus-associatied disease[J].Clin Dermatol,2014,32:253-258.
[6] Goodman A.HPV testing as a screen for cervical cancer[J].Br Med J,2015,350:h2372.
[7] 张帆,丁晓华,蔡红兵,等.人乳头瘤病毒16型转化基因在不同阶段宫颈上皮病变组织中的分布及基因变异特点[J].中华肿瘤学杂志,2010,32(2):107-110.
[8] Yang L,Yang H,Wu K,et al.Prevalence of HPV and variation of HPV16/HPV18 E6/E7 genes in cervical cancer in women in South West China[J].J Med Virol,2014,86:1926-1936.
[9] Nees M,Geoghegan JM,Munson P,et al.Human papillomavirus type 16 E6 and E7 proteins inhibit differentiation-dependent expression oftransforming growth factor-beta2 in cervical keratinocytes[J].Cancer Res,2000,60:4289-4298.
Analysis on E2,E6,E7 Gene Mutations and Oncogenic E6,E7 Antigen Expressions of HPV 16 in Women Patients with CA and Cervical Intraepithelial Neoplasia
Huang Ling1,Pan Chao2,Lian Chengxiang2,Li Xiaoxia3,Wang Guanqing2,3
1.Fujian Medical University Union Hospital,Fuzhou 350001,China;2.Zhongshan Hospital of Xiamen University,Xiamen 361004,China;3.Shanghai General Hospital,Shanghai Jiaotong University,Shanghai 201620,China
ObjectiveIn order to analyze subtypes of human papillomavirus (HPV)in women patients with condyloma acuminatum (CA)and cervical intraepithelial neoplasia(CIN),as well as mutations of E2,E6,E7 genes and expressions of oncogenic E6,E7 antigens of the high-risk subtype HPV16.MethodsHPV genomic DNAs were extracted from 58 formalin-fixed paraffin-embedded biopsied tissues from 24 women patients with CA,11 patients with CIN grade 2(CIN2)and 23 patients with CIN grade 3 (CIN3).HPV subtypes were tested with PCR-membrane in situ hybridization assay.Mutations in E2,E6 and E7 genes of high-risk HPV16 were assayed by DNA sequencing and then compared with wild type of HPV16 in GenBank.Oncogenic E6 and E7 antigens of HPV16 were immunohistochemically stained with a streptavidin-peroxidase(SP)method.ResultsA total of ten subtypes of HPV were detected in women patients with CA,CIN2 and CIN3.Among which,high-risk subtypes were detected in 20.8%of CA,45.5%of CIN2 and 60.9%of CIN3,respectively.HPV16 was detected in 12.5%of CA,18.2%of CIN2 and 34.8%of CIN3,respectively.Both high-risk(20.8%)and low-risk(70.8%)of HPV subtypes were detected in women patients with CA,and high-risk subtypes were detected in 60.0%of lesions on cervix. There were totally 10,4 and 4 mutations detected in E2,E6 and E7 genes of HPV16.Nine consistent substitution mutations in E2 gene of HPV16 were detected for the first time in both vulvar lesion of a woman patient with CA and cervical lesions of three patients with CIN3.HPV16 E6 antigens were expressed in CA,CIN2 and CIN3,whereas HPV16 E7 antigens were expressed only in CIN3.ConclusionCA on cervix and CIN were most commonly infected with high-risk subtypes of HPV. Mutations in E2 gene of HPV16 in women vulva CA lesion might have a link to the pathogenesis of CIN3.
Human papillomavirus;Subtype;Oncogene;Gene mutation
R752.5+4
A
1672-0709(2016)06-0325-06
2016-03-21)
厦门市科技计划(3502Z20134012)
王官清,E-mail:guanqingwang@hotmail.com

