青藤碱对兔膝骨关节炎模型软骨及滑膜血管内皮生长因子及神经生长因子表达的影响
郑洁 王瑞辉 寇久社 罗浩
摘要:目的 观察青藤碱关节腔注射对兔膝骨关节炎模型软骨及滑膜血管内皮生长因子(VEGF)和神经生长因子(NGF)表达的影响,探讨其相关机制。方法 采用木瓜蛋白酶关节腔注射法诱导膝骨关节炎模型。40只新西兰大白兔随机分为空白组、模型组、透明质酸钠组和青藤碱组,空白组不予任何处理,模型组、透明质酸钠组和青藤碱组分别给予生理盐水、玻璃酸钠注射液和正清风痛宁注射液干预30 d,免疫组化检测兔关节软骨及滑膜VEGF、NGF的表达。结果 与空白组比较,模型组软骨及滑膜VEGF、NGF表达显著升高(P<0.01);与模型组比较,青藤碱组软骨及滑膜VEGF、NGF表达显著降低(P<0.05,P<0.01);青藤碱组软骨及滑膜VEGF、NGF表达低于透明质酸钠组(P<0.05,P<0.01)。结论 青藤碱膝关节腔注射可下调VEGF和NGF在膝骨关节炎兔关节软骨及滑膜的表达。
关键词:青藤碱;骨关节炎;血管内皮生长因子;神经生长因子;兔
DOI:10.3969/j.issn.1005-5304.2016.03.011
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2016)03-0038-04
Abstract: Objective To observe the effects of intra-articular injection of sinomenine on the expressions of vascular endothelial growth factor (VEGF) and nerve growth factor (NGF) in articular cartilage and synovium of rabbit knee osteoarthritis models; To discuss its mechanism of action. Methods Totally 40 New Zealand white rabbits were randomly divided into 4 groups: control group, model group, hyaluronate group and sinomenine group. Model group, hyaluronate group and sinomenine group established knee osteoarthritis model by using intra-articular injection of papain enzyme and were treated with saline, sodium hyaluronate and sinomenine respectively for 30 d, except for the control group. After treatment, method of immunohistochemistry was used to detect the expressions of VEGF and NGF in rabbit articular cartilage and synovium. Results Compared with the control group, the expressions of VEGF and NGF in articular cartilage and synovium of model group significantly increased (P<0.01); compared with the model group, the expressions of VEGF and NGF in articular cartilage and synovium of sinomenine group significantly decreased (P<0.05, P<0.01); the expressions of VEGF and NGF in articular cartilage and synovium in sinomenine group were lower than hyaluronate group (P<0.05, P<0.01). Conclusion Intra-articular injection of sinomenine can down-regulate the expressions of VEGF and NGF in articular cartilage and synovium of rabbit knee osteoarthritis.
Key words: sinomenine; osteoarthritis; vascular endothelial growth factor; nerve growth factor; rabbits
血管生成对于组织的生长、发育、再生循环及修复等生理过程极为重要,在一些疾病的病理改变中也发挥了不可忽视的作用。近年来发现,组织血管生成参与了骨关节炎(osteoarthritis,OA)病理进程,与OA关节软骨退变及关节疼痛密切相关。膝骨关节炎(knee osteoarthritis,KOA)患者骨赘、关节软骨、滑膜及半月板等结构均有血管生成或新生血管增多。血管生成与神经生长是一个紧密联系的过程,OA关节骨软骨连接处、骨赘及半月板内新生血管形成的同时还伴随着感觉神经的生长,这是造成关节疼痛的一个不可忽视的重要因素,近年来逐渐受到关注。青藤碱是从青风藤中提取的一种生物碱,具有镇痛、抗炎、调节免疫等作用。临床观察发现青藤碱对改善OA疼痛症状具有明显作用[1]。我们前期实验研究发现,青藤碱关节腔注射可缓解KOA兔滑膜炎性反应,降低关节液软骨降解标志物含量,对软骨具有保护作用[2]。本实验观察青藤碱关节腔注射对KOA兔关节软骨及滑膜组织中促血管生成因子血管内皮生长因子(VEGF)和神经生长因子(NGF)表达的影响,进一步探讨青藤碱缓解OA关节痛及软骨保护作用的机制。
1 实验材料
1.1 动物
新西兰大白兔40只,雌雄各半,4~6月龄,体质量1.8~2.2 kg,西安交通大学医学院实验动物中心,合格证号SCXK(陕)2008-008。单笼、标准饲料喂养,室温20~25 ℃,相对湿度45%~60%,每日正常光照,空气流通,自由摄食、饮水。
1.2 药物
正清风痛宁注射液,湖南正清制药集团股份有限公司,批号1304402-003;玻璃酸钠注射液,山东博士伦福瑞达制药有限公司,批号130308011。
1.3 主要试剂与仪器
VEGF和NGF一抗,北京博奥森生物技术有限公司;SABC免疫组化染色试剂盒、DAB显色试剂盒和辣根酶标记兔抗山羊IgG二抗,武汉博士德生物工程有限公司;木瓜蛋白酶,Merck公司。超薄切片机,德国LEICA公司;TKY-TKA型摊片烤片机,湖北泰康医疗设备有限公司;ZEISS研究级正置数码显微镜,德国ZEISS公司。
2 实验方法
2.1 造模、分组与给药
40只兔分为空白组8只和造模组32只,采用木瓜蛋白酶注射法于实验第1、4、7日对造模组兔右膝关节腔注射4%木瓜蛋白酶溶液0.5 mL(20 mg),首次注射4周后随机处死2只兔,病理学观察出现典型软骨退变表现,同时兔右膝关节出现肿胀、跛行,表明造模成功。将成模兔随机分为模型组、透明质酸钠组和青藤碱组,每组10只。根据成人用药剂量(玻璃酸钠和青藤碱均为2 mL/次)按Meeh-Rubner公式计算人兔等效剂量。除空白组外,其余各组兔造模侧膝关节行关节腔注射,青藤碱组膝关节腔注射正清风痛宁注射液0.2 mL(5 mg),每3 d注射1次,共10次;透明质酸钠组膝关节腔注射玻璃酸钠注射液0.2 mL,每6 d注射1次,共5次;模型组膝关节腔注射生理盐水0.2 mL,注射次数同青藤碱组。干预30 d。实验过程中,模型组、透明质酸钠组和青藤碱组兔各死亡1只,各组实验兔最终为空白组8只,其余3组各9只。
2.2 取材及标本处理
2.2.1 关节液采集 干预结束后,生理盐水冲洗收集关节液。于兔右膝关节腔内注入生理盐水1 mL,充分活动膝关节使生理盐水与关节液充分混合,再抽取关节腔生理盐水0.6~1 mL至EP管,4000 r/min离心10 min,取上清液,-80 ℃保存备检。
2.2.2 滑膜采集 关节液标本采集完毕后,耳源静脉空气栓塞法处死全部实验动物。采用髌旁内外并横断骸韧带的联合切口,将软组织瓣包括髌骨一起向上翻起,并极度屈膝以充分显露膝关节腔,肉眼观察滑膜、软骨等大体情况并记录,取右膝髌骨下滑膜组织,以冰生理盐水冲洗后置10%中性甲醛中固定48 h,石蜡包埋,常规切片备用。
2.3 软骨血管内皮生长因子和神经生长因子表达检测
干预结束后第2日,切取兔右膝内侧胫骨平台约5 mm厚带有软骨下骨质的软骨组织,修成0.5 cm×0.5 cm×0.3 cm,经蒸馏水冲洗后置于10%中性甲醛溶液固定48 h,乙二胺四乙酸脱钙,石蜡包埋,5 μm连续切片,免疫组化检测VEGF及NGF的表达,细胞内呈棕褐色为阳性结果,应用显微图像分析系统采集图像。随机选取3个视野,注意选取临近退变缺损部位,对具有完整4层软骨结构的区域进行观测;计算每个视野内阳性细胞数和细胞总数,计算细胞分数(阳性细胞数÷细胞总数×100%),用百分比表示VEGF和NGF的表达量;每张切片细胞计数分别由3个独立观察者进行,其评分误差率≤5%,取其均值。
2.4 滑膜血管内皮生长因子和神经生长因子表达检测
取右膝髌骨下滑膜组织,经蒸馏水冲洗后置10%中性甲醛中固定48 h,石蜡包埋,常规切片,免疫组化检测VEGF和NGF的表达,细胞浆被染成棕褐色为阳性表现。应用积分光密度值反映VEGF和NGF阳性表达的数量及强度。每张切片随机选取3个视野,用Image-Pro Plus 6.0免疫组化图像分析系统测定每视野各阳性区平均光密度值。每例标本被检区测3张切片,取其均值。
3 统计学方法
采用SPSS19.0统计软件进行分析。实验数据以—x±s表示,多组间比较采用方差分析。P<0.05表示差异有统计学意义。
4 结果
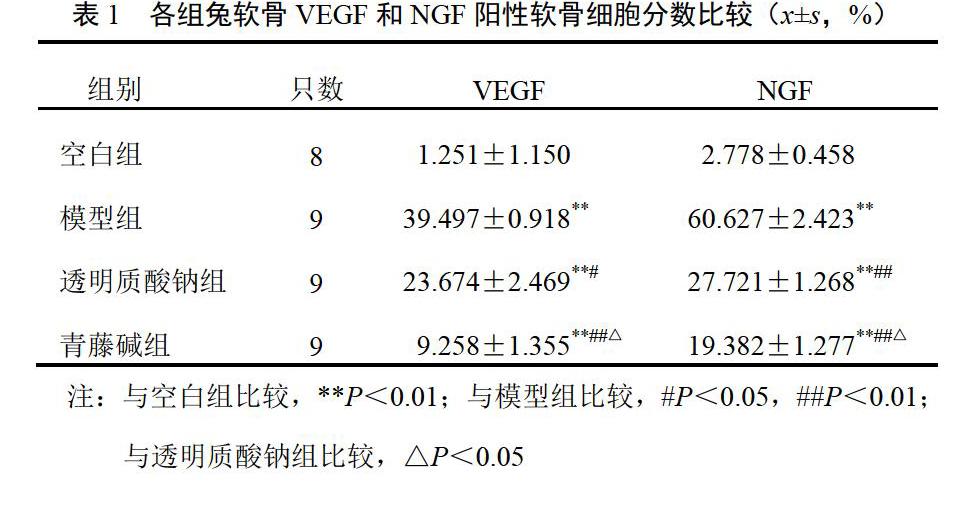
4.1 青藤碱对膝骨关节炎兔软骨血管内皮生长因子和神经生长因子表达的影响
空白组软骨细胞可见极少量VEGF表达;模型组阳性软骨细胞显著增多,各层均可见到,多集中于浅层和中层,阳性软骨细胞数与空白组比较差异有统计学意义(P<0.01);青藤碱组和透明质酸钠组阳性细胞数较模型组明显降低(P<0.05,P<0.01),且多集中于软骨浅层;青藤碱组阳性软骨细胞数低于透明质酸钠组(P<0.05)。空白组表层软骨散见数个NGF阳性软骨细胞;模型组软骨全层阳性软骨细胞较空白组明显著增多(P<0.01);青藤碱组和透明质酸钠组阳性细胞分数较模型组明显低少(P<0.05,P<0.01);青藤碱组阳性软骨细胞分数低于透明质酸钠组(P<0.05)。结果见表1、图1、图2。
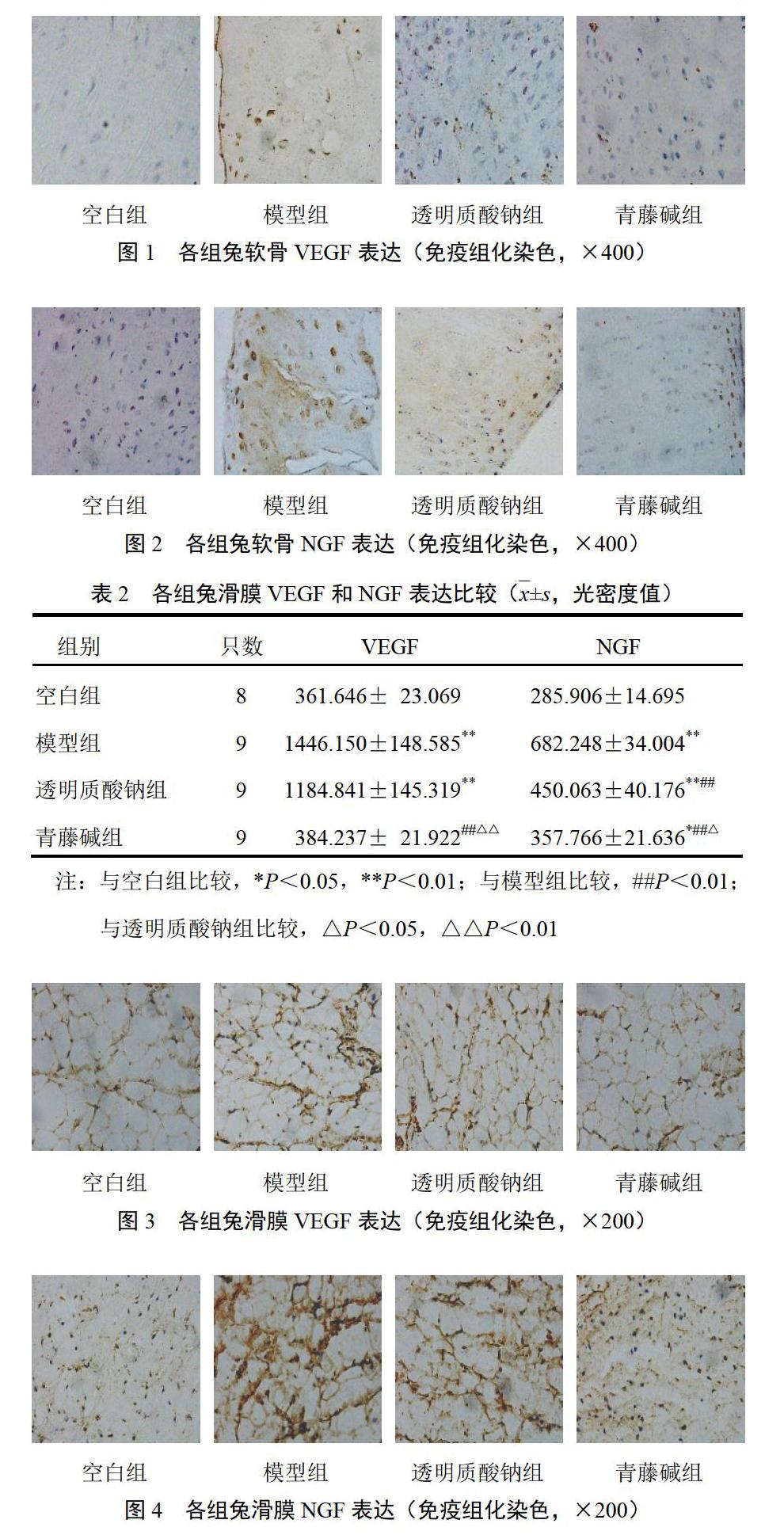
4.2 青藤碱对膝骨关节炎兔滑膜血管内皮生长因子和神经生长因子表达的影响
模型组和透明质酸钠组VEGF平均光密度值较空白组显著升高(P<0.01);青藤碱组VEGF平均光密度值显著低于模型组和透明质酸钠组(P<0.01);青藤碱组VEGF平均光密度值与空白组比较差异无统计学意义(P>0.05)。模型组NGF平均光密度值较空白组显著升高(P<0.01);青藤碱组和透明质酸钠组NGF平均光密度值显著低于模型组(P<0.01);青藤碱组NGF平均光密度值显著低于透明质酸钠组(P<0.05)。结果见表2、图3、图4。
5 讨论
血管生成与类风湿关节炎密切相关已是公认的事实,其在OA软骨退变中也发挥了重要作用。据报道,OA患者骨赘、关节软骨、滑膜及半月板等结构均伴有血管生成或新生血管增多[3-6]。OA常常伴有慢性滑膜炎症,并以巨噬细胞浸润为主要特征,后者可分泌VEGF[7]。研究发现,OA患者及动物模型软骨中VEGF表达量显著上调[8-9]。血管与伴行神经的生长是一个紧密联系的过程,OA关节软骨连接处、骨赘及半月板内血管新生的同时也伴随着感觉神经的生长[10]。NGF也是一种重要的促血管生成因子,NGF及其受体高亲和性受体TrkA和低亲和性p75受体在正常关节软骨细胞有少量表达[11-12],而在OA软骨的表达量显著升高[13-14]。机械压力、炎性刺激及内脂素均可诱导人、小鼠软骨细胞表达NGF,构成OA关节痛的机制之一[15]。研究发现,OA患者关节液中NGF含量显著升高[16],且与软骨退变程度密切相关[13-14];关节腔注射NGF可增强OA大鼠痛性行为反应[17]。本实验免疫组化检测结果显示,VEGF和NGF在正常兔软骨及滑膜均有少量表达,在KOA兔软骨及滑膜均呈高表达,与文献报道一致;青藤碱关节腔注射可显著降低KOA兔软骨及滑膜中VEGF和NGF的表达量,效果优于玻璃酸钠关节腔注射。血管生成是炎性反应尤其是慢性炎性反应的重要特征,本实验结果显示,青藤碱可下调促血管生成因子在KOA兔软骨及滑膜中的表达,与本研究前期观察到的青藤碱抑制KOA兔滑膜炎性反应是一致的,但具体是通过何种机制,涉及哪些信号通路尚未清楚,有待深入研究。OA关节内新生血管形成通常伴有感觉神经的生长,构成OA关节疼痛的重要因素。青藤碱缓解OA关节疼痛已得到临床广泛证实,本研究结果提示抑制关节内血管神经的生长可能是青藤碱减轻OA疼痛作用的一个重要机制。
参考文献:
[1] 白玉龙,许红英,杨晓冰.盐酸青藤碱改善膝骨关节炎患者运动功能36例[J].中国临床康复,2002,6(27):3731-3735.
[2] 郑洁,王瑞辉,寇久社.青藤碱关节腔注射对兔膝骨关节炎模型组织形态学及基质金属蛋白酶-13和软骨寡聚基质蛋白的影响[J].中国中医药信息杂志,2016,23(1):74-77.
[3] BROWN R A, WEISS J B. Neovascularisation and its role in the osteoarticular process[J]. Ann Rheum Dis,1988,47(11):881-885.
[4] FRANSES R E, MCWILLIAMS D F, MAPP P I, et al. Osteochondral angiogenesis and increased protease inhibitor expression in OA[J]. Osteoarthritis & Cartilage,2010,18(4):563-571.
[5] BONNET C S, WALSH D A. Osteoarthritis, angiogenesis and inflammation[J]. Rheumatology (Oxford),2005,44(1):7-16.
[6] ASHRAF S, WIBBERLEY H, MAPP P I, et al. Increased vascular penetration and nerve growth in the meniscus:a potential source of pain in osteoarthritis[J]. Ann Rheum Dis,2011,70(3):523-529.
[7] MAPP P I, AVERY P S, MCWILLIAMS D F, et al. Angiogenesis in two animal models of osteoarthritis[J]. Osteoarthritis Cartilage, 2008,16(1):61-69.
[8] 苏伟,谢文,关明.骨性关节炎患者血管内皮生长因子的表达[J].检验医学,2008,23(1):42-45.
[9] 邱波,陈宣银,周建林.骨关节炎软骨中血管内皮生长因子mRNA表达[J].武汉大学学报(医学版),2011,32(1):51-54.
[10] SUNITA S, GILL S E, SALLY MDC, et al. Neurovascular invasion at the osteochondral junction and in osteophytes in osteoarthritis[J]. Ann Rheum Dis,2007,66(11):1423-1428.
[11] GIGANTE A, BEVILACQUA C, PAGNOTTA A, et al. Expression of NGF, Trka and p75 in human cartilage[J]. Eur J Histochem,2003,47(4):339-344.
[12] GRIMSHOLM O, GUO Y, NY T, et al. Expression patterns of neurotrophins and neurotrophin receptors in articular chondrocytes and inflammatory infiltrates in knee joint arthritis[J]. Cells Tissues Organs,2008,188(3):299-309.
[13] HUANG H, SHANK G, MA L, et al. Nerve growth factor induced after temporomandibular joint inflammation decelerates chondrocyte differentiation[J]. Oral Dis,2013,19(6):604-610.
[14] IANNONE F, DE BARI C, DELL'ACCIO F, et al. Increased expression of nerve growth factor (NGF) and high affinity NGF receptor (p140 TrkA) in human osteoarticular chondrocytes[J]. Rheumatology (Oxford),2002,41(12):1413-1418.
[15] PECCHI E, PRIAM S, GOSSET M, et al. Induction of nerve growth factor expression and release by mechanical and inflammatory stimuli in chondrocytes:possible involvement in osteoarthritis pain[J]. Arthritis Res Ther,2014,16(1):R16.
[16] ALOE L, TUVERI MA, CARCASSI U, et al. Nerve growth factor in the synovial fluid of patients with chronic arthritis[J]. Arthritis Rheum,1992,35(3):351-355.
[17] ASHRAF S, MAPP P I, BURSTON J, et al. Augmented pain behavioural responses to intra-articular injection of nerve growth factor in two animal models of osteoarthritis[J]. Ann Rheum Dis,2014,73(9):1710-1718.
(收稿日期:2015-06-30;编辑:华强)

