马齿苋多糖对宫颈癌细胞恶性生物学行为抑制作用的实验研究
丁 虹,唐雯静,庞燕芬,吕 雯
·论著·
马齿苋多糖对宫颈癌细胞恶性生物学行为抑制作用的实验研究
丁虹1,唐雯静1,庞燕芬1,吕雯2
[摘要]目的研究马齿苋多糖对宫颈癌细胞恶性生物学行为的抑制作用。方法选择c57小鼠并建立宫颈癌荷瘤鼠模型,随机分为对照组、低剂量组、中剂量组和高剂量组4组,分别接受等渗盐水、100、200、400 mg/kg马齿苋多糖腹腔注射。治疗后检测移植瘤的体积、重量以及移植瘤中细胞凋亡数目、ATP含量、新生血管分子的表达量。结果低剂量组、中剂量组和高剂量组的瘤体体积和重量、移植瘤组织中的ATP含量以及血管内皮生长因子(VEGF)、CD13、CD34的表达量均低于对照组,凋亡细胞数目多于对照组。马齿苋多糖能够以剂量依赖性的方式降低移植瘤的体积、重量以及移植瘤中细胞凋亡数目、ATP含量、新生血管血管分子的表达量,增加凋亡细胞的数目。结论马齿苋多糖能够抑制宫颈癌移植瘤的生长、诱导癌细胞凋亡、干扰氧化供能、减少新生血管数目,对宫颈癌细胞恶性生物学行为具有抑制作用。
[关键词]宫颈癌;马齿苋多糖;凋亡;血管新生;三磷酸腺苷
作者单位:1. 310002浙江杭州,南京军区杭州疗养院海勤疗养区妇科;2. 310013浙江杭州,浙江省立同德医院妇产科
引用格式:丁虹,唐雯静,庞燕芬,等.马齿苋多糖对宫颈癌细胞恶性生物学行为抑制作用的实验研究[J].东南国防医药,2016,18(1):38-40,58.
宫颈癌是女性生殖系统最常见的恶性肿瘤,HPV感染是宫颈癌及癌前病变的重要危险因素[1-2]。近年来, HPV感染率和宫颈癌的发病率呈上升趋势[3]。手术切除联合术后放化疗的综合治疗方式是临床治疗宫颈癌的主要方式,能够有效清除病灶并杀灭残留癌细胞,进而最大限度地预防肿瘤复发。化疗是术后综合治疗的重要组成部分,能够杀灭癌细胞,同时也会损伤正常组织,增加化疗药物剂量虽然能够增强对癌细胞的杀伤效应、但也会引起机体无法耐受的化疗损伤并影响化疗效果。近年来,天然植物中多糖成分的抗肿瘤活性受到了越来越多的重视,马齿苋多糖作为生物反应调节剂亦具有杀灭癌细胞的作用[4]。在本研究中,我们探讨了马齿苋多糖对宫颈癌细胞恶性生物学行为的抑制作用。
1材料与方法
1.1实验材料c57小鼠32只由浙江大学实验动物中心提供[实验动物许可证号:SCXK(沪)2015-0107],均为雌性、周龄4~6周、体重18~25 g。马齿苋多糖由浙江省立同德医院药剂科提取和分离,TUNEL试剂盒购自Roche公司,ATP检测试剂盒和蛋白浓度BCA测定试剂盒购自碧云天公司,血管内皮生长因子(VEGF)、CD13、CD34以及β-actin单克隆抗体购自Abcam公司;荧光显微镜为Nikon公司产品,电化学显影仪为天能公司产品。
1.2实验方法
1.2.1宫颈癌荷瘤鼠模型的制作方法取SiHa细胞株(购自中科院上海分院),常规复苏、培养、传代后得到对数期生长细胞,用培养基将细胞浓度稀释至1×107/ml,取细胞悬液100 μL注射入小鼠背部的皮下组织。待肿瘤生长、瘤体形成后,用影像学检查测定瘤体体积,筛选瘤体直径1.2~1.6 cm的小鼠作为宫颈癌荷瘤鼠模型。
1.2.2动物分组及药物治疗方法宫颈癌荷瘤鼠模型制作成功后,将模型小鼠随机分为对照组、低剂量组、中剂量组和高剂量组4组,每组8只,分别接受等渗盐水、100、200、400 mg/kg马齿苋多糖腹腔注射,每日给药1次,连续治疗12 d。
1.2.3瘤体体积及重量处死小鼠后,分离皮下肿瘤组织,测定瘤体的体积和重量。
1.2.4瘤体内细胞凋亡情况取移植瘤组织充分研磨,用TUNEL试剂盒检测瘤体内细胞凋亡情况,分别用TUNEL试剂和DAPI试剂对凋亡细胞以及细胞核染色,然后在荧光显微镜下观察4~6个随机视野内的200个细胞,计算凋亡细胞的数目。
1.2.5肿瘤组织ATP生成能量取移植瘤组织充分研磨,参照试剂盒说明书检测ATP含量。同时,用BCA试剂盒计算待测样本中的蛋白总含量,以总蛋白含量为内参照计算每mg蛋白内ATP的含量。
1.2.6免疫印迹检测取移植瘤标本,加入RIPA蛋白裂解液后匀浆、离心后取上层蛋白样本,加入上样缓冲液后于100 ℃高温变性10 min。取变性后的蛋白标本适量,加入预先配置好的SDS-PAGE凝胶中,依次进行垂直电泳、电转膜、抗原位点封闭、第一抗体孵育、第二抗体孵育以及电化学发光(electrochemiluminescence, ECL)显影。孵育的抗体包括VEGF、CD13、CD34以及β-actin。得到蛋白条带后计算灰度值,以β-actin为内参照对蛋白含量进行半定量分析。

2结果
2.1瘤体体积及重量低剂量组、中剂量组和高剂量组的瘤体体积及重量均低于对照组。马齿苋多糖能够以剂量依赖性方式降低瘤体体积及重量,高剂量组的瘤体体积及重量均低于低剂量组、中剂量组,中剂量组的瘤体体积及重量均于低剂量组。见表1(P均<0.05)。

±s)
2.2瘤体内凋亡细胞数目低、中和高剂量组肿瘤组织中的瘤体内凋亡细胞数目均高于对照组。马齿苋多糖能够以剂量依赖性的方式增加瘤体内凋亡细胞数目,高剂量组肿瘤组织中的瘤体内凋亡细胞数目均高于低剂量组、中剂量组,中剂量组肿瘤组织中的瘤体内凋亡细胞数目均高于低剂量组。见表2。
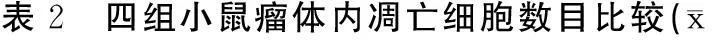
±s)
2.3血管新生分子的蛋白含量低剂量组、中剂量组和高剂量组肿瘤组织中的VEGF、CD13、CD34的蛋白含量低于对照组,马齿苋多糖能够以剂量依赖性的方式降低肿瘤组织中的VEGF、CD13、CD34蛋白含量,高剂量组肿瘤组织中的VEGF、CD13、CD34的蛋白含量低于低剂量组、中剂量组,中剂量组肿瘤组织中的VEGF、CD13、CD34的蛋白含量均于低剂量组。见表3。
2.4ATP含量低剂量组、中剂量组和高剂量组肿瘤组织中的ATP含量均低于对照组,马齿苋多糖能够以剂量依赖性的方式降低肿瘤组织中的ATP含量,高剂量组肿瘤组织中的ATP含量均低于低剂量组、中剂量组,中剂量组肿瘤组织中的ATP含量均低于低剂量组。见表4。

表3 四组小鼠肿瘤组织中血管新生分子的
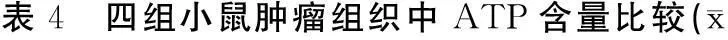
±s)
3讨论
化疗是宫颈癌综合治疗方案的重要组成部分,化疗药物的毒副作用较强,虽然能够有效杀伤肿瘤细胞,但也会对正常组织造成较为严重的损伤。在临床实践中,使用化疗药物治疗宫颈癌时,提高化疗药物剂量、增加不同作用机制的化疗药物种类能够增强化疗药物对癌细胞的杀伤效应,但同时也加重正常组织的损伤,若患者无法耐受,会影响化疗效果[5]。近年来,许多研究报道从多种植物中提取的多糖类物质具有抗肿瘤活性。植物多糖一般不通过直接杀伤肿瘤细胞来发挥抗肿瘤效应,而是作为生物反应调节剂来增强体内的免疫应答和凋亡途径、氧化呼吸功能途径等来杀伤癌细胞[6]。因此,植物多糖对正常组织的损伤较小,筛选具有宫颈癌细胞杀伤效应的植物多糖并与常规化疗药物联合应用能够改善宫颈癌的治疗效果。
马齿苋是我国资源储备极为丰富的一类药食两用植物,其主要功效为清热解毒、凉血消肿,对于腹泻、痢疾、感染等疾病具有治疗作用[7]。马齿苋所包含的有效化学成分包括多糖、黄酮类、萜类、生物碱以及香豆素类等。该植物的粗提物具有抗肿瘤、抗氧化、抗炎等多种活性,进一步的分离纯化发现,马齿苋中的多糖成分具有抗肿瘤效应。赵蕊等[8-9]的研究显示,马齿苋多糖能够增强宫颈癌荷瘤鼠的免疫功能、降低肿瘤细胞发生免疫逃逸的风险,进而使荷瘤鼠的肿瘤体积明显缩小。该研究提示马齿苋多糖具有抗肿瘤活性,能够有效抑制宫颈癌移植瘤的生长。
目前关于马齿苋多糖抗肿瘤效应的研究报道较少,为了进一步明确马齿苋多糖对宫颈癌的杀伤和抑制效应及生物学机制,我们建立了宫颈癌荷瘤鼠模型,通过腹腔注射不同浓度马齿苋多糖进行治疗。我们对移植瘤的生长情况进行了初步分析,对肿瘤体积的测量结果可知,马齿苋多糖能够以剂量依赖性的方式降低瘤体体积及重量,马齿苋多糖的浓度越高,瘤体的体积和重量越低。这部分结果与赵蕊等[8-9]的研究结果相吻合,说明马齿苋多糖能够抑制宫颈癌移植瘤的生长。
在得到马齿苋多糖抑制肿瘤生长的结果后,我们进一步分析了肿瘤组织中癌细胞相关的恶性生物学行为。在宫颈癌的发生和发生过程中,宫颈上皮的表型发生变化,多种抑癌基因失活、原癌基因激活、细胞周期蛋白和抗凋亡分子表达增加会使得宫颈上皮由正常表型向恶性增殖表型转化,表现为极强的增殖能力和抗凋亡能力[10]。化疗药物和植物多糖发挥抗肿瘤效应的根本途径就是通过不同机制来诱导癌细胞发生凋亡[11]。本研究发现,马齿苋多糖能够以剂量依赖性的方式增加瘤体内凋亡细胞数目。说明马齿苋多糖能够诱导宫颈癌移植瘤组织中的癌细胞发生凋亡。
无限增殖是癌细胞基本的恶性生物学特征,细胞表型的转变是癌细胞增殖的首要步骤,而后需要局部新生血管提供的营养物质来进行氧化供能[12]。细胞增殖是耗能的主动过程,线粒体氧化呼吸过程能够为该过程提供所需的ATP,而局部新生血管形成则能为氧化呼吸过程提供必须的氧气等原材料[13]。VEGF是促血管新生效应最强的细胞因子、能够反映肿瘤组织血管生成的能力。CD13和CD34是内皮细胞的标志分子,能够反映肿瘤组织中血管生成的数目[14]。结果显示,马齿苋多糖能够以剂量依赖性的方式降低肿瘤组织中VEGF、CD13和CD34表达量以及ATP含量。
综上所述,马齿苋多糖能够抑制宫颈癌移植瘤的生长、诱导癌细胞凋亡、干扰氧化供能、减少新生血管数目,对宫颈癌细胞恶性生物学行为具有一定的抑制作用。
【参考文献】
[1]朱皓皞,于晓红,杜丽英,等. 宫颈癌中激活蛋白1通路的活化及临床意义[J]. 东南国防医药,2014,16(3):128-131.
[2]潘登华,何融泉,韦康来,等. 人乳头状病毒E6蛋白与宫颈癌关系的研究进展[J]. 医学研究生学报,2014,27(11):1229-1232.
[3]Ribeiro AA, Costa MC, Alves RR, et al. HPV infection and cervical neoplasia: associated risk factors[J].Infect Agent Cancer, 2015, 10:16.
[4]Tian JL, Liang X, Gao PY, et al. Two new alkaloids from portulaca oleracea and their cytotoxic activities[J].J Asian Nat Prod Res, 2014, 16(3):259-264.
[5]Takekuma M, Kuji S, Tanaka A, et al. Platinum sensitivity and non-cross-resistance of cisplatin analogue with cisplatin in recurrent cervical cancer[J].J Gynecol Oncol, 2015, 26(3):185-192.
[6]Chang WT, Lai TH, Chyan YJ, et al. Specific medicinal plant polysaccharides effectively enhance the potency of a DC-based vaccine against mouse mammary tumor metastasis[J].PLoS One, 2015, 10(3):e0122374.
[7]Zhao R, Gao X, Cai Y, et al. Antitumor activity of portulaca oleracea polysaccharides against cervical carcinoma in vitro and in vivo[J].Carbohydr Polym, 2013, 96(2):376-383.
[8]赵蕊,高旭,邵兴月. 马齿苋多糖对荷宫颈癌小鼠免疫刺激活性的研究[J]. 中国免疫学杂志,2014,30(10):1344-1348.
[9]赵蕊,蔡亚平,陈志宝,等. 马齿苋多糖对老龄荷瘤小鼠抗宫颈癌的作用[J]. 中国老年学杂志,2013,33(18):4480-4482.
[10]Yang B, Lu Y, Zhang A, et al. Doxycycline induces apoptosis and inhibits proliferation and invasion of human cervical carcinoma stem cells[J].PLoS One, 2015, 10(6):e0129138.
[11]Jayaram S, Kapoor S, Dharmesh SM. Pectic polysaccharide from corn (Zea mays L.) effectively inhibited multi-step mediated cancer cell growth and metastasis[J].Chem Biol Interact, 2015, 25(235):63-75.
[12]Mello Pde A, Filippi-Chiela EC, Nascimento J, et al. Adenosine uptake is the major effector of extracellular ATP toxicity in human cervical cancer cells[J].Mol Biol Cell, 2014,25(19):2905-2918.
[13]Liu FW, Cripe J, Tewari KS.Anti-angiogenesis therapy in gynecologic malignancies[J].Oncology (Williston Park), 2015, 29(5):350-360.
[14]郭哲,史惠蓉. 宫颈癌组织中CD13与CD34的表达[J]. 郑州大学学报(医学版),2012,47(4):525-527.
(本文编辑:齐名;英文编辑:王建东)
Animal study on the inhibition effect of Portulaca oleracea polysaccharide on malignant behavior of cervical cancer cells
DINGHong1,TANGWen-jing1,PANGYan-fen1,LUWen2
.1.DepartmentofGynecology,NavalLogisticsBranchofHangzhouSanatorium,NanjingMilitrayCommand,Hangzhou,Zhejiang310002,China; 2.DepartmentofGynaecologyandObstetrics,TongdeHospitalofZhejiangProvince,Hangzhou,Zhejiang310013,China
[Abstract]ObjectiveTo study the inhibition effect of portulacaoleracea polysaccharide on malignant behavior of cervical cancer cells. Methodsc57 mice were selected and cervical cancer bearing mice model were established and randomly divided into control group, low dose group, middle dose group and high dose group, which received saline, 100 mg/kg polysaccharide, 200 mg/kg polysaccharide, 400 mg/kg polysaccharide injection respectively. After treatment, tumor volume, weight and apoptosis cell number, ATP content, neovascularization vascular molecules in tumor were detected. ResultsTumor volume, weight, ATP content and VEGF, CD13, CD34 expression level in tumor of low dose group, middle dose group and high dose group were lower than control group; portulacaoleracea polysaccharide reduced tumor volume, weight, ATP content and VEGF, CD13, CD34 expression level in tumor by a dose-dependent manner. ConclusionPortulacaoleracea polysaccharide can inhibit cancer tumor growth, increase cell apoptosis number, induce apoptosis, interfere oxidation energy, reduce new blood vessels number and inhibit malignant behavior of cervical cancer cells.
[Key words]cervical cancer; portulacaoleracea polysaccharide; apoptosis; angiogenesis; ATP
(收稿日期:2015-08-20;修回日期:2015-11-02)
[中图分类号]R737.33;R285.5
[文献标志码]A
doi:10.3969/j.issn.1672-271X.2016.01.011

