胃癌患者贫血的相关因素分析
陈 彬,孟翔凌
(安徽医科大学第一附属医院普外科,安徽 合肥 230022)
胃癌患者贫血的相关因素分析
陈彬,孟翔凌
(安徽医科大学第一附属医院普外科,安徽 合肥230022)
摘要:目的探讨胃癌患者贫血的相关因素。方法采用随机抽样的统计方法,收集2014年1—12月期间在安徽医科大学第一附属医院普外科经病理证实为胃癌患者的病例,采用χ2分析以及二分类非条件Logistic回归模型对胃癌肿瘤相关性贫血与胃癌患者的性别、年龄、及病理等相关数据进行分析。结果共收集病例300份,其中男性231例,女性69例,平均年龄为(61.4±12.5)岁。有贫血患者92例,检出率为30.7%。经分析,胃癌贫血的检出率在不同性别和肿瘤的发生部位分布差异无显著性统计学意义(P>0.05);而在患者的年龄、癌灶的直径及TNM分期的分布差异有显著性(P<0.05)。二分类非条件Logistic回归模型结果表明,肿瘤TNM分期的Ⅲ、Ⅳ期是胃癌相关性贫血的危险因素,肿瘤TNM分组的OR值及95%CI为2.032,1.170~3.528。结论胃癌患者的年龄、肿瘤大小、TNM是胃癌患者发生贫血的危险因素。
关键词:胃癌;贫血
胃癌是最常见的消化系统恶性肿瘤,据报道称[1],在我国恶性肿瘤中胃癌发病率居第2位,死亡率居第3位。胃癌患者常常伴随各种疾病[2],其中,贫血的临床发生率高,是常伴随胃癌发生的疾病之一。肿瘤相关性贫血(cancer related anemia,CRA)[3]是指发生于肿瘤发展进程或抗肿瘤治疗过程中所引起的贫血,可增加肿瘤的转移率,缩短患者的生存时间,影响患者的生活质量和预后。而CRA与胃癌到底存在怎样的关联,本研究试图通过对胃癌患者进行回顾性分析,探讨胃癌患者CRA的相关因素。
1资料与方法
1.1一般资料采用随机抽样的方法,选取、收集2014年1—12月期间在安徽医科大学第一附属医院普外科经病理证实为胃癌患者的病例。病例纳入标准: (1)排除由血液系统疾病引起贫血的患者;(2)排除原发性肝、肾、脾功能亢进等疾病引起的贫血患者;(3)排除残胃癌患者;(4)排除经输血治疗及术前化疗的患者。
1.2数据搜集收集入选病例患者的人口统计学信息,包括姓名、性别、年龄以及肿瘤病理的相关数据,例如肿瘤的生长部位、大小、胃癌大体分型及胃癌的TNM分期等数据。
1.3数据分析中的相关定义贫血诊断标准:根据美国的国家癌症研究所(NCI)癌性贫血诊断标准:血红蛋白≤110 g·L-1(HGB的正常值范围111~150 g·L-1),贫血严重程度划分标准:轻度贫血100.0~110.0 g·L-1,中度贫血80.0~99.0 g·L-1,重度贫血65.0~79.0 g·L-1,危及生命<65.0 g·L-1。本研究仅划分是否为癌性贫血。
胃癌临床病理分期:根据第7版AJCC胃癌TNM分期法[4]分为Ⅰ、Ⅱ、Ⅲ、Ⅳ期(收集病例中无0期患者)。胃的分区:根据钱礼腹部外科学[5]将胃大弯和胃小弯各3等分,连接胃大弯和胃小弯的对应点将胃分为贲门胃底部(U);胃体部(M);幽门部(L)。癌灶直径≥5 cm及癌灶直径<5 cm为标准,胃癌的大体分型以Borrmann分型分为Ⅰ、Ⅱ、Ⅲ、Ⅳ型。
1.4统计学方法采用EpiData3.0 进行数据录入,利用SPSS11.0统计软件进行数据分析。主要统计方法有统计描述、χ2分析以及二分类非条件Logistic回归模型。当P<0.05时,认为具有统计学意义。
2结果
2.1一般人口统计学描述本研究共收集胃癌患者300例,年龄范围为29~84岁,平均年龄为(61.4±12.5)岁,其中男性231例,占77%。所收集的病例中贫血患者有92例,占总数的30.7%。本次病例收集中有149例胃癌发生在贲门胃底部,占总数的49.7%。
2.2不同临床病理学特征胃癌患者贫血发生率的单因素分析单因素χ2分析显示,与年龄<63岁组比较,胃癌患者的贫血发生率在年龄≥63岁组较高,发生率为38.0%,且差异具有统计学意义(P<0.05)。此外,从分析结果也可以清晰地看出,胃癌患者的贫血发生率与癌灶直径以及胃癌TNM分期有明显关联,在不同分组中的比较结果均显示出有统计学差异(P<0.05)。胃癌患者贫血发生率在不同临床病理学特征中的发生率见表1。
2.3不同临床病理学特征胃癌相关性贫血的Logistic回归模型分析将胃癌患者发生相关性贫血(1=不贫血,2=贫血)作为因变量,病理分期、病灶直径当作自变量,然后控制协变量(性别、年龄已经胃癌发病部位等)以Enter 方式带入多因素二分类非条件Logistic回归模型中进行分析。结果见表2。
二分类非条件Logistic回归模型分析结果表明,在控制协变量后,肿瘤TNM分组为Ⅲ、Ⅳ期增加了胃癌患者贫血的发生可能性,即肿瘤TNM分组为Ⅲ、Ⅳ期是胃癌患者发生贫血的危险因素,OR值及95%CI为2.032,1.170~3.528。
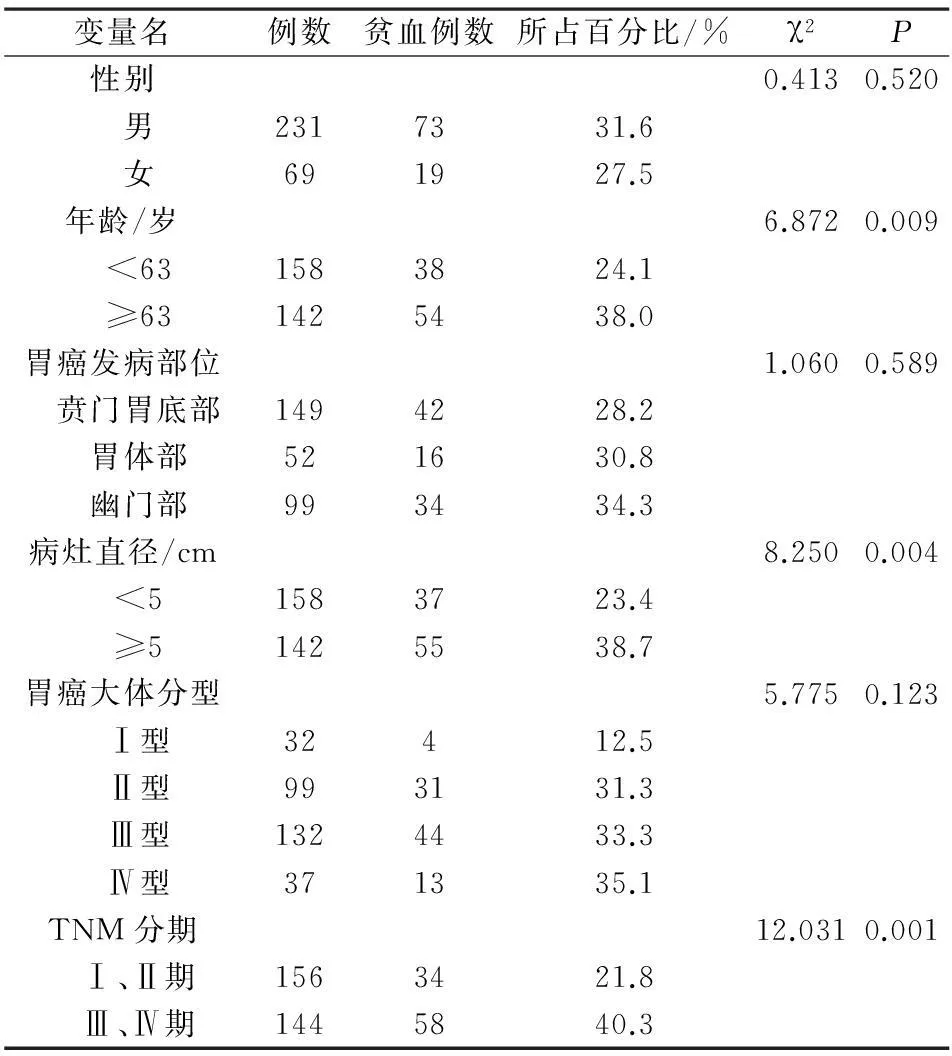
表1 不同临床病理学特征胃癌患者贫血发生率的χ2分析
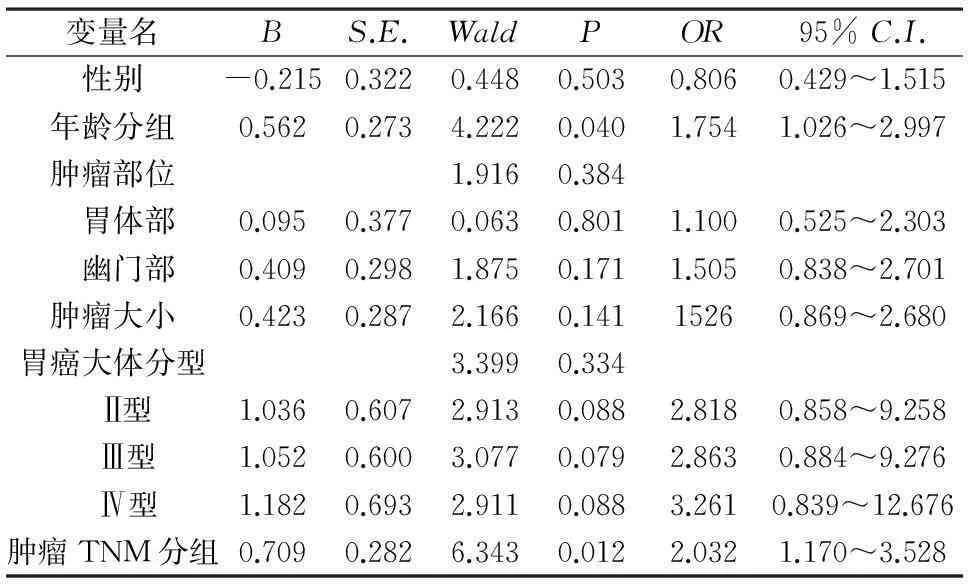
表2 不同临床病理学特征胃癌相关性
注:对照组分别为:男性,年龄<63岁,肿瘤部位在贲门胃底部,肿瘤大小<5 cm,胃癌大体分型为Ⅰ型以及肿瘤TNM分组为 Ⅰ、Ⅱ期。
3讨论
本研究胃癌肿瘤相关性贫血的发生率为30.7%,葛军娜等[6]报道胃癌术前肿瘤相关性贫血的发生率为36.6%,与本研究结果相似。
经过比较得出,年龄≥63岁患者发生贫血的比年龄<63岁患者更容易发生贫血(38.0%:24.1%,χ2=6.872,P=0.009)。随着年龄的增大,机体生理功能逐渐退化,肝脏的合成与解毒功能下降,肾脏的分泌与清除功能减弱,骨髓的储备与再生功能减弱[7]及老年恶性肿瘤患者营养风险发生率显著高于中青年患者[8],上述原因均可导致老年患者较中青年患者更易发生CRA。
癌灶直径≥5 cm的胃癌患者比癌灶直径<5 cm贫血发生率高(38.7% :23.4%,χ2=8.250,P=0.004),说明肿瘤越大发生贫血的可能性越大。癌症患者慢性贫血的发病机制可能是肿瘤细胞和宿主免疫系统的相互作用使机体炎症因子[9]分泌增加,相关炎症因子有白介素-1(IL-1)、白介素-6(IL-6)、γ干扰素(IFN-γ)、肿瘤坏死因子α(TNF-α)。IL-1、IFN-α、TNF-α是抑制红细胞生成的特异性细胞因子,可直接或间接抑制体内红系祖细胞的生成,抑制EPO的产生。铁调素(Hepcidin)是一种调节铁代谢的多肽类物质[10],当机体出现贫血时Hepcidin表达水平下调,促进铁吸收[11]。IL-6通过炎症信号通路上调Hepcidin的基因表达[12], Hepcidin在胃肠道实体肿瘤中高表达且可能参与了胃肠道肿瘤发生[6],干扰铁元素的利用,造成缺铁性贫血。随着癌灶直径的增大,肿瘤生长所需的营养物质及对患者机体的消耗增加,胃部腺体破坏增多,胃肠功能下降,致铁、叶酸、维生素B12等造血所必需的营养物质吸收障碍及炎症因子分泌增加致癌灶直径大的患者更易发生CRA。
本研究结果Ⅲ、Ⅳ期胃癌患者比Ⅰ、Ⅱ期的患者更容易发生贫血(40.3% :21.8%,χ2=12.031,P=0.001)。提示胃癌病理分期越高,肿瘤侵犯破坏的胃组织越多,晚期胃癌患者的营养不足和营养风险发生率较高[13]。随着患者病情进入晚期更多的炎症因子致EPO的分泌不足及铁元素的利用障碍。病理分期越高生活质量越差[14],且晚期胃癌患者疼痛、失眠及食欲下降等并发症加上肿瘤对患者机体的消耗致患者出现严重营养不良。以上原因共同作用致晚期胃癌患者易发生CRA。临床工作中诊断胃癌并发贫血的患者提示病情可能已经进入中晚期。
综上所述,胃癌肿瘤相关性贫血与胃癌患者的年龄、肿瘤大小、TNM分期关系密切,是胃癌患者发生贫血的危险因素,其发病机制是复杂的、多因素的,确切机制尚不明确,有待进一步研究。而有研究[15]表明贫血是癌症患者生存的独立预后因素,因此,对胃癌肿瘤相关性贫血的治疗,在改善患者的预后和提高患者的生活质量有重要意义。
参考文献:
[1]Lorusso G, Rüegg C. The tumor microenvironment and its contribution to tumor evolution toward metastasis[J].Histochem Cell Biol,2008,130(6): 1091-1103.
[2]余佩武,唐波.腹腔镜胃癌根治术常见并发症原因与防治原则[J/CD].中华普外科手术学杂志(电子版),2015,9(2):5-7.
[3]王杰军. EPO 治疗肿瘤相关性贫血专家共识(2010-2011版)[J].第六届中国癌症康复与姑息医学大会大会论文集和专题讲座,2010,15(10):925-936.
[4]Washington K.7th edition of the AJCC cancer staging manual: stomach[J].Annals of Surgical Oncology,2010,17(12): 3077-3079.
[5]张启瑜.钱礼腹部外科学[M].北京:人民卫生出版杜,2006:242.
[6]葛军娜.胃肠肿瘤相关性贫血调查和机制探讨及铁剂干预的临床研究[D].北京:北京协和医学院,2011.
[7]周敏,张洁,邓磊,等.老年恶性实体肿瘤患者癌性贫血的相关因素[J].中国老年学杂志,2013,33(12):2791-2793.
[8]于康,周晓容,郭亚芳.恶性肿瘤住院患者营养风险和营养不足发生率及营养支持应用状况调查[J].肿瘤学杂志, 2011,17(6):408-411.
[9]Adamson JW. The anemia of inflammation/malignancy: mechanisms and management[J]. ASH Education Program Book,2008,2008(1):159-165.
[10] Singh B,Arora S,Agrawal P,et al. Hepcidin:a novel peptide hormone regulating iron metabolism[J]. Clinica Chimica Acta,2011, 412(11):823-830.
[11] Andriopoulos Jr B,Corradini E,Xia Y,et al.BMP6 is a key endogenous regulator of hepcidin expression and iron metabolism[J].Nature Genetics,2009,41(4): 482-487.
[12] Wrighting DM,Andrews NC.Interleukin-6 induces hepcidin expression through STAT3[J].Blood,2006,108(9):3204-3209.
[13] 余家密,王晓杰,郭增,等.晚期胃癌患者营养状况及对化疗疗效影响的分析[J].福建医药杂志,2014,36(6):34-36.
[14] 俞淑芳.晚期胃癌患者生活质量及其影响因素300例调查分析[J].中国现代医生,2013,51(23): 3-6.
[15] Caro JJ,Salas M,Ward A,et al.Anemia as an independent prognostic factor for survival in patients with cancer[J].Cancer,2001,91(12):2214-2221.
收稿日期:(2015-09-22,修回日期:2015-11-03)
通信作者:孟翔凌,男,教授,博士生导师,研究方向:胃肠道肿瘤,E-mail:xianglingm@medmail.com.cn
作者简介:陈彬,男,硕士研究生
doi:10.3969/j.issn.1009-6469.2016.01.038

