山芝麻中化学成分与抗肿瘤活性研究
金孝勤,庞素秋
(中国人民解放军第180医院,福建 泉州 362000)
山芝麻中化学成分与抗肿瘤活性研究
金孝勤,庞素秋
(中国人民解放军第180医院,福建 泉州362000)
摘要:目的研究山芝麻中的化学成分及其抗肿瘤活性。 方法采用硅胶柱层析、制备薄层层析等色谱方法,对山芝麻乙醇提取物分离纯化,用波谱和薄层方法进行化合物结构鉴定。鉴定出的化合物,采用四甲基偶氮唑蓝(MTT)法观察化合物对人结肠癌细胞(HT-29)和卵巢癌细胞(OVCA429)的抑制增殖作用。结果分离出的9种化合物分别是葫芦素B(cucurbitacin B)(Ⅰ),葫芦素E(cucurbitacin E)(Ⅱ),迷迭香酸(rosmarinic acid)(Ⅲ),十二硫醇(Dodecanethiol)(Ⅳ),β-谷甾醇(β-sitosterol)(Ⅴ),乌苏酸(Ursolic acid)(Ⅵ),细辛脂素(Asarinin)(Ⅶ),麦角甾醇(Ergosterol)(Ⅷ),2,6-二甲氧基对醌(2,6-dimethoxy-p-quinone)(Ⅸ)。以荷瘤小鼠 S180为模型,观察其体内抗肿瘤作用。山芝麻的乙醇提取物在高剂量组抑瘤率为54.73%,表现出较好的抗肿瘤活性。经过MTT分析,化合物Ⅶ的IC50值显示对HT-29细胞显著抗增殖作用,对OVCA429细胞表现出微弱的抑制活性。化合物Ⅴ对HT-29细胞和OVCA429细胞都只有轻中度抑制作用。此外,化合Ⅲ和Ⅳ只对OVCA429细胞表现为轻度抑制活性,其它化合物没有显示针对这两种人癌细胞系的抗增殖作用(IC50>100 μmol·L-1)。结论山芝麻具有多种化学成分,部分具有较好的抗肿瘤活性,值得更加深入的研究。
关键词:山芝麻;化学成分;抗肿瘤活性
山芝麻(HelicteresangustifoliaLinn.)为梧桐科植物,别名岗油麻(《生草药性备要》)、岗脂麻(《岭南采药录》)、山油麻(《广州植物志》)、田油麻、仙桃草(《福建民间草药》),野芝麻、狗屎树(《广西中兽医药植》)、假芝麻(《广西药植图志》)、山麻(《闽南民间草药》)、假油麻、山芝麻头(《岭南草药志》)、白头公、油麻甲(江西《草药手册》)、野麻甲、假麻甲(《广东中草药》)[1]。山芝麻广泛种植于中国南部,其干燥根入药,被传统中药学视为滋补上品。山芝麻中富含亚油酸、维生素A、维生素B1、维生素E和钙、镁等矿物质[2]。山芝麻有滋补养血、调经补肾、护肝、润肠、软化皮肤,利尿、缓泻等功用,用于辅助治疗慢性便秘、耳鸣、齿龈炎、贫血,脱发、口角溃疡和偏头痛、视力减退、头昏眼花等疾病,对于改善老年人常见的疾患大有帮助[3]。
山芝麻中已发现的抗癌活性成分主要是木脂素类。Miyahara等用山芝麻中提取分离到的木脂素类化合物作用于人类淋巴样白血病Molt 4B细胞,发现其可使Molt 4B细胞产生寡核小体片段碎片,并呈现出浓度依赖性。实验表明山芝麻中的木脂素类可抑制Molt 4B细胞的生长,并诱导细胞的程序性死亡。但上述只是体外实验,山芝麻木脂素在生物体内的抗癌效果如何,尚待进一步深入研究[4-5]。
本研究从山芝麻中分离、纯化出9种化合物,分别是葫芦素B(cucurbitacin B)(Ⅰ)、葫芦素E(cucurbitacin E)(Ⅱ)、迷迭香酸(rosmarinic acid)(Ⅲ)、十二硫醇(Dodecanethiol)(Ⅳ)、β-谷甾醇(β-sitosterol)(Ⅴ)、乌苏酸(Ursolic acid)(Ⅵ)、细辛脂素(Asarinin)(Ⅶ)、麦角甾醇(Ergosterol)(Ⅷ)、2,6-二甲氧基对醌(2,6-dimethoxy-p-quinone)(Ⅸ),并采用MTT法检测所分离化合物对HT-29人结肠癌细胞和OVCA429卵巢癌细胞的抗增殖活性。
1提取分离
1.1仪器与试剂Jasco P-1020旋光计;JascoV-550型可见/紫外分光光度计;Perkin-Elmer-983型红外分光光度计(KBr压片法);VGZAB2F型质谱仪;AM-400型核磁共振仪;硅胶(200~300目)(青岛海洋化工厂),葡聚糖凝胶LH-20(法玛西亚生物技术AB公司)。所有溶剂都是分析纯(天津市大茂化工厂,天津,中国)。山芝麻,购于泉州市医药公司,经鉴定为梧桐科山芝麻的干燥根。
1.2实验操作取干燥山芝麻5 kg,粉碎,室温下以95%乙醇浸提24 h,回收乙醇得流浸膏,浸膏浓缩后以水溶解,分别用环己烷、乙酸乙酯和正丁醇萃取。乙酸乙酯部分(30 g)用硅胶柱,二氯甲烷-甲醇体系梯度洗脱(100∶1→2∶1)得到A,B,C,D四个部分。A部分用硅胶柱,二氯甲烷-甲醇(20∶1~5∶1)梯度洗脱得化合物Ⅰ(10 mg)、Ⅱ(7 mg)和Ⅲ(19 mg)。B部分用硅胶柱,石油醚-乙酸乙酯(10∶1~8∶1)梯度洗脱得化合物Ⅳ(20 mg)、Ⅴ(6 mg)、Ⅷ(17 mg)和Ⅸ(8 mg)。C部分用硅胶柱,石油醚-乙酸乙酯(5∶1~3∶7)梯度洗脱得Ⅵ(11 mg)和Ⅶ(15 mg)。
1.3实验结果化合物Ⅰ为白色粉末,易溶于氯仿。结合氢谱与碳谱数据与文献[6-7]报道确定该化合物为葫芦素B(cucurbitacin B),结构式见图1。
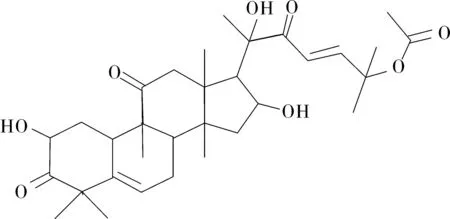
图1 葫芦素B结构式
化合物Ⅱ为白色粉末,易溶于氯仿。参照氢谱及碳谱的数据与文献[6-8]报道确定该化合物为葫芦素E(cucurbitacin E),结构式见图2。

图2 葫芦素E结构式
化合物Ⅲ为白色无定形粉末,三氯化铁-铁氰化钾为阳性,香荚兰醛显粉红色。光谱数据与文献[9]报道一致,故鉴定为迷迭香酸(rosmarinic acid),结构式见图3。
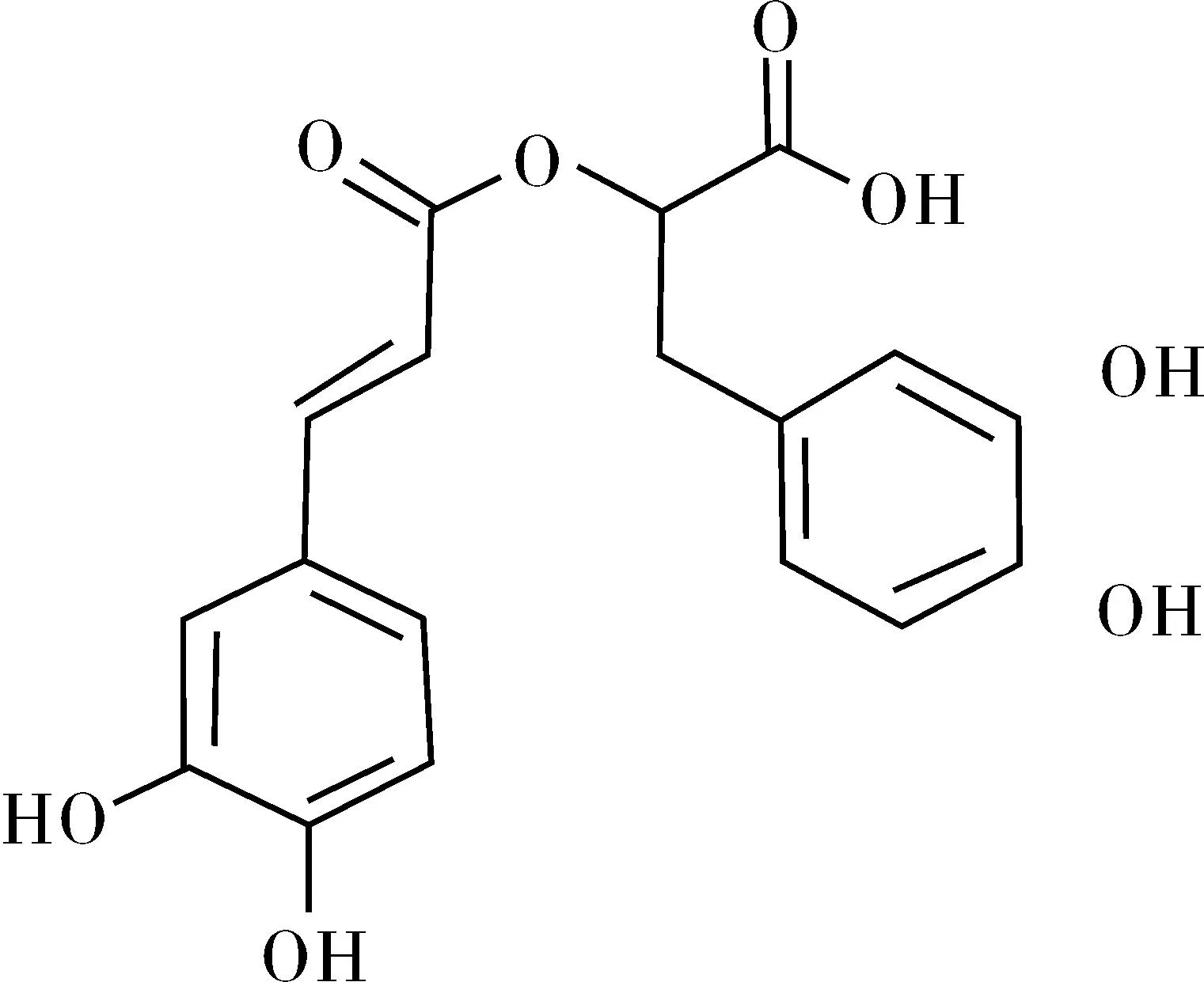
图3 迷迭香酸结构式
化合物Ⅳ:淡黄色胶状结晶。溶于乙酸乙酯、氯仿,微溶于甲醇,难溶水。薄层展开在紫外光下无荧光,5%浓硫酸显紫红色单斑。结合氢谱数据和碳谱数据与文献[10]记载,确定该化合物为十二硫醇(Dodecanethiol),结构式见图4。

图4十二硫醇结构式
化合物Ⅴ为无色针状结晶。易溶于氯仿难溶于水。Liebermann-Burchard反应阳性,10%浓硫酸显紫红色。与β-谷甾醇对照品TLC展开,在三种不同的展开系统中比较Rf值完全一致(石油醚∶乙酸乙酯=5∶1,Rf=0.4;石油醚∶丙酮=8∶1,Rf=0.51;氯仿∶乙酸乙酯=10∶1, Rf=0.45)。故确认该化合物为β-谷甾醇(β-sitosterol),结构式见图5。
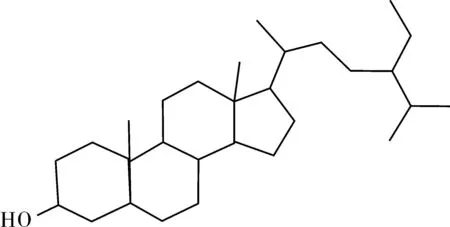
图5 β-谷甾醇结构式
化合物Ⅵ为黄绿色粉末状。可溶于氯仿,微溶于乙酸乙酯、丙酮、甲醇,不溶于石油醚、水。薄层在紫外光下无荧光,5%浓硫酸显紫红色单斑。Liebermann-Burchard反应呈阳性。其氢谱数据和碳谱数据与文献[11]记载一致,确定该化合物为乌苏酸(Ursolic acid),结构式见图6。
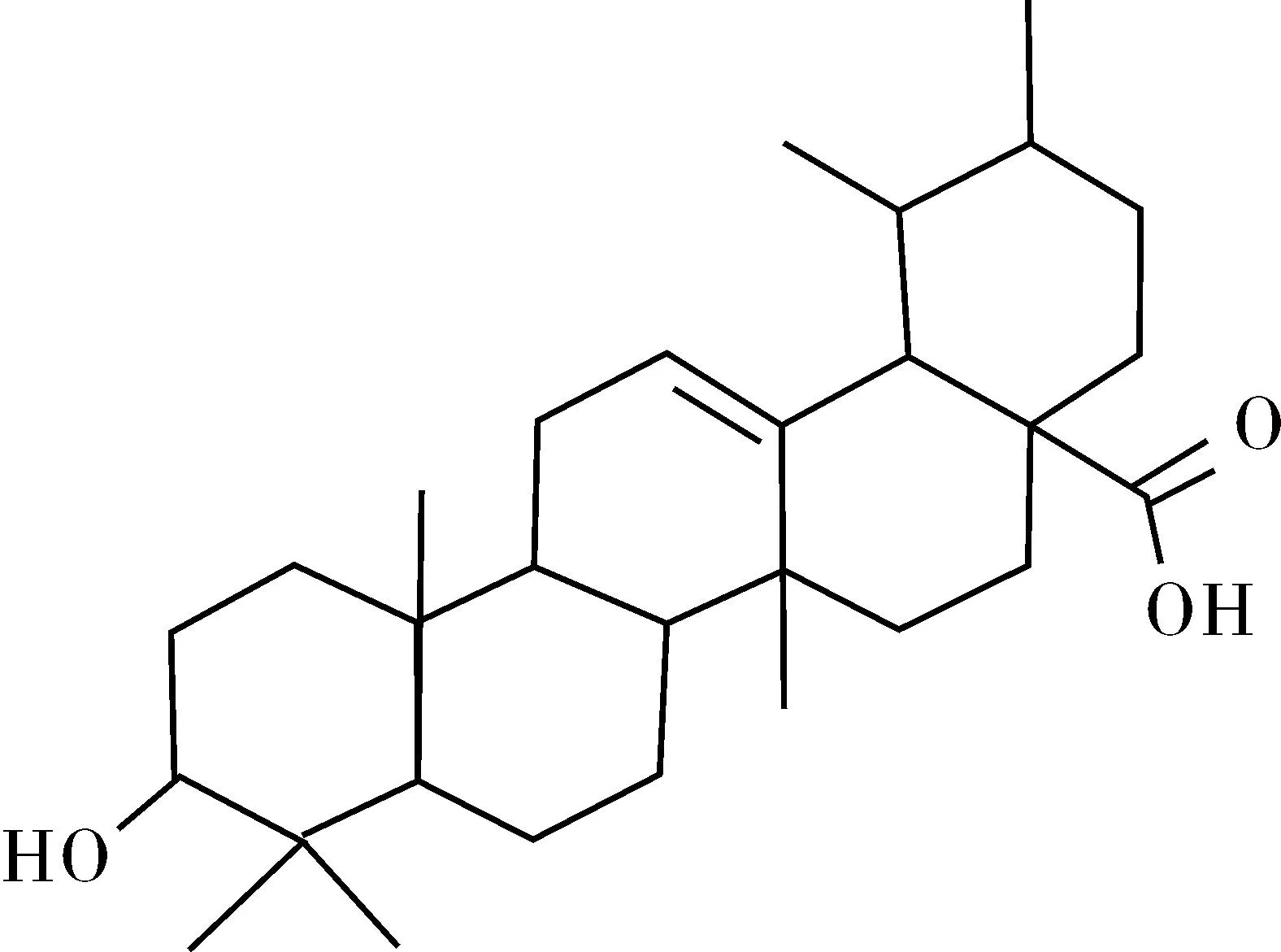
图6 乌苏酸结构式
化合物Ⅶ为无色块状结晶。可溶于氯仿、丙酮、甲醇,不溶于水。薄层在紫外光下无荧光,5%浓硫酸显紫红色单斑。结合光谱数据与文献[12]报道,化合物Ⅶ鉴定为细辛脂素(Asarinin),结构式见图7。
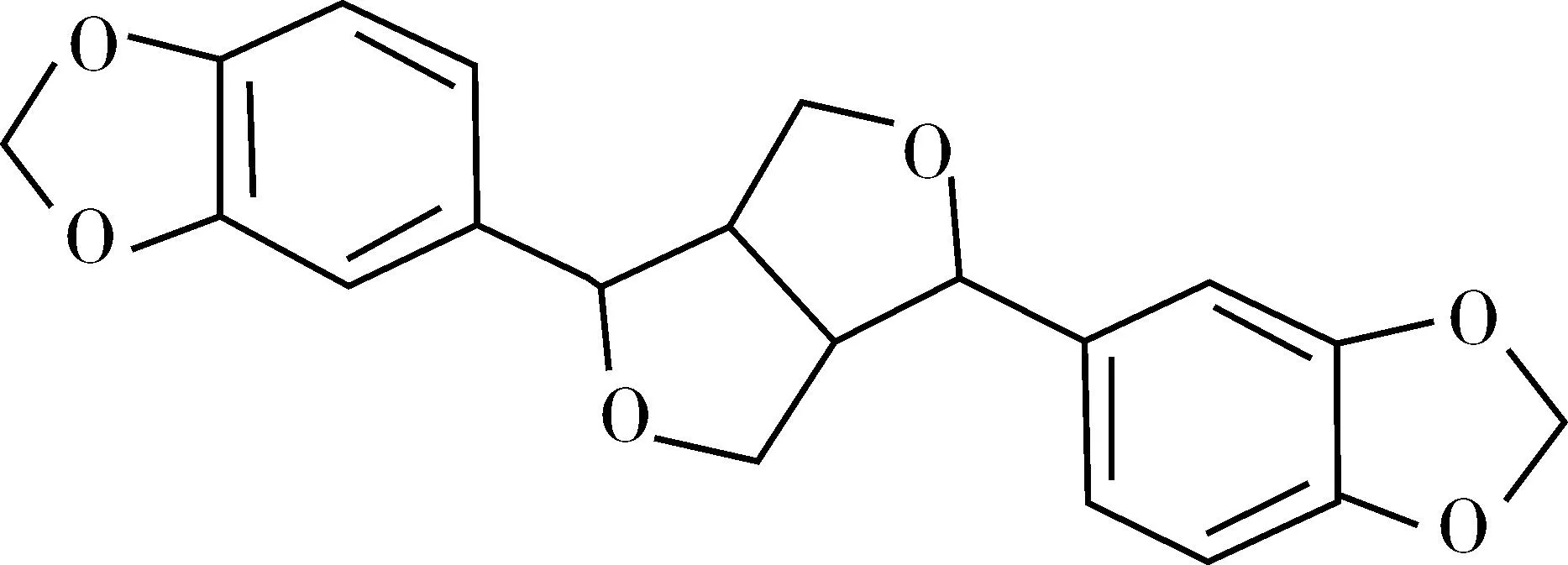
图7 细辛脂素结构式
化合物Ⅷ为无色针状晶体,Liebermann-Burchard反应呈墨绿色。经比较光谱数据[13]与麦角甾-5-烯-3β醇的光谱值一致。将该化合物与标准的麦角甾醇进行薄层层析对照,两者的Rf值一致,故鉴定该化合物为麦角甾醇(Ergosterol)。结构式见图8。
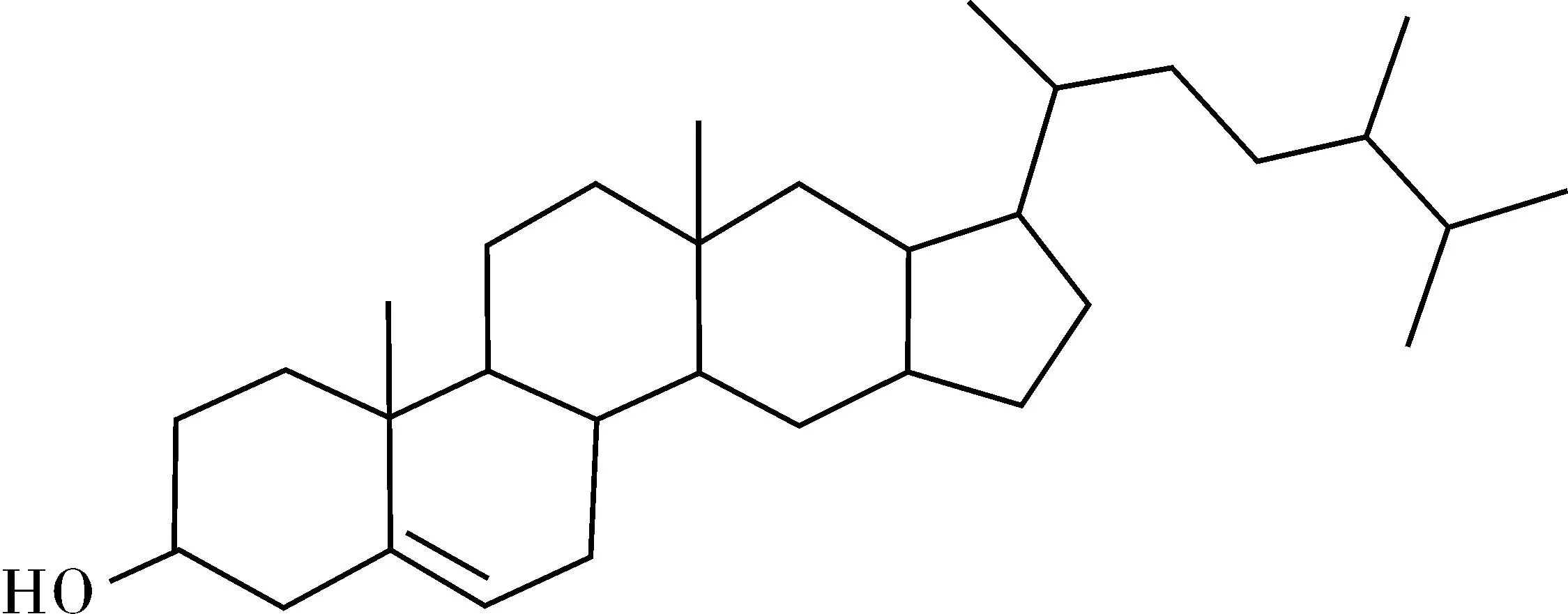
图8 麦角甾醇结构式
化合物Ⅸ为红色晶体。与文献[11]比较,该化合物与2,6-二甲氧基对醌的物理性质及碳谱和氢谱数据一致,由此鉴定该化合物为2,6-二甲氧基对醌。结构式见图9。
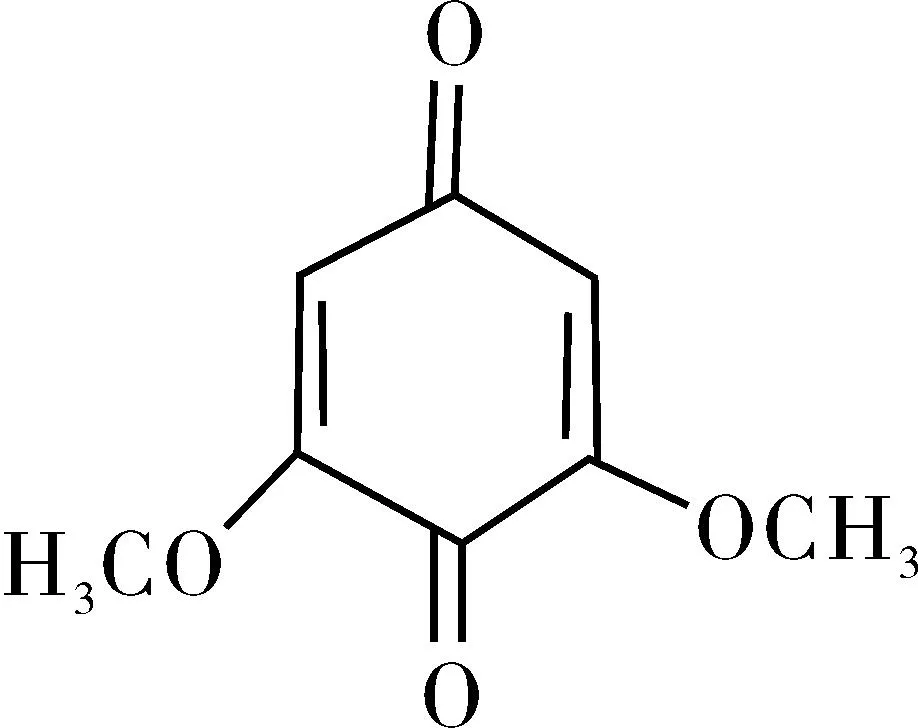
图9 2,6-二甲氧基对醌结构式
2药理实验
2.1体内实验
2.1.1荷瘤小鼠造模取腹腔接种S180生长良好的KM鼠,抽取其腹水,用无菌生理盐水按1∶3比例稀释成瘤细胞悬液,计活细胞率在95%以上。再用生理盐水调整瘤细胞密度为每毫升1×107个。共取60只平均体质量在(20.37±0.68)g的KM鼠进行种瘤,每只小鼠右前肢腋下皮下接种0.2 mL,整步操作尽量在1 h内完成。
2.1.2给药方法接种次日, 随机分成5组,每组12只,体重无明显差异。模型对照组灌胃每天定时给予等体积的蒸馏水;阳性对照组每天定时腹腔注射用环磷酰胺0.02 g·kg-1;山芝麻乙醇提取物按低、中、高剂量(0.1、0.25、0.5 g·kg-1)组分别灌胃,每日1次,连续8 d。最后一次给药的24 h后称重,颈椎脱臼处死小鼠。剪开肿瘤部位,完整剥离瘤块、胸腺和脾脏,用滤纸吸净血和液体,称取质量,计算抑瘤率、胸腺指数和脾脏指数。计算公式如下:
(公式1)
(公式2)
(公式3)
2.1.3结果计算得出结果如表1,低剂量组与中剂量组与环磷酰胺组之间的抑瘤率有显著差异,而高剂量组则无明显差异。由体质量、脾指数、胸腺指数变化分析发现,随着剂量增加,体质量、脾指数、胸腺指数均增加,而肿瘤质量在三个剂量组均呈现降低。
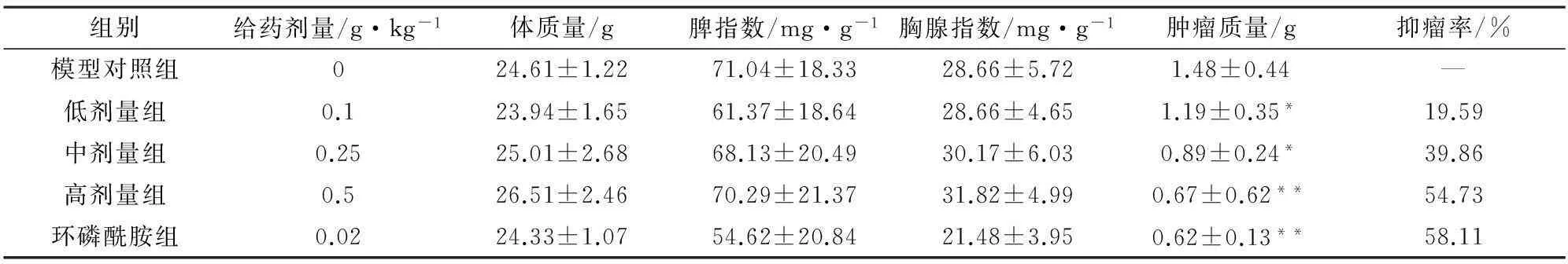
表1 体内抗肿瘤相关指标的对比分析
注:与模型对照组比较,*P<0.05,**P≤0.01。
2.2体外实验化合物的抗增殖效应通过MTT实验评价。实验采用人结肠癌细胞HT-29和卵巢癌细胞OVCA429(购于美国ATCC)。HT-29和OVCA 429细胞在含有10%胎牛血清(Hyclone)和抗生素(100 IU·mL-1的青霉素和100 g·L-1硫酸链霉素)的RPMI-1640培养基(Hyclone)中,于5%CO2、37℃的培养箱中培养。取对数生长期细胞调成适宜浓度的细胞悬液进行实验。
2.2.1细胞活力的测定4×104·mL-1HT-29细胞悬液和OVCA429细胞悬液分别接种在96孔板中,每孔加细胞悬液100 μL,5%CO2、37℃的培养箱中培养,至细胞完全贴壁后取出,弃去上清,加入药物。对照组:加入与加药组同量的DMSO和无血清RPMI-1640培养基、加药组:药物用DMSO溶解后,分别以无血清RPMI-1640培养基稀释,终浓度为6.25,12.5,25和50 μmol·L-1。每组设4个复孔,96孔板在5%CO2、37℃的培养箱中培养24 h后,每孔加入新配制的10 μL MTT(10 g·L-1)。37℃孵育4 h后吸掉培养基,每孔加入150 μL DMSO,震荡5 min,酶标仪测490 nm处测吸光度值。
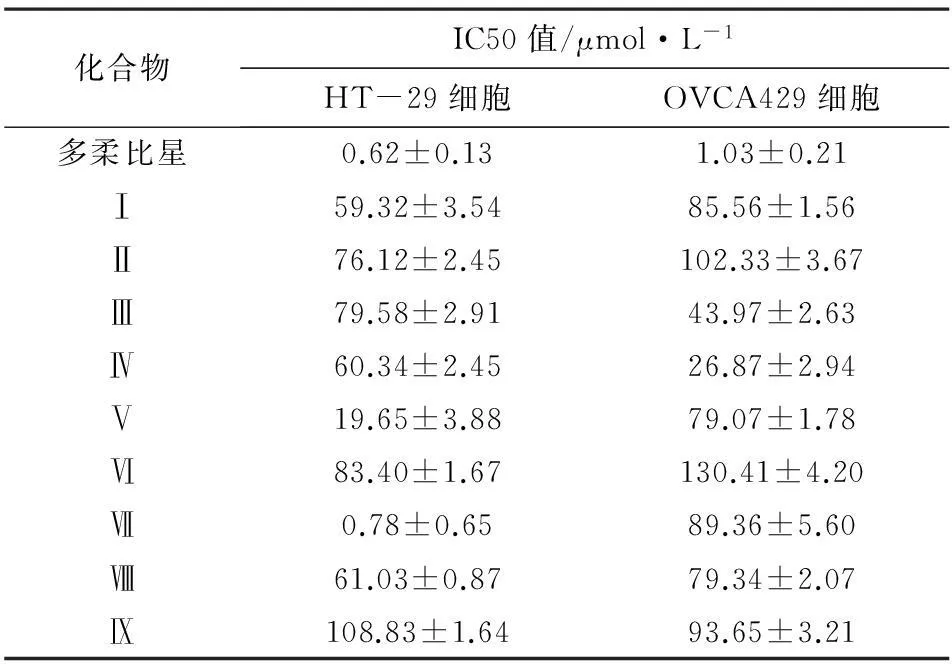
表2 体外实验各提取化合物的IC50值对比
2.2.2实验结果在MTT分析中,多柔比星作为阳性对照,对HT-29细胞的IC50为(0.62±0.13)μmol·L-1,对OVA429细胞的IC50值(1.03±0.21)μmol·L-1。化合物Ⅶ的IC50值显示对HT-29细胞有显著抗增殖作用,为(0.78±0.65)μmol·L-1,但对OVCA429细胞表现出微弱的抑制活性,IC50值仅为(89.36±5.60)μmol·L-1。化合物Ⅴ只有轻中度抑制,对HT-29细胞和OVCA429细胞的IC50值分别为(19.65±3.88)和(79.07±1.78)μmol·L-1。此外,化合物Ⅳ和Ⅲ对OVCA429细胞表现为轻度抑制活性,IC50值分别为(26.87±2.94)μmol·L-1和(43.97±2.63)μmol·L-1。其它化合物没有显示针对这两种人癌细胞系的抗增殖作用(IC50>100 μmol·L-1)。见表2。
3讨论
山芝麻为民间传统草药,其用途广,资源丰富。现代研究表明,山芝麻具有抗脂质过氧化,保护肝脏,抗丙型肝炎病毒,声带息肉,非特异性结肠炎,抗炎和镇痛等作用,是一味较好的治疗保健中药,具有广阔的开发前景。
虽然山芝麻医药市场的需求量很大,但其化学成分研究尚处于初步阶段,未建立有关活性成分的质量标准,化学成分的活性及毒性副作用还不清楚。鉴于此,我们应该扩大其化学成分、药理作用及临床应用的研究,提升药品质量、安全性评价,充分发挥其药用价值,从而开发民族医药资源,促进民族医药事业的发展。
参考文献:
[1]魏映柔,王国才,张晓琦,等.山芝麻化学成分[J].中国中药杂志,2011,36(9):1193-1197.
[2]方春生,杨燕军.酸浆苦素B的体外抗肿瘤活性研究[J].广州中医药大学学报,2015,32(4):652-655,660.
[3]黄必奎.山芝麻化学成分与药理作用研究概况[J].广西中医药大学学报,2013,30(2):129-131.
[4]Chen W,Tang W,Lou L,et al.Pregnane, coumarin and lupane derivatives and cytotoxic constituents from Helicteres angustifolia[J].Phytochemistry,2006,67(10):1041-1047.
[5]乔祎雪,牟伊,黄张建,等.新型CDDO-Me类似物的合成及抗肿瘤活性[J].中国药科大学学报,2015,46(3):289-293.
[6]高媛,宋联强,樊梅,等.马甲子叶提取物的抗肿瘤活性研究[J].华西药学杂志,2015,30(3):303-305.
[7]苏丹,高玉桥,黄增芳,等.山芝麻挥发油成分的GC-MS分析[J].中国药房,2011,22(23):2173-2174.
[8]刘向辉,李鑫,赵兵,等.山芝麻属药学研究概况[J].辽宁中医药大学学报,2012,14(10):119-121.
[9]王志强,张秀英,李文广,等.异甘草素抗肿瘤活性及初步机制研究[J].中国药理学通报,2015,31(8):1159-1165.
[10] Guo XD,Huang ZS,Bao YD,et al.Two new sequiterpenoids from Helicteres angustifolia[J].Chinese Chemical Letters,2005,1:49-52.
[11] 郭新东,安林坤,徐迪,等.中药山芝麻的化学成分研究(Ⅰ)[J].中山大学学报(自然科学版),2003,42(2):52-55.
[12] 黄必奎.山芝麻化学成分与药理作用研究概况[J].广西中医药大学学报,2013,16(2):129-131.
[13] 高玉桥,苏丹,张泳义,等.山芝麻三萜类化合物抗UC多靶点作用的分子对接研究[J].时珍国医国药,2014,25(6):1369-1371.
Studies on chemical constituents and their anti-tumor activities
in roots ofHelicteresangustifolia
JIN Xiao-qin,PANG Su-qiu
(The180thHospitalofPLA,Quanzhou,Fujian362000,China)
Abstract:ObjectiveTo study the chemical constituents and the anti-tumor activity in roots ofHelicteresangustifolia(HA). MethodsSilica gel column chromatography, preparative thin layer chromatography and other chromatographic methods were used to isolate the compounds from HA spectral and thin layer methods were used to identify the compound structures.Effects of these compounds on the proliferations of HT-29 cells and OVCA-429 cells were tested by MTT method.180 mice tumor model was established to observe anti-tumor activity in vivo of HA extracts.ResultsCucurbitacin B (I), cucurbitacin E (II), rosmarinic acid (III), dodecanethio(IV), β-sitosterol(V), ursolic acid (VI), asarinin (VII), ergosterol (VIII) and 2,6-dimethoxy-p-quinone (IX) were isolated from HA.Compound VII showed a significant inhibitory activity on HT-29 cells and a weak inhibitory activity on OVCA429 cells. Compound V showed little inhibitory activity on HT-29 cells and OVCA429. In addition, the compounds IV and III only showed mild inhibitory activity on OVCA429 cells. ConclusionSome of the compounds in HA have significant anti-tumor activity, which is worthy of further study.
Key words:Helicteresangustifolia;chemical constituents;anti-tumor activity
收稿日期:(2015-07-24,修回日期:2015-10-09)
doi:10.3969/j.issn.1009-6469.2016.01.009

