Maoecrystal V的全合成研究进展
杨 璐, 黄瑞磊, 王志松, 余聂芳
(中南大学 药学院 分子设计与药物发现研究所,湖南 长沙 410013)
·综合评述·
Maoecrystal V的全合成研究进展
杨璐, 黄瑞磊, 王志松, 余聂芳*
(中南大学 药学院 分子设计与药物发现研究所,湖南 长沙410013)
摘要:综述了Maoecrystal V的4种全合成方法,并对其发展前景进行了展望。参考文献30篇。
关键词:Maoecrystal V; 核心骨架; 全合成; 综述
通信联系人: 余聂芳,教授,博士生导师, E-mail: niefang_yu@126.com
Maoecrystal V(MV, Chart 1)是孙汉董院士从毛萼香茶菜中分离出的一种贝壳杉烷二萜[1]。MV的骨架结构与含19个碳原子的6,7-seco-enf-贝壳杉烷二萜类似,具有并环,螺环,桥环,内酯环,四氢呋喃环以及6个手性中心,其中2个为连续手性季碳。MV对HeLa细胞系具有较强的选择性和细胞毒性(IC50=60 nM)[2]。
MV特殊的化学结构和良好的生物活性受到有机化学家的密切关注,其全合成一直是有机合成的热点之一。目前,已有4个课题组完成了MV的全合成[3-8]。构建MV的核心骨架的关键步骤为在合适位点进行Diels-Alder反应。杨震教授课题组通过在C8, C9, C13, C14进行分子内Diels-Alder反应,首次完成了MV核心骨架全合成。Danishefsky课题组采用类似的方法成功构建了MV的关键骨架,但后续官能团转换时步骤较多,合成路线较长,收率较低。Zakarian课题组通过在C9, C11, C12, C13进行分子内Diels-Alder反应构建MV的核心骨架,收率也较低。Thomson课题组在构建骨架时改用C15和C16为位点进行分子间Diels-Alder反应,最终以相对较高的收率完成了MV的立体选择性全合成。
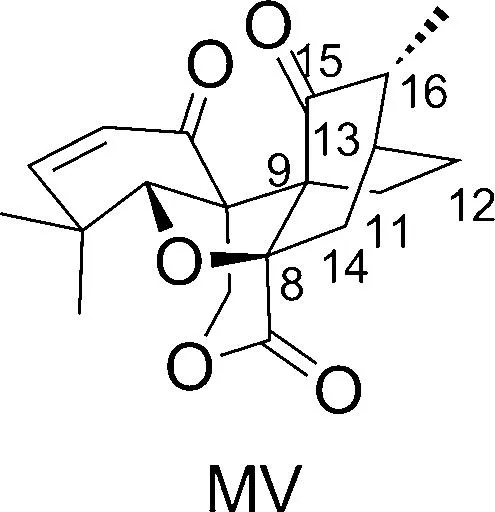
Chart 1
本文围绕4个课题组对MV的全合成工作做了综述和评价,并对MV的进一步研究做了展望。
1MV的合成
1.1杨震教授课题组的合成策略
杨震教授于2009年首先报道了MV核心骨架的合成方法[9],次年,报道了MV的全合成方法。即以2,2-二甲基-3-烯环己酮(1)为起始原料,经三步反应制得二环化合物(4)[10]; 4经还原反应制得5; 5与羧酸(6)在EDCI催化下发生酯化反应后再通过重氮化反应制得重氮化衍生物(7); 7在Rh2(OAc)4催化下经卡宾反应得三环化合物(8)[11-12]; 8经3步反应得9; 9经分子内Diels-Alder反应得含MV四环核心骨架的重要前体10; 10在C1经过2步反应实现官能团转化得12; 12在C16继续进行官能团转化反应,最终合成了MV(Scheme 1)[13]。
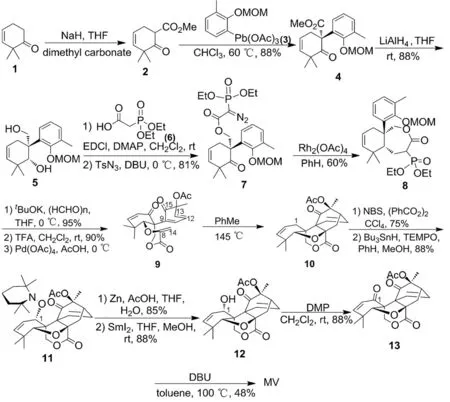
Scheme 1
10的合成为该路线的关键步骤。MV的整个合成路线历经16步反应,总收率2.6%[14]。该方法对MV类似物的全合成有重要的参考价值。Diels-Alder反应也成为构建MV核心骨架的关键步骤。在此基础上,杨震课题组继续进行了MV的全合成研究。最终通过18步反应完成了MV的全合成,总收率1.3%。合成方法与之前大同小异,虽收率有所降低,但对MV衍生物的合成及其构效关系研究有重要意义[11]。近年来,杨震课题组又报道了MV的立体选择性全合成,其基本方法也是沿袭上述思路,但是为了立体选择性的合成目标化合物,Semipinacol 重排反应成为关键步骤,重要中间体5的ee值高达99%。利用Semipinacol 重排反应合成(-)-MV的方法对该类化合物的立体选择性合成有重要的参考价值[15]。
1.2Danishefsky教授课题组的合成策略
2012年,Danishefsky教授课题组报道了MV的全合成方法。该方法以14和15为起始原料,经取代反应合成16; 16经两步反应进行官能团转化得17; 17与18发生酯化反应得中间体19[16]; 19发生分子内Diels-Alder反应,脱去硅醚保护基制得含四环核心骨架的20;通过选择性氧化20的双键制得环氧化合物(21)[17]; 21在MgI2作用下断开环氧键,自由基脱碘和选择性环氧化制得23; 23的C8羟基进攻环氧键得24; 24的C5醚键异构化得五环核心骨架化合物(25); 25的C15依次经MOM保护,环氧化,DMP氧化和碱性开环得α,β-不饱和酮(28); 28在碱性条件下与苯硫酚发生Michael加成反应后被NaBH4还原得29; 29被Raney-Ni还原脱去苯硫基,经甲磺酰化反应后在碱性条件下脱去OMs形成双键,同时脱除乙酰基得醇(30); 30在DMDO和BF3·OEt2作用下发生环氧化重排反应得酮(31),完成C5醚键的构型翻转;31与Lombardo试剂反应得32; 32发生Simmons-Smith环丙烷化反应得33; 33在PCC作用下脱去MOM,两个羟基氧化成二酮得.34;34在PTO2作用下催化氢化还原为谐二甲基化合物(35); 35与Lombardo试剂发生选择性烯化反应得36; 36在酸作用下发生双键重排得37; 37发生Saegusa氧化反应得不饱和酮(38); 38在TFDO作用下发生环氧化反应得差向异构体(39); 39在BF3OEt2作用下发生重排反应合成了MV(Scheme 2)[18]。

Scheme 2
Danishefsky教授课题组以分子内Diels-Alder反应为关键步骤构筑了含MV基本骨架的20,然后对20进行结构修饰合成了MV。该方法由于有大量的异构化和官能团转化反应,因此合成路线比较长(32步)[18]。虽然Danishefsky教授课题组的合成方法看似比较繁琐,尤其是在构建核心骨架的过程中涉及大量官能团转化反应,但该方法对MV的全合成仍有重要意义。
1.3Zakarian教授课题组的合成策略
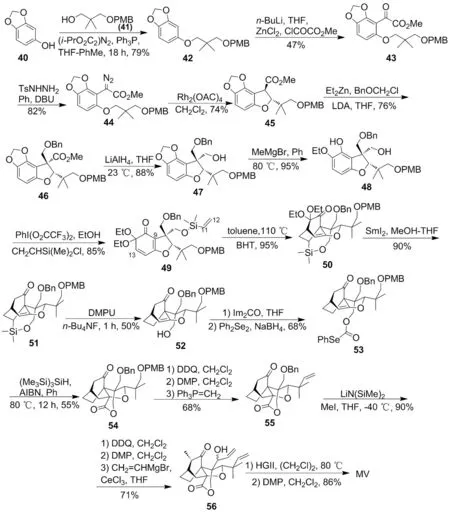
Scheme 3
2013年,Zakarian教授课题组报道了MV的全合成研究。在此之前,Zakarian课题组已经报道了MV核心骨架的合成[19]。Zakarian课题组以芝麻酚(40)为起始原料,与41反应生成42[20]; 42依次经傅克反应和重氮化反应得44; 44在Rh2(OAc)4催化下发生碳氢官能团化反应生成苯并呋喃类化合物(45); 45依次发生烷基化反应和酯基还原反应得47;用甲基溴化镁格式试剂进攻47的胡椒基得48; 48在PhI(OCOCF3)2作用下发生氧化去芳构化反应后,在碱性条件下与CH2=CHSi(Me)2Cl发生硅酸化反应制得Diels-Alder反应前体化合物49;以BHT为阻聚剂,49发生分子内Diels-Alder反应制得到二环[2.2.2]辛烷骨架化合物50; 50在二碘化钐作用下脱除两个乙氧基后再脱去硅醚得52[21]; 52通过官能团转化反应得53; 53在(Me3Si)3SiH/AIBN作用下发生自由基环化反应得四环核心骨架化合物(54); 54经7步反应得重要的二烯化合物(56)[22]; 56发生分子内RCM反应后用DMP氧化合成了MV(Scheme 3)[23]。
Zakarian课题组在合成MV时,首先构建了MV的三环结构,然后以金属催化的官能团转化反应,氧化去芳构化反应,分子内Diels-Alder反应和RCM反应为主要方法,最终以1.5%的总收率完成了MV的全合成[23]。该方法虽仍以分子内Diels-Alder反应作为构建核心骨架的关键方法,但又有所区别。即在合成的最后一步通过RCM反应才完整构建了环系。该方法的不足之处在于反应步骤过长,总收率较低,但丰富了MV的全合成方法。2014年,Zakarian课题组报道了用铑催化的不对称碳氢官能团化反应,经26步反应首次立体选择性合成了(-)-MV,总收率0.21%[24]。
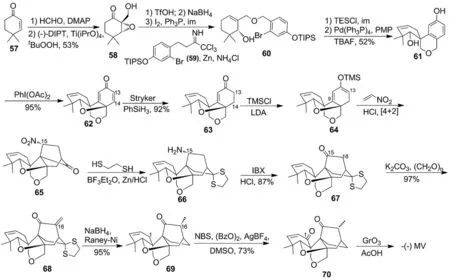
Scheme 4
1.4R J Thomson教授课题组的合成策略
2014年,R J Thomson教授课题组报道了基于MV核心骨架合成方法的(-)-MV立体选择性全合成[25]。以57为起始原料,在DMAP作用下先与甲醛反应,再发生Sharpless环氧化反应得58[26]; 58经3步反应后与59发生取代反应得60; 60发生分子内Heck反应得三环化合物(61); 61通过氧化去芳构化得环氧化合物(62); 62在Stryker催化条件下还原C13和C14间的双键得63[27]; 63与LDA/TMSCl反应得64; 64与硝基乙烯发生[4+2]Diels-Alder环合反应得单一立体构型的化合物(65); 65通过还原硝基和羰基保护得66[28]; 66通过官能团转化反应先将C15的氨基转化为羰基,然后经乙烯基化反应和Raney-Ni还原得69; 69通过选择性氧化烯丙基位,将C1氧化为羰基得70; 70通过选择性氧化惰性碳氢键合成了(-)-MV(Scheme 4)[29]。
R J Thomson教授课题组在立体选择性合成(-)-MV的过程中,关键反应步骤包括分子内Heck反应,不对称环氧化反应,Diels-Alder环合反应以及惰性碳氢键的氧化反应。整个反应步骤缩短至18步[30]。该方法的最大优点是,前期就通过Sharpless不对称环氧化反应确定了最终产物的单一构型,并在成环时利用分子内Heck反应使核心骨架的构筑简单化。该反应路线为类似手性天然产物的不对称合成提供了借鉴。
2展望
随着MV全合成方法研究的深入,合成步骤明显缩短,收率不断提高。但如何简便有效地构筑此类天然产物的碳骨架仍充满挑战。发展更多巧妙新颖、经济实用的合成路线,并以MV为先导化合物开发出新的药物分子,是MV全合成研究下一步关注的重点。
参考文献
[1]Li S, Wang J, Niu X M. Maoecrystal V,cytotoxic diterpenoid with a novel C19 skeleton from isodon eriocalyx (Dunn.) hara[J].Org Lett,2004,11,6(23):4327-4330.
[2]Zhang W B, Shao W B, Li F Z,etal. Asymmetric total synthesis of (-)-Maoecrystal V[J].Chem Asian J,2015,10(9):1874-1880.
[3]Baitinger I, Mayer P, Trauner D.Toward the total synthesis of maoecrystal V: establishment of contiguous quaternary stereocenters[J].Org Lett,2010,Dec 17;12(24):5656-5659.
[4]Krawczuk P J, Schöne N, Baran P S. A synthesis of the carbon skeleton of maoecrystal V[J].Org Lett,2009,11(21):4774-4776.
[5]Dong L, Deng L, Lim Y H,etal. Synthesis of an advanced maoecrystal V core structure[J].Chemistry-A European Journal,2011,17(21):5778-5781.
[6]Dong L, Deng L J, Lim Y H,etal. Synthesis of an advanced Maoecrystal V core structure[J].Chemistry-A European Journal,2011,17(21):5778-5781.
[7]Nicolaou K C, Dong L, Deng L J,etal. Synthesis of functionalized maoecrystal V core structures[J].Chemical Communications,2010,46(1):70-72.
[8]Carberry P, Viernes D R, Choi L B,etal. An unusual intramolecular Diels-Alder approach toward maoecrystal V[J].Tetrahedron Letters,2013,4:1734-1737.
[9]Gong J, Lin G, Li C C,etal. Synthetic study toward the total synthesis of maoecrystal V[J].Org Lett,2009,11(21):4770-4773.
[10]Krief A L, Jeanmart G. Isomerisation of 2,2-dimethyl dimedone to (d,l)cis-chrysanthemic acid[J].Tetrahedron Lett,2000,41:3871.
[11]Mller D J, Moody C. Synthetic applications of the O-H insertion reactions of carbenes and carbenoids derived from diazocarbonyl and related diazo compounds[J].Tetrahedron,1995,51:10811.
[12]Edwards M G, Kenworthy M N, Kitson R R,etal. The preparation ofα-alkylidene-γ-butyrolactones using a telescoped intramolecular michael/olefination (TIMO) sequence:Synthesis of (+)-paeonilactone B[J].Eur J Org Chem,2008:4769-4783
[13]Gong J, Lin G, Sun W,etal. Total synthesis of (±)-Maoecrystal V[J].J Am Chem Soc,2010,132(47):16745-16746
[14]Zhang W B, Lin G, Shao W B,etal. Total synthesis of Maoecrystal V[J].ChemAsian J,2015,10(4):903-909.
[15]Zhang W B, Shao W B, Li F Z,etal. Asymmetric total synthesis of (-)-Maoecrystal V[J].Chem Asian J,2015,10(9):1874-1880.
[16]Danishefsky S J, Morris J, Mullen G,etal. Toward the total synthesis of maoecrystal V:An intramolecular Diels-Alder route to the maoecrystal V[J].J Am Chem Soc,1982,104:7591-7599.
[17]Danishefsky S J, Harayama T, Singh R K. Use ofβ-phenylsulfinyl-α,β-unsaturated carbonyl dienophiles in Diels-Alder reactions[J].J Am Chem Soc,1979,101:7008-7012.
[18]Peng F, Danishefsky S J. Total synthesis of (±)-Maoecrystal V[J].J Am Chem Soc,2012,134(45):18860-18867
[19]Gu Z, Zakarian A. Studies toward the synthesis of Maoecrystal V[J].Org Lett,2011,13(5):1080-1082.
[20]J E Green, D M Bender, S Jackson,etal. Mitsunobu approach to the synthesis of optically activeα,α-disubstituted amino acids[J].Org Lett,2009,11(4):807-810.
[21]Davies K A, Wulff J E. Marrying iterative synthesis to cascading radical cyclization:6-endo/5-exo radical cascade across bis-vinyl ethers[J].Org Lett,2011,13:5552-5555.
[22]Imamoto, Takiyama T, Nakamura N K,etal. Reactions of carbonyl compounds with grignard reagents in the presence of cerium chloride[J].J Am Chem Soc,1989,111:4392-4398.
[23]Lu P, Gu Z, Zakarian A. Total synthesis of maoecrystal V:Early-stage C-H functionalization and lactone assembly by radical cyclization[J].J Am Chem Soc,2013,135(39):14552-14555.
[24]Lu P, Mailyan A, Gu Z,etal. A enantioselective synthesis of (-)-Maoecrystal V by enantiodetermining C-H functionalization[J].J Am Chem Soc,2014,136(51):17738-17749.
[25]Lazarski K, Hu D X, Stern C L,etal. A synthesis of the carbocyclic core of Maoecrystal V[J].Org Lett,2010,12(13):3010-3013.
[26]Nagasawa, Shimada T, Torihata N,etal. Enantioselective total synthesis of idesolide via NaHCO3-promoted dimerization[J].Tetrahedron 2010,66:4965-4969.
[27]Lipshutz B H, Keith J, Papa P,etal. Convenient,efficient method for conjugate reductions using catalytic quantities of Cu(I)[J].Tetrahedron Lett,1998,39:4627-4630.
[28]Nicolaou K C, Mathison C J N, Montagnon T. New reactions of IBX:Oxidation of nitrogen- and sulfur-containing substrates to afford useful synthetic intermediates[J].Angew Chem Int Ed,2003,42:4077-4082.
[29]Gutekunst W R, Baran P S. C-H functionalization logic in total synthesis[J].Chem Soc Rev,2011,40:1976-1991.
[30]Zheng C, Dubovyk I, Thomson R J. Enantioselective total synthesis of (-)-Maoecrystal V[J].J Am Chem Soc,2014,136(51):17750-17756.
Research Progress on Total Synthesis of Maoecrystal V
YANG Lu,HUANG Rui-lei,WANG Zhi-song,YU Nie-fang*
(School of Pharmacy, Institute of Molecular Design and Drug Discovery,
Central South University, Changsha 410013, China)
Abstract:Four total synthesis methods and the development of Maoecrystal V were reviewed and prospected with 30 references.
Keywords:Maoecrystal V; core structure; total synthesis; review
作者简介:杨璐(1991-),男,汉族,甘肃天水人,硕士研究生,主要从事抗癌药物的研究。 E-mail: yaleyang12345@126.com
基金项目:国家自然科学基金资助项目(81573297)
收稿日期:2015-11-01;
修订日期:2015-12-15
中图分类号:O625; O626
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.02.15369

