新型二(取代苯基亚甲基)丙酮的合成
高复兴, 王囡囡, 郭 鹏, 王用红, 薛灵芬
(河南信阳师范学院 化学化工学院,河南 信阳 464000)
·研究简报·
新型二(取代苯基亚甲基)丙酮的合成
高复兴*, 王囡囡, 郭鹏, 王用红, 薛灵芬
(河南信阳师范学院 化学化工学院,河南 信阳464000)
摘要:以稀碱为催化剂,取代苯甲醛或取代水杨醛分别与丙酮于室温经Claisen-Schmidt缩合反应合成了10个新型的二(取代苯基亚甲基)丙酮化合物(2a~2j),其结构经1H NMR, IR, ESI-MS和元素分析表征。
关键词:取代苯甲醛; 取代水杨醛; 二(取代苯基亚甲基)丙酮; Claisen-Schmidt缩合; 合成
姜黄素(Ⅰ, Chart 1)是一种二酮结构的橙黄色色素,临床常用于降血脂、抗肿瘤、抗菌消炎、抗氧化、镇痛、利胆和预防老年痴呆等[1-2]。但Ⅰ活性较低、水溶性较差、人体内代谢较快等缺点严重影响其疗效[3]。刘鹰翔等[4]发现,通过移除1-位亚甲基和2(3)-位羰基得到的对称α,β-不饱和酮与Ⅰ药性相近,药效更高。为此,研究人员们设计并合成了多种Ⅰ的类似物,并研究了其活性[5-6]。
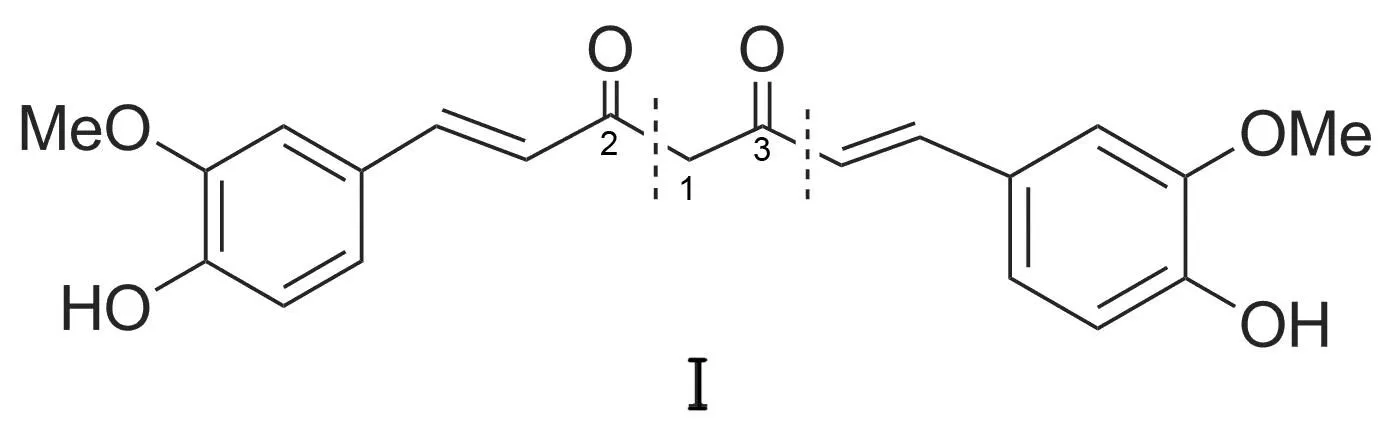
Chart 1
目前,合成Ⅰ的类似物所用原料主要为五元、六元碳环酮,杂环酮,丙酮和3,4,5-位取代芳醛[7-8]。合成方法主要是以水和乙醇为溶剂,稀碱或浓盐酸为催化剂的Claisen-Schmidt缩合反应。初步的构效关系表明:芳环取代基种类与位置是决定药物活性的关键因素;取代基吸电子或给电子能力增强、对位为弱给电子基,抗肿瘤活性增强。此外,酚羟基是Ⅰ的类似物具有自由基清除能力的必需基团[9-10]。
本文以稀碱为催化剂,取代苯甲醛(1a~1e)或取代水杨醛(1f~1j)分别与丙酮于室温经Claisen-Schmidt缩合反应合成了10个新型的二(取代苯基亚甲基)丙酮化合物[2a~2j, (2f~2j不经羟基保护直接合成)](Scheme 1),其结构经1H NMR, IR, ESI-MS和元素分析表征。
1实验部分
1.1仪器与试剂
WRS-1A型熔点仪(温度未校正);AVANCE AV-500 MHz型核磁共振仪(氘代丙酮为溶剂,TMS为内标);Thermo Scientific Nicolet iS50型红外光谱仪;Micromass Q-TOF型质谱仪;Elementar Vario EL Ⅲ型元素分析仪。
1a~1f, 1h~1j,含量≥98%;其余所用试剂均为分析纯或化学纯。
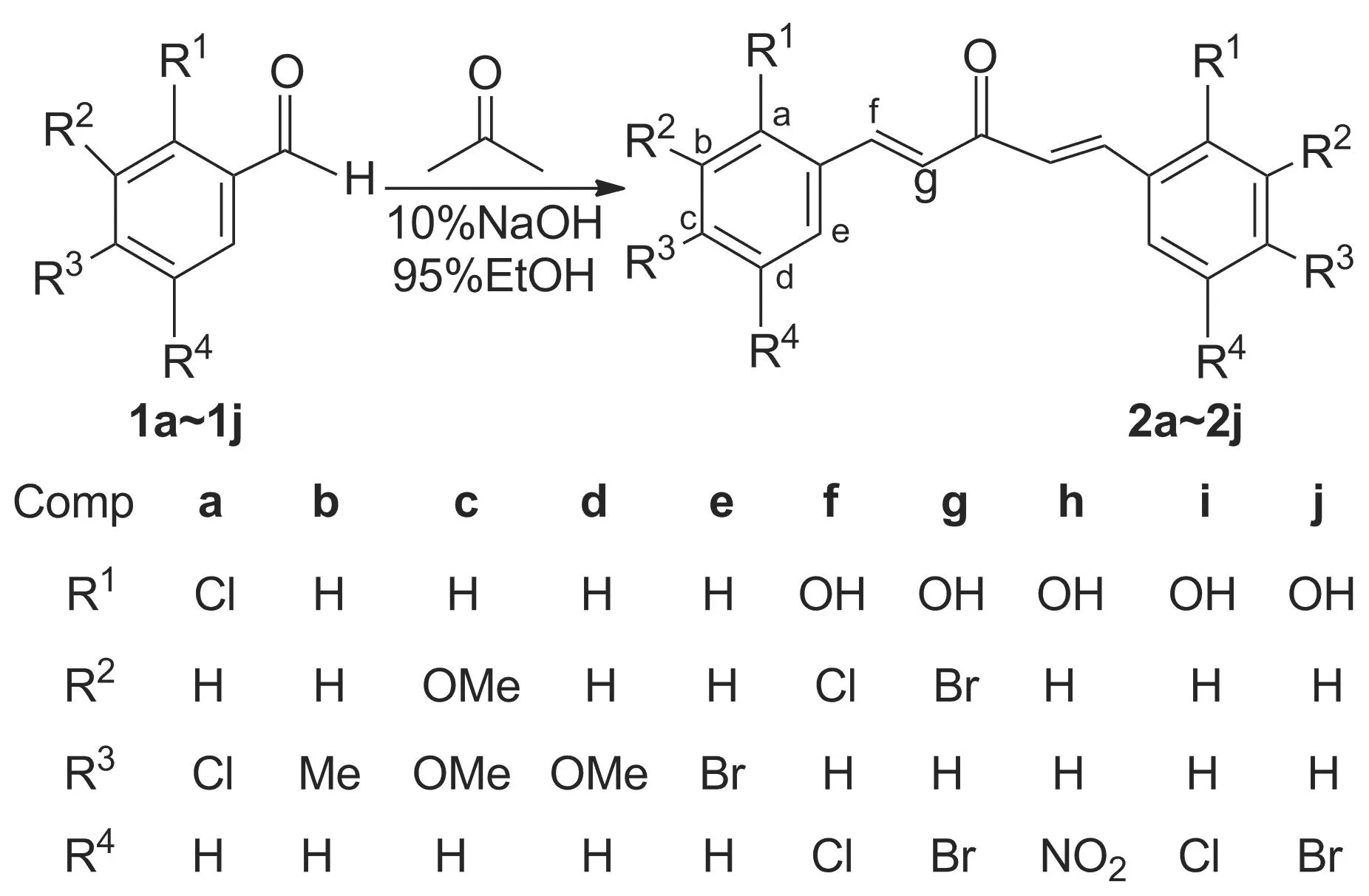
Scheme 1
1.2合成
(1) 2a~2e的合成(以2a为例)
在反应瓶中依次加入2,4-二氯苯甲醛(1a) 1.750 g(10 mmol),丙酮0.290 g(5 mmol), 95%乙醇20 mL和10%氢氧化钠溶液10 mL,搅拌下于室温反应2 h。静置片刻,抽滤,滤饼用冷水(3×10 mL)洗涤,干燥,用混合溶剂A[V(冰醋酸)/V(95%乙醇)=1/25]浸泡,抽滤,滤饼依次用混合溶剂A(2×8 mL)和冷水(2×10 mL)洗涤,干燥后用混合溶剂B[V(无水乙醇)/V(丙酮)=2/1, 2×90 mL]重结晶得2a。
以1b~1e替代1a,用类似方法合成2b~2e。
二(2,4-二氯苯基亚甲基)丙酮(2a): 淡黄色晶体,收率82.2%, m.p.167~169 ℃;1H NMRδ: 7.35(d,J=15.95 Hz, 2H, g-H), 7.48(dd,J=8.55 Hz, 1.10 Hz, 2H, d-H), 7.62(s, 2H, b-H), 7.99(d,J=8.50 Hz, 2H, e-H), 8.06(d,J=15.95 Hz, 2H, f-H); IR ν: 3 055, 1 653, 1 618, 1 583, 1 550, 1 470 cm-1; ESI-MSm/z: 372[M+]; Anal.calcd for C17H10OCl4: C 54.88, H 2.71; found C 54.49, H 2.82。
二(4-甲基苯基亚甲基)丙酮(2b): 黄色针状晶体,收率78.5%, m.p.176~178 ℃;1H NMRδ: 2.37(s, 6H, c-CH3), 7.24(d,J=16.00 Hz, 2H, g-H), 7.27(d,J=7.80 Hz, 4H, b,d-H), 7.63(d,J=7.90 Hz, 4H, a,e-H), 7.75(d,J=16.00 Hz, 2H, f-H); IRν: 3 026, 1 645, 1 620, 1 585, 1 567, 1 510 cm-1; ESI-MSm/z: 262[M+]; Anal.calcd for C19H18O: C 86.99, H 6.92; found C 86.85, H 7.08。
二(3,4-二甲氧基苯基亚甲基)丙酮(2c): 橙黄色针状晶体,收率75.0%, m.p.79~81 ℃;1H NMRδ: 3.87(s, 6H, c-OCH3), 3.89(s, 6H, b-OCH3), 7.01(d,J=8.30 Hz, 2H, d-H), 7.15(d,J=15.90 Hz, 2H, g-H), 7.27(dd,J=8.26 Hz, 1.60 Hz, 2H, e-H), 7.36(d,J=1.50 Hz, 2H, a-H), 7.69(d,J=15.85 Hz, 2H, f-H); IRν:3 007, 1 619, 1 597, 1 581, 1 511, 1 467 cm-1; ESI-MSm/z: 354[M+]; Anal.calcd for C21H22O5: C 71.17, H 6.26, found C 71.25, H 6.48。
二(4-甲氧基苯基亚甲基)丙酮(2d): 淡黄色晶体,收率70.6%, m.p.128~130 ℃;1H NMRδ: 3.86(s, 6H, c-OCH3), 7.01(d,J=8.70 Hz, 4H, b,d-H), 7.14(d,J=15.90 Hz, 2H, g-H), 7.68~7.73(m, 6H, a,e,f-H); IRν: 3 036, 1 630, 1 597, 1 574, 1 509, 1 468 cm-1; ESI-MSm/z: 294[M+]; Anal.calcd for C19H18O3: C 77.53, H 6.16; found C 77.51, H 6.22。
二(4-溴苯基亚甲基)丙酮(2e): 淡黄色晶体,收率62.4%, m.p.207~209 ℃;1H NMRδ: 7.33(d,J=16.05 Hz, 2H, g-H), 7.64(d,J=8.40 Hz, 4H, a,e-H), 7.71(d,J=8.45 Hz, 4H, b,d-H), 7.76(d,J=16.10 Hz, 2H, f-H); IRν: 3 050, 1 648, 1 592, 1 581, 1 486 cm-1; ESI-MSm/z: 392[M+]; Anal.calcd for C17H12OBr2: C 52.08, H 3.08; found C 51.87, H 2.94。
(2) 2f~2j的合成(以2f为例)
在反应瓶中依次加入1f 1.910 g(10 mmol),丙酮0.290 g(5 mmol), 95%乙醇15 mL和10%氢氧化钠溶液15 mL,搅拌下于室温反应2 h。用18%盐酸调至pH 5~6,置冰箱中静置结晶,抽滤,滤饼依次用冷水(3×10 mL)和95%乙醇(2×8 mL)洗涤,干燥后用混合溶剂B(2×90 mL)重结晶得2f。
以1g~1j替代1f,用类似方法合成2g~2j。
二(2-羟基-3,5-二氯苯基亚甲基)丙酮(2f): 淡黄色晶体,收率81.8%, m.p.209~211 ℃;1H NMRδ: 7.41(d,J=16.10 Hz, 2H, g-H), 7.51(d,J=2.30 Hz, 2H, c-H), 7.75(d,J=2.15 Hz, 2H, e-H), 8.02(d,J=16.05 Hz, 2H, f-H), 8.99(s, 2H, a-OH); IRν: 3 431, 3 284, 3 078, 1 674, 1 654, 1 620, 1 596, 1 585 cm-1; ESI-MSm/z: 402.9{[M-H]+}; Anal.calcd for C17H10O3Cl4: C 50.53, H 2.49; found C 50.67, H 2.74。
二(2-羟基-3,5-二溴苯基亚甲基)丙酮(2g): 淡黄色粉末,收率80.3%, m.p.212~214 ℃;1H NMRδ: 7.39(d,J=16.05 Hz, 2H, g-H), 7.77(d,J=2.15 Hz, 2H, e-H), 7.92(d,J=2.05 Hz, 2H, c-H), 8.02(d,J=16.05 Hz, 2H, f-H), 8.78(s, 2H, a-OH); IRν: 3 382, 3 068, 1 670, 1 616, 1 593, 1 558 cm-1; ESI-MSm/z: 580.7{[M-H]+}; Anal.calcd for C17H10O3Br4: C 35.09,H 1.73; found C 35.01, H 1.88。
二(2-羟基-5-硝基苯基亚甲基)丙酮(2h): 橙黄色晶体,收率71.0%, m.p.226~228 ℃;1H NMRδ: 7.20(d,J=9.00 Hz, 2H, b-H), 7.59(d,J=16.15 Hz, 2H, g-H), 8.09(d,J=16.10 Hz, 2H, f-H), 8.18(dd,J=8.98 Hz, 2.50 Hz, 2H, c-H), 8.63(d,J=2.45 Hz, 2H, e-H), 10.56(s, 2H, a-OH); IRν: 3 566, 3 082, 1 645, 1 611, 1 588, 1 559, 1 488 cm-1; ESI-MSm/z: 355.1{[M-H]+}; Anal.calcd for C17H12O7N2: C 57.31, H 3.39; found C 57.17, H 3.69。
二(2-羟基-5-氯苯基亚甲基)丙酮(2i): 黄绿色粉末,收率63.4%, m.p.185~187 ℃;1H NMRδ: 6.95(d,J=8.70 Hz, 2H, b-H), 7.28(dd,J=8.72 Hz, 2.00 Hz, 2H, c-H), 7.36(d,J=16.10 Hz, 2H, g-H), 7.76(d,J=1.75 Hz, 2H, e-H), 7.86(d,J=16.10 Hz, 2H, f-H), 10.51(s, 2H, a-OH); IRν: 3 106, 1 639, 1 613, 1 557, 1 491 cm-1; ESI-MSm/z: 333.0{[M-H]+}; Anal.calcd for C17H12O3Cl2: C 60.92, H 3.61; found C 60.56, H 3.90。
二(2-羟基-5-溴苯基亚甲基)丙酮(2j): 姜黄色晶体,收率58.5%, m.p.182~184 ℃;1H NMRδ: 6.90(d,J=8.70 Hz, 2H, b-H), 7.35(d,J=16.10 Hz, 2H, g-H), 7.40(dd,J=8.70 Hz, 2.10 Hz, 2H, c-H), 7.85(d,J=16.15 Hz, 2H, f-H), 7.88(d,J=2.00 Hz, 2H, e-H), 10.53(s, 2H, a-OH); IRν: 3 138, 1 635, 1 594, 1 556, 1 488 cm-1; ESI-MSm/z:422.9{[M-H]+}; Anal.calcd for C17H12O3Br2: C 48.15, H 2.85; found C 47.94, H 3.07。
2结果与讨论
2.1合成
按文献[6]方法分离提纯2a~2e时。最初采用[V(盐酸)/V(水)=1/1]酸化反应液后冷却析晶的方法,析出物较少且有杂质;后改为先用混合溶剂A充分浸泡粗产品,然后用混合溶剂B重结晶,效果较好。2f~2j因含有酚羟基而易溶于反应液,故反应完成后也需先酸化和冷却析晶后再分离提纯;酸化时应严格控制pH值,避免副反应发生。
2.2表征
2的1H NMR 分析表明,f,g-H吸收峰为二重峰,偶合常数为15.85~16.15 Hz,表明其处于烯烃反式结构位置[11];羰基吸收峰均位于1 650 cm-1附近;元素分析值与理论计算值基本吻合。
参考文献
[1]马玉卓,尹利娜,刘鹰翔,等. 2-(E)-(4-环戊氧基-3-甲氧基苯亚甲基)环戊酮芳胺Mannich碱类化合物的合成及抗肿瘤活性[J].中国药物化学杂志,2006,16(3):144-149.
[2]Umashankar D, Masami K, Hiroshi S,etal. 3-(3,4,5-Trimethoxyphenyl)-1-oxo-2- propene:A novel pharmacophore displaying potent multidrug resistance reversal and selective cytotoxicity[J].Bioorg Med Chem Lett,2007,15:3373-3380.
[3]Bandugula V R, Jayakumar S S, Elumalai B,etal. Prevention of nicotine and streptozotocin treatment induced circulatory oxidative stress by bis-1,7-(2-hydroxyphenyl)-1,6-diene-3,5-dione in diabetic rats[J].Mol Cell Biochem,2009,331:127-133.
[4]刘鹰翔,闫星,孙平华,等. 取代苯基亚甲基环戊酮衍生物的设计、合成与抗肿瘤活性[J].中国药物化学杂志,2010,20(1):11-18.
[5]Zhao C G, Cai Y P, He X Z,etal. Synthesis and anti-inflammatory evaluation of novel mono-carbonyl analogues of curcumin in LPS-stimulated RAW 264.7 macrophages[J].European Journal of Medicinal Chemistry,2010,45:5773-5780.
[6]高复兴,陈光辉,王金涛,等. 新型2,5-二(取代苯基亚甲基)环戊酮的合成[J].合成化学,2012,20(4):515-516.
[7]杜志云,涂增清,张焜,等. 不对称姜黄素类似物的合成及其清除自由基的研究[J].化学研究与应用,2011,23(9):1126-1130.
[8]刘洋,许建华,黄秀旺,等. 姜黄素类似物合成与体外抗肿瘤活性研究[J].化学研究与应用,2011,23(7):923-927.
[9]Liang G,Yang S L, Jiang L J, et al. Synthesis and anti-bacterial properties of mono-carbonyl analogues of curcumin[J].Chem Pharm Bull,2008,56(2):162-167.
[10]黄淑芳,应华洲,胡永洲. 含氮姜黄素衍生物的合成及抗肿瘤活性研究[J].中国药物化学杂志,2011,21(2):88-95.
[11]邓芹英,刘岚,邓慧敏. 波谱分析教程[M].北京:科学出版社,2003:115.
Synthesis of Novel Bis(substituted-benzylidene)acetones
GAO Fu-xing*,WANG Nan-nan,GUO Peng,WANG Yong-hong,XUE Ling-fen
(College of Chemistry and Chemical Engineering, Xinyang Normal University, Xinyang 464000, China)
Abstract:Ten novel bis(substituted-benzylidene)acetone compounds(2a~2j) were synthesized at room temperature by Claisen-Schmidt condensation reaction of substituted-benzaldehyde or substituted-salicylaldehyde with acetone, respectively, using dilute sodium hydroxide as catalyst. The structures were characterized by1H NMR, IR, ESI-MS and elemental analysis.
Keywords:substituted-benzaldehyde; substituted-salicylaldehyde; bis(substituted-benzylidene)acetone; Claisen-Schmidt condensation; synthesis
作者简介:高复兴(1963-),男,汉族,河南信阳人,副教授,主要从事有机化学的研究。 E-mail: fxgao830@163.com
基金项目:河南省自然科学基金资助项目(092300410032)
收稿日期:2015-09-06;
修订日期:2015-12-24
中图分类号:O622.4
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.02.15309

