FeCl3催化合成新型烯丙基醚类化合物
许兴珠, 谷占收, 李正义, 孙小强, 王治明
(常州大学 石油化工学院,江苏 常州 213164)
·快递论文·
FeCl3催化合成新型烯丙基醚类化合物
许兴珠, 谷占收, 李正义, 孙小强, 王治明
(常州大学 石油化工学院,江苏 常州213164)
摘要:以烯丙基醇类化合物(1a~1i)和乙醇为起始原料,FeCl3为催化剂,经分子间亲核取代反应合成了9个烯丙基醚类化合物(2a~2i,其中2c, 2e~2i为新化合物),收率80%~95%,其结构经1H NMR,13C NMR和HR-ESI-MS表征。研究了催化剂,溶剂,反应温度和反应时间对2a产率的影响。结果表明:在最优反应条件[1a 0.5 mmol, FeCl34 mg, EtOH 2.5 mmol, CH2Cl2为溶剂,于室温反应0.8 h]下,2a收率95%。
关键词:烯丙基醇; 亲核取代反应; 烯丙基醚; 催化合成
含烯丙基醚结构的化合物具有异构化、结合氢及易聚合等特性,常用于保护基、聚合物单体、交联剂、涂料和阻燃树脂等领域[1-6]。由于烯丙基醚类化合物的合成过程往往涉及使用强酸或贵金属催化剂,其应用受到极大限制。如Namy J L等[7]以烯丙基酮类化合物和甲醇为原料,经两步法合成了烯丙基醚类化合物,但反应过程仍需使用浓HCl,对反应装置要求较高,限制了其工业化应用。Ohshima T等[8]以查尔醇和乙醇为原料,三氟甲磺酸铝为催化剂,合成了一系列烯丙基醚类化合物,产率较高,但所用金属催化剂价格较为昂贵。寻找简单高效的方法合成烯丙基醚类化合物成为科研工作者关注的热点。
FeCl3作为一种廉价低毒的路易斯酸催化剂,已经受到广泛的关注[9-10]。本课题组[11]曾报道了一种使用FeCl3催化邻氨基查尔醇,经分子内亲核取代反应合成喹啉类化合物的新方法。Jana等[12]发现,FeCl3催化的炔烃与羰基化合物的复分解反应是合成苯并六/七元含氮杂环的有效方法之一。
鉴于此,本文以烯丙基醇类化合物(1a~ 1i)和乙醇为起始原料,FeCl3为催化剂,经分子间亲核取代反应合成了9个烯丙基醚类化合物(2a~2i;其中2c, 2e~2i为新化合物, Scheme 1),收率80%~95%,其结构经1H NMR,13C NMR和HR-ESI-MS表征。以2a的合成为模板反应,研究了催化剂,溶剂,反应温度和反应时间对2a产率的影响。并以2a和2f为例,初步研究了烯丙基醚类化合物在烯丙基胺和二氢喹啉类化合物合成上的应用(Scheme 2)。
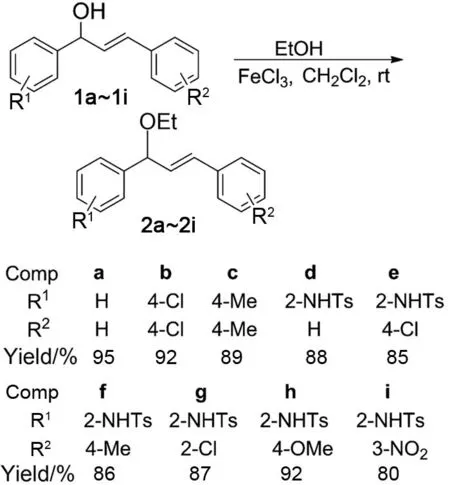
Scheme 1
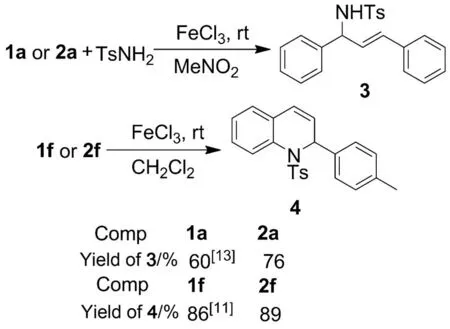
Scheme 2
1实验部分
1.1仪器与试剂
SGW X-4型显微熔点仪;Bruker ARX-300/400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Agilent 6540型高分辨质谱仪。
1a~1i按文献[13]方法合成;其余所用试剂均为分析纯;THF使用前经金属钠回流除水后蒸馏。
1.2合成
(1)2a~2i的合成(以2a为例)
在Schlenk管中加入1a 110 mg(0.5 mmol),FeCl34 mg和EtOH 115 mg(2.5 mmol),搅拌下滴加CH2Cl22 mL,滴毕,于室温反应0.8 h(TLC检测)。反应液经硅胶柱层析[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=10 ∶1]纯化得无色油状液体2a[7];1H NMRδ: 7.35~7.42(m, 5H), 7.20~7.32(m, 5H), 6.59(d,J=15.8 Hz, 1H), 6.33(dd,J=6.9 Hz, 16.0 Hz, 1H), 4.91(d,J=6.6 Hz, 1H), 3.42~3.63(m, 2H), 1.26(t,J=6.9 Hz, 3H);13C NMRδ: 141.6, 136.7, 131.2, 130.7, 128.6, 127.7, 127.7, 126.9, 126.6, 125.9, 82.6, 64.1, 15.4。
用类似的方法合成无色油状液体2b, 2c和白色固体2d~2i。
2b[15]:1H NMRδ: 7.22~7.34(m, 8H), 6.55(d,J=15.0 Hz 1H), 6.17~6.25(m, 1H), 4.85~4.88(m, 1H), 3.39~3.60(m, 2H), 1.26(t,J=7.0 Hz, 3H);13C NMRδ: 140.3, 139.8, 134.9, 133.4, 131.5, 130.8, 130.2, 128.7, 128.2, 127.8, 81.7, 64.2, 15.3。
2c:1H NMRδ: 6.83~7.29(m, 8H), 6.57(d,J=15.0 Hz, 1H), 6.21~6.28(m, 1H), 4.88(d,J=7.0 Hz, 1H), 3.35~3.60(m, 2H), 2.35(s, 6H), 1.21~1.26(m, 3H);13C NMRδ: 141.3, 138.6, 134.6, 133.9, 130.9, 129.7, 129.2, 128.7, 128.4, 127.3, 82.5, 63.8, 23.1, 21.3, 15.4; HR-ESI-MSm/z: Calcd for C19H22O{[M+H]+}267.174 3, found 267.174 0。
2d[11]: m.p.81.1~82.8 ℃;1H NMRδ: 8.73(s, 1H), 7.62~7.68(m, 3H), 7.21~7.33(m, 6H), 6.96~7.08(m, 4H), 6.35(d,J=15.6 Hz, 1H), 6.01~6.08(dd,J=6.0 Hz, 1H), 4.86(d,J=6.0 Hz, 1H), 3.42~3.61(m, 2H), 2.47(s, 3H), 1.31(t,J=6.9 Hz, 3H);13C NMRδ: 143.5, 136.6, 136.1, 136.0, 131.8, 129.4, 129.1, 128.9, 128.5, 128.2, 127.9, 127.6, 127.2, 126.7, 123.1, 119.1, 83.1, 64.7, 21.5, 15.2。
2e: m.p.84.5~86.1 ℃;1H NMRδ: 8.68(s, 1H), 7.62~7.67(m, 3H), 7.21~7.28(m, 3H), 7.13~7.16(m, 2H), 6.98~7.08(m, 4H), 6.31~6.36(dd,J=1.1 Hz, 16.0 Hz, 1H), 6.01~6.08(dd,J=5.6 Hz, 15.9 Hz, 1H), 4.87~4.89(d,J=16.0 Hz, 1H), 3.44~3.57(m, 2H), 2.27(s, 3H), 1.31(t,J=6.9 Hz, 3H);13C NMRδ: 143.6, 136.8, 136.2, 134.6, 133.6, 130.4, 129.5, 129.2, 129.1, 128.7, 128.5, 128.0, 127.9, 127.2, 123.8, 119.6, 83.0, 64.8, 21.5, 15.2; HR-ESI-MSm/z: Calcd for C24H24NO3SCl{[M+H]+}442.123 8, found 442.123 9。
2f: m.p.80.3~82.0 ℃;1H NMRδ: 8.73(s, 1H), 7.62~7.66(m, 3H), 7.14~7.24(m, 3H), 6.99~7.08(m, 4H), 6.82~6.84(m, 2H), 6.34(d,J=15.0 Hz, 1H), 5.88~5.95(m, 1H), 4.81~4.84(m, 1H), 3.42~3.58(m, 2H), 2.33(s, 3H), 2.28(s, 3H), 1.34(t,J=7.0 Hz, 3H);13C NMRδ: 143.5, 136.7, 136.2, 133.3, 132.0, 129.5, 129.2, 129.1, 128.9, 128.5, 127.2, 126.7, 126.6, 126.5, 123.8, 119.7, 83.2, 64.8, 58.5, 21.5, 15.2; HR-ESI-MSm/z: Calcd for C25H27NO3S{[M+H]+} 422.178 4, found 422.178 5。
2g: m.p.84.0~85.5 ℃;1H NMRδ: 8.71(s, 1H), 7.63~7.69(m, 3H), 7.19~7.36(m, 5H), 6.99~7.09(m, 4H), 6.77(dd,J=1.0 Hz, 16.0 Hz, 1H), 6.07(m, 1H), 4.90(m, 1H), 3.86(m, 2H), 2.27(s, 3H), 1.34(t,J=7.0 Hz, 3H);13C NMRδ: 143.5, 136.4, 136.1, 134.2, 133.3, 130.3, 129.7, 129.5, 129.1, 129.0, 128.4, 128.3, 127.1, 127.0, 126.8, 124.0, 120.2, 119.3, 83.1, 64.8, 21.5, 15.2; HR-ESI-MSm/z: Calcd for C24H24NO3SCl{[M+H]+}442.123 8, found 442.123 7。
2h: m.p.83.5~85.2 ℃;1H NMRδ: 8.73(s, 1H), 7.62~7.66(m, 3H), 7.14~7.24(m, 3H), 6.99~7.08(m, 4H), 6.82~6.84(m, 2H), 6.34(d,J=15.0 Hz, 1H), 5.88~5.95(m, 1H), 4.81~4.84(m, 1H), 3.81(s, 3H), 3.42~3.58(m, 2H), 2.28(s, 3H), 1.34(t,J=7.0 Hz, 3H);13C NMRδ: 159.5, 143.5, 136.8, 136.2, 131.6, 129.5, 129.1, 128.9, 128.8, 128.6, 128.0, 127.3, 125.3, 123.7, 119.7, 113.9, 83.3, 64.6, 55.4, 21.6, 15.2; HR-ESI-MSm/z: Calcd for C25H27NO4S{[M+H]+} 438.173 4, found 438.173 6。
2i: m.p.86.8~87.5 ℃;1H NMRδ: 8.59(s, 1H), 8.10~8.12(m, 2H), 7.45~7.68(m, 5H), 6.99~7.12(m, 5H), 6.45~6.50(m, 1H), 6.22~6.29(m, 1H), 4.96~4.98(m, 1H), 3.47~3.59(m, 2H), 2.23(s, 3H), 1.34(t,J=7.0 Hz, 3H);13C NMRδ: 148.5, 143.7, 138.0, 136.8, 136.3, 132.6, 131.2, 129.5, 129.5, 129.3, 129.0, 127.5, 127.2, 123.9, 122.5, 121.2, 120.6, 119.6, 82.6, 65.0, 21.4, 15.2; HR-ESI-MSm/z: Calcd for C24H24N2O5S{[M+H]+}453.147 9, found 453.147 6。
(2) 3的合成
在Schlenk管中加入1a 0.21 g(1 mmol), TsNH20.19 g(1.1 mmol)和FeCl380 mg,搅拌下滴加MeNO33.5 mL,滴毕,于20 ℃反应至终点(TLC跟踪)。加入适量水,用乙酸乙酯萃取,有机相用无水Na2SO4干燥30 min。抽滤,滤液旋除乙酸乙酯后经硅胶柱层析(洗脱剂:A)纯化得亮黄色固体3,收率60%, m.p.133~135 ℃;1H NMRδ: 7.64~7.66(m, 2H), 7.12~7.27(m, 12H), 6.34(d,J=15.6 Hz, 1H), 6.07(dd,J=6.6 Hz, 15.8 Hz, 1H), 5.04~5.15(m, 2H), 2.31(s, 3H);13C NMRδ: 143.1, 139.5, 137.6, 135.9, 132.0, 129.3, 128.6, 128.3, 128.0, 127.8, 127.7, 127.2, 126.9, 126.4, 59.6, 21.3。
(3) 4的合成
在Schlenk管中加入1f 0.2 g(0.5 mmol)和FeCl32 mg,搅拌下滴加CH2Cl22 mL,滴毕,于20 ℃反应至终点(TLC跟踪)。反应液直接经硅胶柱层析(洗脱剂:A)纯化得白色固体4,收率86%;1H NMRδ: 7.63(d,J=8.0 Hz, 1H), 7.33(d,J=8.0 Hz, 2H), 7.18~7.23(m, 3H), 7.08~7.14(m, 3H), 7.04(d,J=8.0 Hz, 2H), 6.96(d,J=7.6 Hz, 1H), 6.26(d,J=9.6 Hz, 1H), 5.98(d,J=6.0 Hz, 1H), 5.87(dd,J=9.6 Hz, 6.0 Hz, 1H), 2.35(s, 3H), 2.26(s, 3H);13C NMRδ: 143.3, 137.7, 136.2, 135.3, 132.9, 129.2, 129.1, 128.7, 128.2, 127.7, 127.4, 127.3, 126.7, 126.4, 126.2, 125.4, 56.8, 21.6, 21.1。
2结果与讨论
2.1反应条件优化(以2a为例)
以2a的合成为模板反应,研究了催化剂,溶剂,反应温度和反应时间对2a产率的影响,结果见表1。
表12a合成条件的优化
Table 1Optimization of the synthesizing 2a
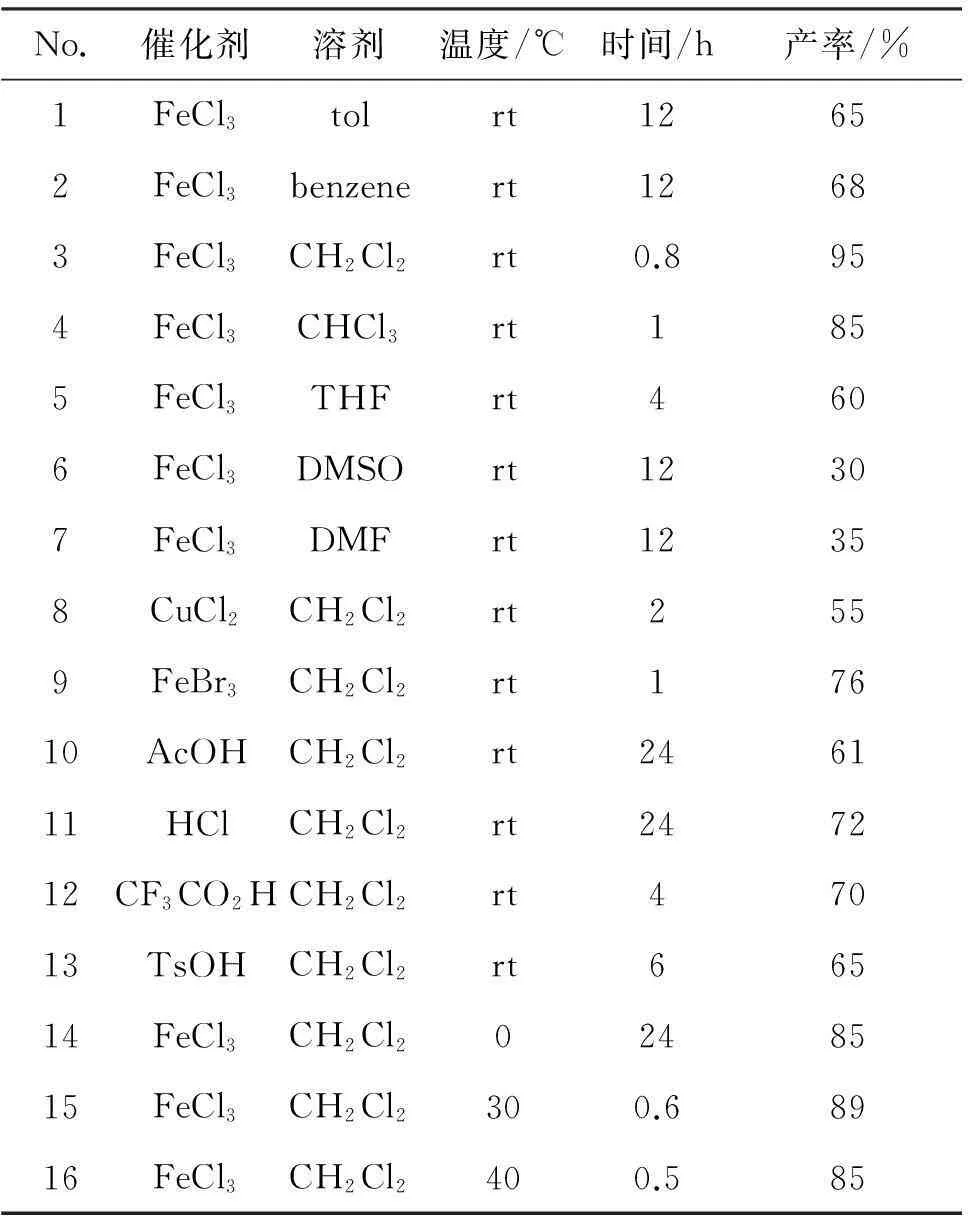
No.催化剂溶剂温度/℃时间/h产率/%1FeCl3tolrt12652FeCl3benzenert12683FeCl3CH2Cl2rt0.8954FeCl3CHCl3rt1855FeCl3THFrt4606FeCl3DMSOrt12307FeCl3DMFrt12358CuCl2CH2Cl2rt2559FeBr3CH2Cl2rt17610AcOHCH2Cl2rt246111HClCH2Cl2rt247212CF3CO2HCH2Cl2rt47013TsOHCH2Cl2rt66514FeCl3CH2Cl20248515FeCl3CH2Cl2300.68916FeCl3CH2Cl2400.585
在相同的反应条件下,溶剂对2a收率的影响见表1中的No.1~No.7。从中可见,FeCl3为催化剂时,取代反应能在非极性溶剂(苯,甲苯)和极性溶剂(氯仿,THF,DMSO和DMF)中均能顺利进行,在CH2Cl2中反应最快(0.8 h),收率较高(95%, No.3); 以CH2Cl2为溶剂,催化剂对2a收率的影响见表1的No.3和No.8~No.13,从中可见,路易斯酸(FeCl3,CuCl2和FeBr3)为催化剂时,反应速度较快(No.3, No.8和No.9),但CuCl2和FeBr3的催化效果不如FeCl3,以质子酸(HCl,CF3CO2H和TsOH)为催化剂,反应速度较慢,产率较低(No.10~No.13); No.3和No.14~No.16主要考察了温度对合成2a的影响,室温时,反应产率最高(No.3),温度升高(No.15和No.16),虽然反应速度略微加快,但2a产率降低,且有少量不明副产物生成,反应温度为0℃时,反应不发生。
综上,合成2a的最佳反应条件为:FeCl3为催化剂,CH2Cl2为溶剂,于室温反应0.8 h。
2.2反应拓展
为进一步考察产物的拓展反应,以2a和2f为例,研究了烯丙基醚类化合物在烯丙基胺和二氢喹啉类化合物合成上的应用(Scheme 2)。结果表明:以2a和对甲苯磺酰胺为起始原料,在FeCl3催化下,可通过分子间的亲核取代反应以较高的产率生成烯丙基胺类化合物(3);以2f为起始原料,在FeCl3催化下,可以通过分子内的亲核取代反应以较高的产率生成二氢喹啉类化合物(4)。上述反应的收率均优于文献值[11,14]。
3结论
报道了一种合成烯丙基醚类化合物的新方法。该方法具有原料简单易得,催化剂廉价以及反应条件较为温和等特点。此外,将合成的部分烯丙基醚类化合物应用于合成烯丙基胺和二氢喹啉类化合物,收率较高,为烯丙基醚、烯丙基胺和二氢喹啉类化合物的合成提供了新思路。
参考文献
[1]Bergvall A G, Sjoegreen C A E, Clausson A K O. Unsaturated polyester-based,allyl ether containing liquid compositions:SE 466 402[P].1992.
[2]Meixner J, Kremer W, Mneller M. Preparation of unsaturated polyester polyurethanes for coating:EP 424 745[P].1991.
[3]Meixner K, Kremer K, MULLer E. Unsaturated urethanized polyester resins,A process for their production and their use for the production of coatings:US 514 201 5[P].1992.
[4]Akiyama L, Shigematsu A, Matsumura S. Unsaturated polyester resin coating composition:US 474 514 1[P].1988.
[5]Tahira T, Imanaka Y. Preparation of tetrabromobis phenol bisallyl esters as fire retardants for thermoplatic resins:JP 102 995 6[P].1998.
[6]王西新,赵建玲,杨浩,等. 烯丙基醚的合成技术研究[J].辽宁化工,2001,30(12):532-539.
[7]Lannou M I, Florence H, Namy J L. Applications of lanthanide trichloride hydrates prepared from mischmetall in Luche-type reduction[J].Synlett,2007,(17):2707-2710.
[8]Ohshima T, Ipposhi J, Nakahara Y. Aluminum triflate as a powerful catalyst for direct amination of alcohols,including electron-withdrawing group-substituted benzhydrols[J].Adv Synth Catal,2012,54(13):2447-2452.
[9]Sun C L, Li B J, Shi Z J. Direct C-H transformation via iron catalysis[J].Chem Rev,2011,111(3):1293-1314.
[10]Correa A, Mancheno O G, Bolm C. Iron-catalysed carbon-heteroatom and heteroatom-heteroatom bond forming processes[J].Chem Soc Rev,2008,37(6):1108-1117.
[11]Wang Z, Li S, Yu B,etal. FeCl3·6H2O-catalyzed intramolecular allylic amination:Synthesis of substituted dihydroquinolines and quinolines[J].J Org Chem,2012,77(19):8615-8620.
[12]Jalal S, Bera K,Sarkar S,etal. Efficient synthesis of functionalized dihydroquinolines,quinolines and dihydrobenzo[b]azepine via an iron(III) chloride-catalyzed intramolecular alkyne-carbonyl metathesis of alkyne tethered 2-amino benzaldehyde/acetophenone derivatives[J].Org Biomol Chem,2014,12(11):1759-1770.
[13]Kothandaraman P, Foo S J, Chan P W. Gold-catalyzed intramolecular allylic amination of 2-tosylaminophenylprop-1-en-3-ols:A concise synthesis of (±)-Angustureine[J].J Org Chem,2009,74(16):5947-5952.
[14]Jana U, Maiti S, Biswas S. An efficient FeCl3-catalyzed amidation reaction of secondary benzylic and allylic alcohols with carboxamides orp-toluenesulfonamide[J].Tetrahedron Lett,2008,49(5):858-862.
[15]Chatterjee P N, Roy S. Allylic activation across an Ir-Sn heterobimetallic catalyst:Nucleophilic substitution and disproportionation of allylic alcohol[J].Tetrahedron,2012,68(19):3776-3785.
Synthesis of Novel Allylic Ether Compounds Catalysed by FeCl3
XU Xing-zhu,GU Zhan-shou,LI Zheng-yi,SUN Xiao-qiang,WANG Zhi-ming
(School of Petrochemical Engineering, Changzhou University, Changzhou 213164, China)
Abstract:Nine allylic ether compounds(2a~2i; 2c, 2e~2i were novel compounds) were synthesized by intermolecular nucleophilic substitution reaction, using allylic alcohols(1a~1i) and ethanol as starting materials, FeCl3as catalyst. The yields of 2a~2i were 80%~95%. The structures were characterized by1H NMR,13C NMR and HR-ESI-MS. Effects of catalyst, solvent, reaction temperature and time on yield of 2a were investigated. The results showed that the yield of 2a was 95% under the optimized reaction conditions[1a 0.5 mmol, FeCl34 mg, EtOH 2.5 mmol, CH2Cl2as solvent, reacted at rt for 0.8 h].
Keywords:allylic alcohol; nucleophilic substitution reaction; allylic ether; catalytic synthesis
通信作者:王治明,教授,硕士生导师, E-mail: zhiming@cczu.edu.cn
作者简介:许兴珠(1989-),男,汉族,江苏南京人,硕士研究生,主要从事有机合成的研究。
基金项目:国家自然科学基金资助项目(21372033); 江苏省高校自然科学研究重大项目(12KJA150002, 14KJA150002); 江苏省青蓝工程资助项目
收稿日期:2015-03-17;
修订日期:2015-12-17
中图分类号:O623.412
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.02.15084

