白藜芦醇通过抑制内质网应激减轻大鼠脑缺血/再灌注损伤
高 轩 陈荔枝 刘振红 吕艳华 夏立伟 李永秋
(唐山市工人医院神经内科,唐山063000)
白藜芦醇通过抑制内质网应激减轻大鼠脑缺血/再灌注损伤
高轩陈荔枝①刘振红①吕艳华①夏立伟李永秋
(唐山市工人医院神经内科,唐山063000)
[摘要]目的:探讨白藜芦醇(Resveratrol,Res)对大鼠脑缺血/再灌注诱导的内质网应激反应的调控作用。方法:将72只健康雄性SD大鼠,采用随机数字表法分为3组(n=24):假手术组(S组)、脑缺血/再灌注模型组(I/R组)、Res组(R组)。采用阻断左侧大脑中动脉并阻断双侧颈总动脉30 min恢复灌注的方法制备大鼠脑缺血/再灌注模型。R组于缺血前7 d给予腹腔注射Res(50 mg/kg),1次/日。对大鼠进行神经功能缺损评分后留取脑组织,采用TTC法检测脑梗死体积,干湿重法测定脑组织含水量,免疫组织化学及Western blot法检测大脑皮层内质网应激相关蛋白GRP78、p-PERK、CHOP的表达变化。结果:与S组比较,I/R组大鼠神经功能评分及脑含水量升高(P<0.05),脑梗死体积增大(P<0.05),皮层GRP78、p-PERK和CHOP蛋白表达均显著上调(P<0.05)。与I/R组比较,P组大鼠神经功能评分及脑含水量降低(P<0.05),脑梗死体积减小(P<0.05),GRP78表达上调(P<0.05),p-PERK和CHOP蛋白表达下调(P<0.05)。结论:白藜芦醇通过抑制内质网应激反应,对大鼠脑缺血/再灌注损伤发挥保护作用。
脑缺血/再灌注(Cerebral ischemia /reperfusion,I/R)损伤的病理生理过程十分复杂,主要包括细胞内钙失稳态、兴奋性氨基酸释放增加、细胞酸中毒、自由基生成等,这些环节最终导致神经细胞凋亡和坏死[1]。近年来研究发现内质网应激是脑缺血/再灌注损伤中的一个关键环节,可启动神经细胞凋亡途径[2]。葡萄糖调控蛋白78(Glucose regulated protein,GRP78),磷酸化胰腺内质网激酶(pancreatic ER kinase,p-PERK),C/EBP同源蛋白(C/EBP homologous protein,CHOP)是内质网应激的标志性蛋白,其中GRP78上调可缓解内质网内未折叠蛋白负荷,促进内质网功能恢复。但是内质网应激被过度诱导时,就会启动PERK/CHOP途径,导致细胞死亡。白藜芦醇是多种植物内的一种多酚化合物,具有抗炎、抗氧化、清除自由基和抑制凋亡等作用,同时在脑缺血/再灌注损伤中发挥神经保护作用[3],但其确切机制尚不清楚。本研究拟探讨白藜芦醇的脑保护作用是否与抑制脑缺血/再灌注损伤诱发的内质网应激相关,为明确其机制提供参考。
1材料与方法
1.1材料
1.1.1主要药物和试剂白藜芦醇购自Sigma公司;2,3,5-氯化三苯基四氮唑(TTC)购自Amresco公司;兔抗大鼠的GRP78、p-PERK、CHOP及β-actin多克隆抗体购自美国Santa Cruz公司;辣根过氧化物酶偶联山羊抗兔IgG购自北京中杉金桥生物技术有限公司;兔IgG即用型SABC免疫组化试剂盒购自博士德生物工程有限公司;BCA试剂盒和DAB显色试剂盒购自北京中衫金桥生物技术有限公司。
1.1.2实验动物与分组SPF级成年SD大鼠72只,雄性,体重350~400 g,3月龄左右,由北京维通利华实验动物技术有限公司提供。采用随机数字表法,将所有大鼠随机分为三组:假手术组(S组)、脑缺血/再灌注模型组(I/R组)、Res组(R组),每组24只。每组又分为4个时间点,每个时间点6只大鼠。
1.2方法
1.2.1动物模型制备及处理参照文献[4]步骤,阻断左侧大脑中动脉并阻断双侧颈总动脉30 min恢复灌注的方法制备大鼠脑缺血/再灌注损伤模型。腹腔注射戊巴比妥钠(40 mg/kg)麻醉后,取仰卧位行颈部正中切口,分离暴露双侧颈总动脉。然后取右侧卧位,分离暴露左侧大脑中动脉,用电凝器电凝嗅束近端至大脑下静脉之间的一段大脑中动脉。再次仰卧位,无创微动脉夹夹闭双侧颈总动脉,缺血30 min后松开动脉夹恢复灌注。Sham组仅分离暴露双侧颈总动脉与左侧大脑中动脉,但不夹闭不电凝。Res组于模型制备前7 d给予白藜芦醇无菌液腹腔注射(50 mg/kg),1次/日,连续注射7 d,最后一次注射在造模前1 h。
1.2.2神经功能缺损评分于再灌注24 h时,参照文献[5]对各组大鼠进行神经功能缺损评分。无神经功能缺损症状计为0分;垂直提起时缺血对侧前肢不能伸展计为1分,行走时向缺血对侧转圈计为2分,行走时向缺血对侧倾倒计为3分,意识消失不能自发行走计为4分。
1.2.3脑含水量测定采用干湿重法测定大鼠脑组织含水量,取出缺血侧大鼠脑组织迅速称其湿重,然后置于105℃高温烤箱内,干燥48 h后称量其干重。脑组织脑含水量按Elliott公式计算:脑含水量(%)=(湿重-干重)/湿重× 100%。
1.2.4脑梗死体积测定神经功能缺陷评分测定完毕后,采用TTC染色法测量脑梗死体积。麻醉后迅速断头后取脑组织,由前向后冠状面切片,置入新鲜配制的2%TTC磷酸盐缓冲液中,37℃恒温烤箱避光染色30 min后,置入4%多聚甲醛溶液固定保存。红色为正常脑组织,白色为梗死灶。分离红色和白色脑组织,分别称重,计算脑梗死体积:脑梗死体积(%)=苍白区重量/(苍白区重量+非苍白区重量)×100%。
1.2.5免疫组织化学法检测大鼠心脏快速灌注生理盐水约200 ml,随后4%多聚甲醛约300 ml,断头取脑固定,常规脱水、透明、浸蜡及包埋,冠状切片(5 μm)。微波修复1 min,3% H2O2灭活15 min,5% BSA封闭30 min,甩干后滴加兔抗大鼠GRP78、CHOP多克隆抗体,抗体效价分别为1∶100和1∶50,4℃过夜。次日滴加羊抗兔的辣根过氧化物酶标记的IgG,孵育30 min,SABC液孵育40 min,DAB显色5 min。终止反应后脱水、透明、中性树胶封片,置于镜下观察。
1.2.6Western blot法检测 取大鼠脑组织80 mg,加入1 ml RIPA裂解液,超声裂解,低温离心后取上清液。BCA法进行蛋白定量,配置5%的浓缩胶和10%的分离胶,50 μg蛋白上样进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,半干法转至PVD F膜上,5% BSA封闭1 h,滴加兔抗大鼠GRP78、p-PERK、CHOP和β-actin多克隆抗体,抗体效价均为1∶500,4℃过夜。次日滴加羊抗兔的IgG,室温孵育1 h,ECL显色曝光。Image J医学图像分析系统进行半定量分析,以目标蛋白的灰度值与β-actin灰度值的比值反应目标蛋白表达水平。
2结果
2.1各组大鼠神经功能缺损评分结果大鼠取材前进行神经功能缺损的评定,评定结果显示:Sham组大鼠无神经缺损的各种症状;与Sham组比较,I/R组大鼠的神经功能缺陷评分较高(P<0.05);Res组大鼠神经功能缺陷评分较I/R组降低(P<0.05)。见表1。
2.2各组大鼠脑组织含水量改变干湿重法测定大鼠脑组织含水量改变,评价大鼠脑水肿程度。与Sham组比较,I/R组大鼠脑组织含水量增加(P<0.05);与I/R组比较,Res组大鼠脑组织含水量减少(P<0.05)。见表1。
2.3各组大鼠脑梗死体积变化 TTC染色法测量大鼠脑梗体积变化,结果显示:Sham组大鼠未见脑梗死区域;与Sham组相比,I/R组大鼠脑梗死体积增大(P<0.05);Res组大鼠较I/R组脑梗死体积相比明显缩小(P<0.05)。见表1。
2.4GRP78的免疫组织化学染色结果GRP78阳性产物为棕黄色颗粒,定位于细胞浆中。Sham组大鼠皮层可见GRP78微量基础表达,免疫反应较弱;I/R组大鼠皮层GRP78呈强阳性表达,广泛分布于大脑皮层,阳性细胞数较多,免疫反应性较强;Res组大鼠皮层GRP78阳性细胞数增多,免疫反应性进一步增强。见图1。
2.5CHOP的免疫组织化学染色结果CHOP阳性产物为棕黄色颗粒,定位于胞核,也可见于胞浆中。Sham组大鼠皮层可见CHOP微量表达;I/R组大鼠皮层CHOP呈强阳性表达,阳性细胞数目较多,免疫反应性较强;Res组大鼠皮层CHOP阳性细胞数目减少,且免疫反应性减弱。见图2。
表1大鼠神经功能缺损评分、脑梗死体积及脑组织含水量变化
Tab.1Changes of neurological deficit score,cerebral infarct size,brain water content in each group

GroupsNeurologicaldeficitscoreCerebralinfarctsize(%)Brainwatercontent(%)Shamgroup0075.34±3.29I/Rgroup2.98±0.671)42.65±2.821)87.66±2.581)Resgroup1.18±0.232)18.46±1.512)78.22±3.052)
Note:1)P<0.05,compared with Sham group;2)P<0.05,compared with I/R group.

图1 脑皮层GRP78免疫组织化学染色结果(×400)Fig.1 Immunohistochemical stainning of GRP78 in cortex(× 400)Note: A.Sham group;B.I/R group;C.Res group.
2.6GRP78蛋白定量结果Sham组大鼠皮层GRP78呈现弱表达;I/R组大鼠皮层GRP78蛋白表达量较Sham组明显增多(P<0.05),于3 h开始升高,6 h达高峰,随后开始回落;与I/R组对应时间点相比,Res组大鼠皮层GRP78的蛋白表达量明显升高(P<0.05)。见图3。
2.7p-PERK和CHOP蛋白定量结果Sham组大鼠皮层p-PERK和CHOP呈现微量表达;与Sham组相比,I/R组大鼠皮层p-PERK和CHOP蛋白表达量明显上调(P<0.05),于6 h开始升高,12 h达高峰,随后降低;与I/R组对应时间点相比,Res组大鼠皮层p-PERK和CHOP蛋白表达量明显下调(P<0.05)。见图4、5。

图2 脑皮层CHOP免疫组织化学染色结果(×400)Fig.2 Immunohistochemical stainning of CHOP in cortex(× 400)Note: A.Sham group;B.I/R group;C.Res group.
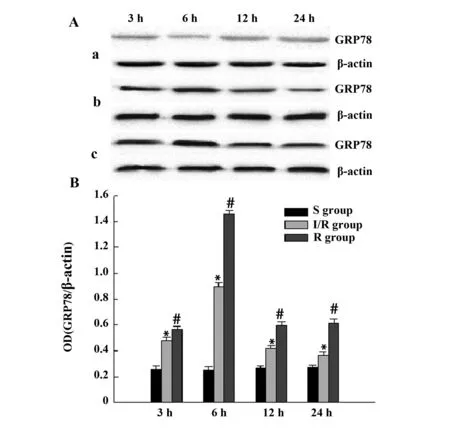
图3 脑皮层GRP78蛋白的Western blot检测结果Fig.3 Western blot result of GRP78 expression in cortexNote: a.Sham group;b.I/R group;c.Res group.*.P<0.05,compared with Sham group;#.P<0.05,compared with I/R group.
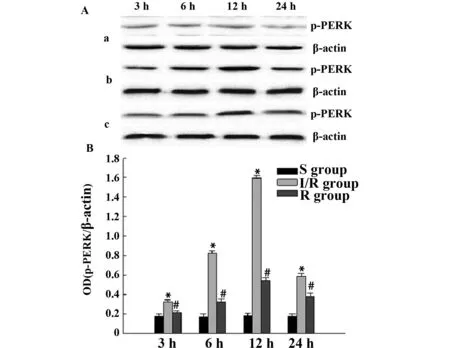
图4 脑皮层p-PERK蛋白的Western blot检测结果Fig.4 Western blot result of p-PERK expression in cortexNote: a.Sham group;b.I/R group;c.Res group.*.P<0.05,compared with Sham group;#.P<0.05,compared with I/R group.

图5 脑皮层CHOP蛋白的Western blot检测结果Fig.5 Western blot result of CHOP expression in cortexNote: a.Sham group;b.I/R group;c.Res group.*.P<0.05,compared with Sham group;#.P<0.05,compared with I/R group.
3讨论
本研究通过阻断左侧大脑中动脉并阻断双侧颈总动脉方法制备脑缺血/再灌注损伤大鼠模型,并于缺血前7 d给予白藜芦醇腹腔注射,采用行为学、形态学及分子生物学方法观察白藜芦醇对脑缺血/再灌注损伤的神经保护作用及机制。结果表明白藜芦醇预处理可降低神经功能缺损评分改善神经功能;可缩小脑缺血/再灌注大鼠脑梗死体积;减少脑组织含水量缓解脑水肿,揭示白藜芦醇在大鼠脑缺血/再灌注损伤中发挥保护性疗效,提示其可能具有较好的临床应用前景。然而,目前白藜芦醇神经保护作用的机制尚未阐明。有文献报道白藜芦醇通过抑制NF-κB信号通路下调基质金属蛋白酶功能,进而阻断其介导的胞外基质降解,减轻大鼠海马结构与功能损伤[6]。其次还可通过上调神经保护因子沉默信息调控因子1(Sirtuins 1,Sirtl)的表达,进而促进自噬的激活,减轻大鼠脑缺血/再灌注损伤[7]。另外多数研究显示白藜芦醇可减轻缺血半暗带内及海马CA1区的神经细胞凋亡,其作用机制与上调Bcl-2的表达,激活PI3K/AKT通路抑制凋亡相关蛋白的表达相关[8,9]。鉴于白藜芦醇抗凋亡的生物学作用,以及脑缺血/再灌注后内质网应激是启动凋亡的一种新途径,本研究将进一步探讨白藜芦醇对脑缺血/再灌注损伤的保护作用与内质网应激的关系。
内质网应激(Endoplasmic reticulum stress,ERS)是缺血、缺氧、氧化应激等各种刺激导致内质网内错误折叠蛋白和未折叠蛋白质的聚集,使细胞生理功能发生紊乱的一种状态[10]。ERS是细胞的一种自我保护机制,适度ERS的激活可促进内质网功能的恢复,持续而强烈的ERS可诱导内质网相关降解途径介导的细胞凋亡,造成组织损伤[11]。葡萄糖调控蛋白78(Glucose regulated protein,GRP78),磷酸化胰腺内质网激酶(pancreatic ER kinase,p-PERK),C/EBP同源蛋白(C/EBP homologous protein,CHOP)是内质网应激的标志性蛋白。其中GRP78是内质网应激的分子伴侣蛋白,其高表达可减少内质网内未折叠蛋白聚集,改善内质网损伤[12]。本实验的免疫组化及免疫印迹结果显示I/R大鼠大脑皮层中GRP78的表达明显上调,于6 h达高峰。可能由于缺血区出现低血低氧低糖,导致错误折叠蛋白聚集诱发ERS,损伤内质网结构和功能,大鼠皮层细胞高表达GRP78可部分缓解内质网损伤。白藜芦醇注射可进一步增强大鼠皮层GRP78蛋白的表达量,进一步促进内质网功能恢复。同时我们还发现I/R大鼠皮层中p-PERK和CHOP蛋白也呈现高表达状态,于12 h 达高峰,二者为内质网的相关促凋亡蛋白。由此推理脑缺血/再灌注后内质网应激被持续而强烈的诱导后细胞启动PERK/CHOP途径,最终导致细胞凋亡。并且有报道显示GRP78具有抗凋亡的作用,阻止caspases级联反应[13]。白藜芦醇预处理可明显下调皮层p-PERK和CHOP的蛋白表达,进而减轻细胞损伤。
综上所述,脑缺血/再灌注后GRP78、p-PERK和CHOP高表达,表明细胞启动了内质网应激途径。一方面高表达的GRP78蛋白可促进内质网损伤修复,另一方面高表达的p-PERK和CHOP可启动细胞损伤途径。白藜芦醇预处理可进一步上调GRP78蛋白的表达,而下调p-PERK和CHOP蛋白的表达,促进内质网结构和功能的恢复,减轻细胞损伤。本研究揭示了白藜芦醇在脑缺血/再灌注损伤中的神经保护作用机制,为脑缺血/再灌注的预防及临床治疗提供理论基础和实验依据。
参考文献:
[1]Gao HJ,Liu PF,Li PW,etal.Ligustrazine monomer against cerebral ischemia/reperfusion injury[J].Neural Regen Res,2015,10(5):832-840.
[2]Ishige K,Osada N,Kosuge Y,etal.Involvement of endoplasmic reticulum stress in neurodegeneration after transient global ischemia-reperfusion[J].NihonYakurigaku Zasshi,2013,142(1):9-12.
[3]Fang L,Gao H,Zhang W,etal.Resveratrol alleviates nerve injury after cerebral ischemia and reperfusion in mice by inhibiting inflammation and apoptosis[J].Int J Clin Exp Med,2015,8(3):3219-3226.
[4]Zhao H,Sapelsky RM,Steinberg GK.Interrupting reperfusion as a stroke therapy:ischemic posteonditioning reduces infarct size after focal ischemia in rats[J].J Cereb Blood Flow Metab,2006,26(9):1114-1121.
[5]Prass K,Scharff A,Ruscher K,etal.Hypoxia-induced stroke tolerance in the mouse is mediated by erythropoietin[J].Stroke,2003,34(8):1981-1986.
[6]朱佳蕾,邓夏珩,高丽,等.白藜芦醇通过核因子-κB信号通路抑制脑缺血基质金属蛋白酶功能上调[J].中国老年学杂志,2013,33(5):1073-1075.
[7]石瑶,郭倩,周也涵,等.白藜芦醇通过Sirtuins 1通路促进自噬减轻大鼠脑缺血/再灌注损伤[J].基础医学与临床,2015,35(4):496-501.
[8]王建平,许栋乾,赵源征,等.白藜芦醇对永久性脑缺血细胞凋亡及Bcl-2表达的影响[J].中风与神经疾病杂志,2011,28(12):1078-1081.
[9]方芳,李珍,王烈成,等.白藜芦醇预处理对局灶性脑缺血/再灌注大鼠海马CA1区神经元凋亡的保护作用和机制[J].中国药理学通报,2012,28(11):1544-1548.
[10]Chevet E,Hetz C,Samali A.Endoplasmic reticulum stress-activated cell rprogram ming in oncogenesis[J].Cancer Discov,2015,5(6):586-597.
[11]Krebs J,Agellon LB,Michalak M.Ca(2+)homeostasis and endoplasmic reticulum(ER)stress:An integrated view of calcium signaling[J].Biochem Biophys Res Commun,2015,460(1):114-121.
[12]Zhu G,Lee AS.Role of the unfolded protein response,GRP78 and GRP94 in organ homeostasis[J].J Cell Physiol,2015,230(7):1413-1420.
[13]Zhao CQ,Zhang YH,Jiang SD,etal.Both endoplasmic reticulum and mitochondria are involved in disc cell apoptosis and intervertebral disc degeneration in rats[J].Age(Dordr),2010,32(2):161-177.
[收稿2015-07-08修回2015-08-21]
(编辑许四平)
[关键词]白藜芦醇;脑缺血;再灌注损伤;内质网;应激
Resveratrol ameliorates cerebral ischemia/reperfusion injury by inhibiting endoplasmic reticulum stress in rats
GAOXuan,CHENLi-Zhi,LIUZhen-Hong,LÜYan-Hua,XIALi-Wei,LIYong-Qiu.DepartmentofNeurology,TangshanWorkers′Hospital,Tangshan063000,China
[Abstract]Objective:To investigate the effect of resveratrol(Res)on endoplasmic reticulum stress induced by cerebral ischemia/reperfusion(I/R)injury in rats.Methods: The seventy-two male SD rats were divided randomly into three groups(n=20):sham operation group(group S),I/R group and Res-treatment group(group R).Focal cerebral I/R model was induced by electrocoagulation of left middle cerebral artery and occlusion of bilateral common carotid arteries followed by reperfusion after 30 min.The rats in Res group were treated with Res(50 mg/kg)i.p.7 d before the operation,once a day for 7 d.Neurological deficits were assessed at 24 h post-injury,followed by collecting the brain tissues.Cerebral infarct size was detected by TTC staining,and the water content of brain tissue were measured by wet-dry weight method.The expression of GRP78,p-PERK and CHOP proteins were deter-mined by immunohistochemistry and Western blot analysis.Results: Compared with sham group,the neurological deficit score and the brain water content were significantly increased(P<0.05),cerebral infarct size was enlarged(P<0.05),and the expression of GRP78,p-PERK and CHOP were up-regulated in I/R group(P<0.05).At the corresponding time,compared with I/R group,the neurological deficit score and the brain water content were markedly decreased(P<0.05),cerebral infarct size was smaller(P<0.05),the level of GRP78 was notablely increased(P<0.05),while the expression of p-PERK and CHOP were down-regulated in Res group(P<0.05).Conclusion: Resveratrol plays a protection role in ischemia-reperfusion injury,through inhibiting the endoplasmic reticulum stress in rats.
[Key words]Resveratrol;Cerebral ischemia;Reperfusion injury;Endoplasmic reticulum;Stress
作者简介:高轩(1974年-),女,主任医师,主要从事脑缺血/再灌注损伤机制及治疗的研究,E-mail:gaoxuan1972@yeah.net。
中图分类号R743.35
①唐山市工人医院社区医疗部,唐山063000。
文献标志码A
文章编号1000-484X(2016)01-0092-05
doi:10.3969/j.issn.1000-484X.2016.01.020
——疾病防治的新靶标