肿瘤相关巨噬细胞和CCL5在胃癌中的表达及其相关性研究①
丁海霞 赵连梅 单保恩
(河北医科大学第四医院肿瘤研究中心,石家庄050000)
肿瘤相关巨噬细胞和CCL5在胃癌中的表达及其相关性研究①
丁海霞赵连梅单保恩②
(河北医科大学第四医院肿瘤研究中心,石家庄050000)
指导教师:赵连梅(1981年-),女,医学博士,助理研究员,主要从事免疫基础研究。
[摘要]目的:研究胃癌中肿瘤相关巨噬细胞(TAM)与CCL5的表达及其相关性。方法:选择临床病理资料齐全的胃癌蜡块标本48例,癌旁组织作为对照,采用SP免疫组化法检测CD68和CCL5在胃癌组织及癌旁组织中的表达,并采用Spearman相关性统计方法对其相关性进行统计。结果:CD68和CCL5在胃癌组织中均呈阳性表达,且明显高于癌旁组织(P<0.01);CD68和CCL5与胃癌组织浸润深度、淋巴结转移情况、TNM分期情况及肿瘤分化程度均具有相关性(P<0.001),且胃癌中CD68和CCL5的表达程度呈正相关(P<0.01,r=0.759)。 结论:CD68和CCL5 对胃癌的发生、侵袭和转移起重要的促进作用,提示TAM分泌的CCL5可能促进胃癌侵袭转移。
胃癌是消化道最常见的恶性肿瘤之一,生长迅速,晚期预后差,研究显示肿瘤相关巨噬细胞参与癌症发病的各个环节[1],CD68阳性的巨噬细胞可作为胃癌根治性切除术后预后的独立危险因素[2]。胃癌微环境能够诱导巨噬细胞分化,而活化的巨噬细胞,尤其是肿瘤相关巨噬细胞通过分泌多种活性物质在局部促进肿瘤生长、侵袭和转移,在其分泌的活性物质中,细胞因子和趋化因子扮演了重要的角色。Wu等[3]报道了肿瘤相关巨噬细胞通过VEGF 和VEGF-C的表达促进胃癌的血管新生及淋巴结转移。有学者发现肿瘤相关巨噬细胞可能通过分泌CCL2和CCL5促进乳腺癌的转移[4],而后逐渐在血液系统恶性肿瘤、淋巴瘤、大量实体瘤中发现了趋化因子及其配体[5-9],CCL5作为趋化性细胞因子CC 亚族的成员之一,能够趋化肿瘤细胞及其他炎性细胞,并可调节金属蛋白酶及黏附分子表达增加细胞侵袭性[8]。国外有学者对胃癌患者血清中CCL5的表达进行了研究,发现血清中CCL5的表达与胃癌的发生、发展和转移密切相关[10],而国内尚无此类报道。CD68是胃癌肿瘤相关性巨噬细胞的标志物,本研究应用免疫组化法检测CCL5在胃癌肿瘤相关巨噬细胞中的表达,通过对CCL5与CD68的关系进行探讨,证明CCL5可能是TAM促进胃癌侵袭转移的重要趋化因子之一,从而为胃癌的治疗提供新的靶点。
1材料与方法
1.1材料
1.1.1一般资料胃癌组织取材于河北医科大学第四医院2013年48例胃癌患者,其中男28例,女20例,年龄50~75岁。术前均未行放化疗及其他抗肿瘤治疗,术后依照美国癌症联合委员会(AJCC)制定的胃癌TNM分期第七版标准记录病理类型、临床分期及分化类型。
1.1.2主要试剂CD68兔抗人单克隆抗体购自Santa Cruz Biotechnology corporation,SP免疫组化试剂盒、DAB显色试剂盒均购自中杉金桥科技公司,CCL5兔抗人单克隆抗体购自上海拜力生物科技有限公司,SP免疫组化试剂盒,DAB显色试剂盒均购自中杉金桥科技公司。
1.2方法常规HE染色,确定标本的组织分化程度,采用链霉菌抗生物素蛋白-过氧化物酶连接(SP)免疫组织化学法检测CD68和CCL5在胃癌组织和癌旁组织中的表达。石蜡切片,常规脱蜡、水化组织切片,采用枸橼酸盐缓冲液煮沸热修复30 min后冷却至室温,3%H2O237℃孵育10 min,PBS冲洗2×3 min;1∶100滴加一抗4℃冰箱过夜,PBS冲洗2×3 min;滴加二抗,37℃30 min,PBS冲洗2×3 min;DAB显色,充分冲洗后,常规脱水,透明,干燥,封片。
结果判定:依照细胞阳性着色程度(抗原含量),可分为:弱阳性(+)┅1分;中等阳性(++)┅2分;强阳性(+++)┅3分。依照阳性细胞数量,可分为:弱阳性(+ ,指阳性细胞总数在25%以下);中等阳性(++,指阳性细胞总数在25%~49%);强阳性(+++ ,指阳性细胞总数在50%以上)。 目前多采用积分综合计量。计算公式为:(+)%×1 +(++)%×2+(+++)%×3;总数值<1.0者为(+)记为1分,1.0~1.5者为(++)记为2分,>1.5者为(+++)记为3分,表达阴性者记为0分。至少随机观察5~10个HPF。
1.3统计学方法应用SPSS13.0软件进行统计学处理,CD68和CCL5在癌和癌旁组织的表达差异采用配对设计的t检验,与病理因素的相关性采用R×C的χ2进行检验,组间相关性采用Spearman相关分析,P<0.01有统计学意义。
2结果
2.1CD68在胃癌和癌旁组织中的表达CD68在胃癌组织的巨噬细胞均呈阳性表达,胞浆内含清晰的黄色或黄褐色颗粒者视为阳性,见图1箭头所示。在癌旁组织中仅1例呈弱阳性表达,根据病理评分,行配对t检验,具有明显统计学差异(P<0.01),CD68的阳性表达程度与胃癌组织大小、浸润深度、分化程度、淋巴结转移情况、TNM分期情况、远处转移呈正相关性,与年龄、性别无相关性,见表1。
表1CD68在胃癌中的表达及与病理因素的关系[n(%)]
Tab.1Relationship between expression and pathological factors of CD68 in gastric cancer[n(%)]

FeaturenExpressiondegreesandProportionofCD68++++++Pχ2Age(year)≤6520866>0.010.223>652811710GenderMale289109>0.012.817Female207310Tumorsize(cm)≤5221363<0.0114.422>5264517InvasiondepthT1+T2221642<0.0126.757T3+T4263221DegreeofdifferentiationHigh241572<0.0111.297Low245811LymphnodemetastasisNo201361<0.0119.360Yes285419PathologicalgradeⅠ-Ⅱ211452<0.0121.423Ⅲ-Ⅳ274320TumorthrombusNo181242<0.019.695Yes308616EnvelopWithout93420.0197.109Witp94827
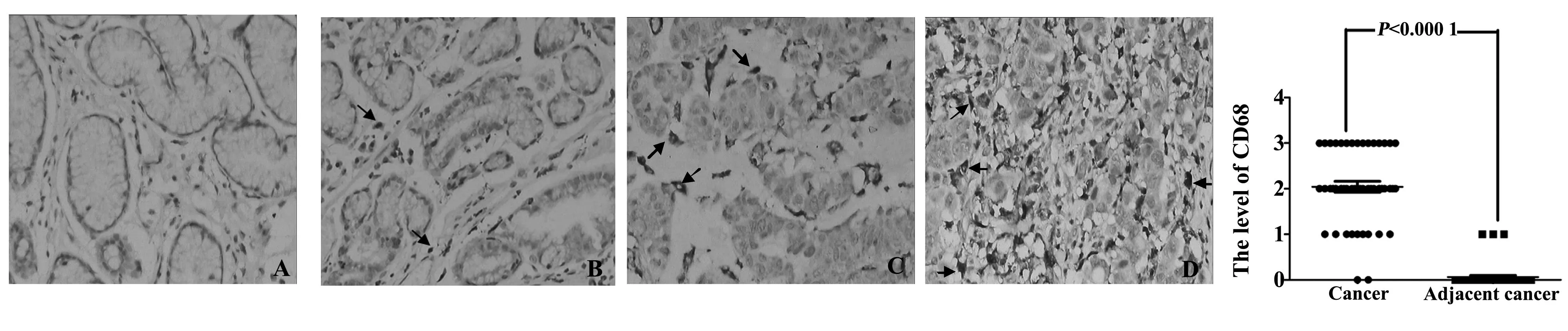
图1 CD68在胃癌组织及癌旁组织中的表达情况(SP,×200)Fig.1 Expression of CD68 in gastric cancer and precancerous tissues(SP,×200)Note: A.Grade-;B.Grade+;C.Grade++;D.Grade+++.A for precancerous tissues;B-D for cancer tissues.

图2 CCL5在胃癌组织及癌旁组织中的表达情况(SP,×200)Fig.2 Expression of CCL5 in gastric cancer and precancerous tissues(SP,×200)Note: A.Grade-;B.Grade+;C.Grade++;D.Grade+++.A for precancerous tissues;B-D for cancer tissues.
表2CCL5在胃癌中的表达及与病理因素的关系[n(%)]
Tab.2Relationship between expression and pathological factors of CCL5 in gastric cancer[n(%)]

FeaturenExpressiondegreesandproportionofCCL5++++++Pχ2Age(year)≤6520956>0.010.423>652810810GenderMale289910>0.012.313Female201037Tumorsize(cm)≤5221264<0.0113.206>5263617InvasiondepthT1+T2221651<0.0132.510T3+T4262321DegreeofdifferentiationHigh241563<0.0110.477Low245712LymphnodemetastasisNo201271<0.0118.467Yes284618PathologicalgradeⅠ-Ⅱ211443<0.0119.924Ⅲ-Ⅳ273420TumorthrombusNo181152<0.019.937Yes308517EnvelopWithout94230.0644.636Witp95925

图3 CCL5与CD68在胃癌中表达的相关性(r=0.759)Fig.3 Correlation between CCL5 and CD68 in gastric cancer(r=0.759)Note: Spearman correlation analysis suggested the expression of CD68 and CCL5 in gastric carcer tissues was positively correlated(r=0.759,P<0.01).
2.2CCL5在胃癌和癌旁组织中的表达CCL5在胃癌组织中呈阳性表达,胞浆内含清晰的黄色或黄褐色颗粒者视为阳性,癌旁组织中为阴性表达,见图2箭头所示。根据病理评分,行配对t检验,具有明显统计学差异(P<0.01),CCL5的阳性表达程度与胃癌组织浸润深度、淋巴结转移情况、TNM分期情况及肿瘤分化程度呈正相关性,与年龄、性别、远处转移无相关性,见表2。
2.3CCL5与CD68在胃癌中表达的相关性研究经Spearman相关分析,胃癌组织中CCL5与CD68的表达有显著的相关性,且呈正相关(r=0.759),见图3。
3讨论
侵袭、转移使得胃癌死亡率不断上升,而且行胃癌根治性切除术后患者复发转移的几率仍然很大[11]。因此目前对胃癌的靶向治疗逐渐成为人们关注的焦点。而靶向治疗的关键是寻找到新的靶点,对其进行阻断或增强其功能使其发挥抗肿瘤作用。吉非替尼(gefitinib)可通过减少由间充质干细胞分泌的CCL5的数量负性影响表皮生长因子受体酪氨酸激酶,抑制肿瘤细胞的生长,抑制血管生成因子的侵入和分泌[12]。而CCL5在胃癌中的作用研究相对较少。本文通过CCL5与肿瘤相关巨噬细胞的表面标志物CD68在胃癌组织中的表达及其相关性进行研究,期望为胃癌的靶向治疗提供重要的理论依据。
肿瘤相关巨噬细胞(Tumor associated macroph-ages,TAM)是肿瘤间质免疫细胞的重要部分,可分泌多种细胞因子和趋化因子导致发生上皮-间质转化(Epithelial-mesenchymal transition,EMT),即上皮细胞向间质细胞转化,侵袭转移能力增强[13]。研究发现,微环境中大量TAM有利于胃癌的生长并导致患者预后不良[14]。本研究结果与上述文献一致,CD68的表达与胃癌组织大小、浸润深度、分化程度、淋巴结转移情况、TNM分期、远处转移呈正相关性,与年龄、性别无相关性。
CCL5即调节活化正常 T 细胞表达与分泌的趋化因子(Regulated upon activation normal T cell expressed and secreted,RANTES),是分子量为8 kD的小分子蛋白,主要由CD8+T 淋巴细胞及巨噬细胞分泌,能够诱导白细胞向炎症部位浸润。RANTES 特异性受体包括 CCRl、CCR3、CCR4 和 CCR5。CCR1 和 CCR5 是高亲和力受体[15]。CCL5通过其受体发挥作用,当两者结合后激活G蛋白并最终引起细胞内钙离子浓度上升及蛋白激酶C的活化,趋化白细胞、调节性T细胞、单核细胞的迁移和增殖,有研究显示CCR5-CCL5轴与癌症转移密切相关,天然中药DT-13通过CCR5-CCL5轴抑制胃癌细胞的转移[16],Yanagie等[17]在胃癌研究中对趋化因子受体不同的cDNA基因比较发现,趋化因子CCL5上调,其受体CCR5涉及到胃癌的扩散,其表达水平同样可作为胃癌患者生存的一个不良因素,阻断CCR5后胃癌患者的生存期明显延长[18]。而在本研究中发现CCL5在胃癌组织中的表达与胃癌的大小、淋巴结转移、组织浸润、分化程度呈正相关性,与年龄、性别、远处转移无相关性,符合上述结果。
CD68是TAM的表面标志,本研究显示CCL5与CD68的表达呈正相关,说明CCL5的分泌可能是TAM促进胃癌发生发展和转移重要原因之一,该结论将为胃癌的治疗提供新的治疗靶点。在将来的动物试验中将应用药物下调或封闭CCL5的受体CCR5后观察肿瘤的生长、转移情况,为临床提供理论依据。
综上所述,CD68和 CCL5对胃癌组织的大小、浸润程度、淋巴结转移、肿瘤分化程度起重要的促进作用,这一结论与胃癌血清中CCL5浓度的检测结果一致[11]。随着分子生物学技术的发展,CCL5可能成为胃癌治疗的新靶点,为胃癌的靶向治疗提供生物学依据,为胃癌的治疗提供新的手段。
参考文献:
[1]Mukhtar RA,Nseyo O,Campbell MJ,etal.Tumor-associated macrophage in breast cancer as potential biomarkers for new treatments and diagnostics [J].Expert Rev Mol Diagn,2011,11(1):91-100.
[2]Wang B,Xu D,Yu X,etal.Association of intra-tumoral infiltrating macrophages and regulatory T cells is an independent prognostic factor in gastric cancer after radical resection [J].Ann Surg Oncol,2011,18(9):2585-2593.
[3]Wu H,Xu JB,He YL,etal.Tumor-associated macrophages promote angiogenesis and lymphangiogenesis of gastric cancer [J].Surg Oncol,2012,106(4):462-468.
[4]Soria G,Ben-Baruch A.The inflammatory chemokines CCL2 and CCL5 in breast cancer [J].Cancer Lett,2008,267(2):271-285.
[5]Vallet S,Pozzi S,Patel K,etal.A novel role for CCL3 in myeloma-induced bone disease via osteocalcin downregulation and inhibition of osteoblast function[J].Leukemia,2011,25(7):1174-1181.
[6]Dairaghi DJ,Oyajobi BO,Gupta A,etal.CCR1 blockade reduces tumor burden and osteolysis in vivo in a mouse model of myeloma bone disease[J].Blood,2012,120(7):1449-1457.
[7]Lv D,Zhang Y,Kim HJ,etal.CCL5 as a potential immunotherapeutic target in triple-negative breast cancer [J].Cell Mol Immunol,2013,10(4):303-310.
[8]Lin S,Wan S,Sun L,etal.Chemokine C-C motif receptor 5 and C-C motif ligand 5 promote cancer cell migration under hypoxia [J].Cancer Sci,2012,103(5):904-912.
[9]Zhang Y,Lv D,Kim HJ,etal.A novel role of hematopoietic CCL5 in promoting triple-negative mammary tumor progression by regulating generation of myeloid-derived suppressor cells[J].Cell Res,2013,23(3):394-408.
[10]Sima AR,Sima HR,Rafatpanah H,etal.Serum chemokine ligand 5(CCL5/RANTES)level might be utilized as a predictive marker of tumor behavior and disease prognosis in patients with gastric adenocarcinoma[J].J Gastrointest Cancer,2014,45(4):476-480.
[11]Zhao ZJ,Zhang RP,Wang G,etal.Prognosis of patients with recurrence after curative resection of advanced gastric cancer[J].Chin J Gastrointest Surg,2011,14(2):107-110.
[12]Borghese C,Cattaruzza L,Pivetta E,etal.Gefitinib inhibits the cross-talk between mesenchymal stem cells and prostate cancer cells leading to tumor cell proliferation and inhibition of docetaxel activity[J].J Cell Biochem,2013,114(5):1135-1144.
[13]Galdiero MR,Garlanda C,Jaillon S,etal.Tumor associated macrophage and neutrophils in tumor progression[J].J Cell Physiol,2013,228(7):1404-1412.
[14]Zhang QW,Liu L,Gong CY,etal.Prognostic signicance of tumor-associated mac-rophages in solid tumor:a meta-analysis of the literature[J].PLoS One,2012,7(12):483-496.
[15]Sigrist S,Oberholzer J,Bohbot A,etal.Activation of human macrophages by allogeneic islets preparations:inhibition by AOP-RANTES and heparinoids[J].Immunology,2004,111(4):416-421.
[16]Lin Sen-Sen,Fan Wei,Sun Li,etal.The saponin DT-13 inhibits gastric cancer cell migration through down-regulation of CCR5-CCL5 axis[J].Chin J Nat Med,2014,12(11):833-840.
[17]Yanagie H,Hisa T,Ono M,etal.Chemokine and chemokine receptor related to cancer metastasis[J].Gan To Kagaku Ryoho,2010,37(11):2052-2057.
[18]Mencarelli A,Graziosi L,Renga B,etal.CCR5 antagonism by maraviroc reduces the potential for gastric cancer cell disse mination[J].Transl Oncol,2013,6(6):784-793.
[收稿2015-04-07修回2015-07-16]
(编辑张晓舟)
[关键词]胃癌;TAM;CCL5
Expression and correlation of tumor-associated macrophages and CCL5 in ganstric cancer
DINGHai-Xia,ZHAOLian-Mei,SHANBao-En.DepartmentofInstituteofCancerResearch,theFourthHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China
[Abstract]Objective:To study the expression and correlation of tumor-associated macrophages(TAM) and CCL5 in ganstric cancer.Methods: 48 cases patients with completed clinical and pathological data of gastric cancer paraffin block specimens were selected.Cancer tissues and adjacent tissues were used as control,using SP immunohistochemical method to detect CD68 and CCL5 in gastric cancer tissues and adjacent tissues,and using the Spearman correlation statistics statistical methods for the correlation.Results: CD68 and CCL5 showed positive expression in gastric cancer tissue,significantly higher than those in the adjacent tissues(P<0.01),CD68 and CCL5 were related with gastric cancer invasion depth,lymph node metastasis,TNM stage and tumor differentiation(P<0.001).There was positive relation between the expression of CD68 and CCL5 in gastric cancer(P<0.01,r=0.759).Conclusion: CD68 and CCL5 played a driving role to the invasion and metastasis of gastric cancer occurrence,suggesting that the secretion CCL5 by TAM may promote the invasion and metastasis of gastric cancer.
[Key words]Ganstric cancer;Tumor associated macrophages(TAM);CCL5
作者简介:丁海霞(1981年-),女,硕士,主治医师,主要从事内分泌与免疫机制的研究。
通讯作者②。
中图分类号R735.2
①本文为河北省自然科学基金资助项目(No.H2015206376)。
文献标志码A
文章编号1000-484X(2016)01-0074-05
doi:10.3969/j.issn.1000-484X.2016.01.016