藻类叶绿素a/叶绿素b型捕光蛋白复合体结构与功能的研究进展
徐冉++侯和胜++佟少明
摘 要:藻类的Chl a/Chl b型捕光蛋白复合体,结合叶绿素a和叶绿素b,主要存在于绿藻、裸藻、轮藻和黄藻中,具有3个α-螺旋的跨膜区,其中第一、第三螺旋的氨基酸序列在植物界中高度保守,是叶绿素a的结合位点;第二个跨膜区的保守的氨基酸序列则为叶绿素b的结合位点。LHC在捕获和传递光能,光保护和过剩能量耗散,调节光能在两个光系统中的分配,维持类囊体膜的结构等方面起着重要的作用。虽然对高等植物的LHC的研究日渐深入,但对藻类捕光色素蛋白复合体的认识远不及高等植物。本文通过比较藻类Chl a/Chl b型的LHC与高等植物LHC结构和功能的异同点,可为进一步加深对藻类LHC结构和功能的理解奠定基础。
关键词:光合系统;捕光蛋白复合体;光合作用
中图分类号:Q244 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2016.02.006
Research Progress of the Chl a/Chl b Type Light-harvesting Complex Protein in Algae
XU Ran, HOU Hesheng ,TONG Shaoming
(Key Laboratory of Plant Biotechnology of Liaoning Province, School of Life Science, Liaoning Normal University, Dalian, Liaoning 116081,China)
Abstract :Chlorophyll a/chlorophyll blight-harvesting complex (LHC) which can bind two kinds of pigments including chlorophyll a and chlorophyll b mainly exists in the green algae, euglenophyta, charophyta and xanthophyta. It has three α-helixes, which the first and the third helix are highly conserved at the amino acids sequence in the plant kingdom. The first and the third helix contain the binding sites of chlorophyll a, while the second helixes contains the binding sites of chlorophyll b. LHC is the most important apparatus to absorb solar energy and also plays an important role in photoprotection, heat dissipation and in proper energy distribution between the two photosystems. Additionally, LHC plays very important roles in maintaining the thylakoid structure in grana. Although the study about LHC is comprehensive and in-depth, understanding of the structure and function of LHC of the algae is still less than higher plants. The similarities and differences of the structure and function of LHC between various algae and higher plants have been found, but the structure and function of LHC of algae need to be further investigated.
Key words:photosynthetic system; light-harvesting complex; photosynthesis
藻类主要生活在海洋、湖泊与河流中,在水生生态系统中发挥着初级生产者的重要作用,共有约2 100属,27 000种,可分为绿藻门、裸藻门、轮藻门、黄藻门、金藻门、硅藻门、甲藻门、褐藻门、红藻门和蓝藻门等10门[1]。捕光蛋白复合体(Light-harvesting complex,LHC)是一类由核基因(Lhc)编码的蛋白质与各类色素结合,形成的具有各种构型的色素蛋白复合体[2],以单体、二聚体以及其它的聚集状态镶嵌于类囊体膜上,能够捕获光能,并把能量迅速传至反应中心(Reaction center ,RC)引起光化学反应。在藻类中,根据所含LHC种类的不同,又可将10门藻类分成3大类[2]:(1)叶绿素a(Chl a)/叶绿素b(Chl b)捕光蛋白复合体型;(2)Chl a/叶绿素c(Chl c)捕光蛋白复合体型;(3)藻胆体型。本研究将通过阐述Chl a/ Chl b捕光蛋白复合体型的藻类与高等植物LHC结构和功能的异同点,来进一步加深对藻类LHC结构和功能的理解。
1 LHC色素
与高等植物相比,藻类Chl a/ Chl b捕光蛋白复合体中Chl b含量较高,Chl a/Chl b比值普遍较低,且因门类或种类不同而差别较大,从0.6~2.7不等,海洋绿藻的比值最低,一般在0.6~1.0[3],原始绿藻的捕光色素比较特殊,同时含有Chl a、Chl b及Chl c 3种叶绿素(Chl a/Chl b≈0.7~0.9)以及一种特殊的叶黄素-草绿黄素(Prasinoxanthin),如Micromonadophyceae中的Mantoniella squamata和Micromonaspullsilla。目前,虽然将这类原始绿藻的捕光复合体归入Chl a/ Chl b蛋白复合体中,但也有观点认为它是杂色藻向绿藻进化的过渡态。虽然不同藻类色素比值均在一定范围内,但当藻类处于各种胁迫环境时,其色素的比值与复合体的构型会发生不同程度的改变,与之相比,高等植物Chl a/Chl b比值则更为稳定,大多在2~3[4]之间。
2 LHC蛋白
绿藻等藻类的PS I和PS II含有各自的捕光蛋白,分别为LHC I和 LHC II, 由相应的核基因(Lhca和Lhcb)编码,翻译后的多肽结合叶绿素和胡萝卜素等色素插入到类囊体膜上,在不同藻类中,捕光蛋白的结构和生理功能也不尽相同。
2.1 藻类及高等植物的LHCI蛋白
PSⅠ主要由RC和LHC I组成。LHC I含约100个Chl,Chl a/Chl b≈3~4,具有4条多肽,分子量≈10~24 kDa,其中21 kDa的多肽是PS I长波长荧光(730 nm)发射的来源,而23 kDa和24 kDa多肽则是短波长荧光(680 nm)发射的来源[5]。
与高等植物相比,藻类的PS I中只有Lhca3编码的蛋白同系物存在,起着连接LHC I捕光系统和PS I的重要作用。在绿藻中,当铁缺失时,Lhca3的N-末端被识别并移除,导致LHC I构型改变,从而有效减少多余能量从LHC I转移至PS I;在衣藻中,Lhca3基因缺失可引发所有LHC I蛋白损耗,从而减少光能的吸收与传递;在杜氏盐藻中,铁胁迫可以引起Lhca3变化,引起LHC I结构改变,从而增大PS I捕光系统,平衡光系统中的激感现象[6]。Lhca2和Lhca9是绿藻特有的Lhca基因,其编码蛋白组成的亚基直接与PS I相连,将多余能量从低聚的LHC I传递到PS I。与色素相比,藻类LHC中捕光蛋白的组成更为稳定。
2.2 藻类及高等植物的LHC II蛋白
在PS II中,藻类的LHC II蛋白与高等植物具有较高的相似性,均含有由Lhcb1~Lhc6基因编码的6种多肽与色素非共价结合形成的LHC II中的几种。
在藻类LHCB蛋白家族中,LHCB1含量最多,研究最为深入。每个LHCBI含有232个氨基酸残基,分子量≈28 kDa,具有3个跨膜α-螺旋,每个多肽结合8个Chl a,6个Chl b,2个叶黄素,1个新黄素和不定量的紫黄素分子,其中两个叶黄素分子位于中心,周围围绕着紧密结合的Chl a和Chl b分子,除此之外,每个LHCB1单体又含有两个反式的黄体素(Lut),一个9-顺式新黄质(Noe)和一个不确定的类胡萝卜素(Car)分子[7],其中Lut与LHCB1的结合主要用于调控α螺旋的正确折叠和能量传递;强光下,不确定的Car结合位点结合紫黄质(Vio),在脱环氧化酶的作用下形成玉米黄素(Zea),利用叶黄素循环来抵御光破坏。
成熟的LHCB2与LHCB1具有很高的相似性(约85%以上)[8],其含量在LHCB中仅次于LHCB1,约含228个氨基酸残基,分子量为27 kDa,在氨基酸N端有14个位点与LHCB1不同,其中11个在基质侧、2个在类囊体囊腔侧、1个在第一个跨膜螺旋区,这些结构上的差异导致两种蛋白质功能上的不同,如磷酸化过程中,LHCB2比LHCB1速率快。
LHCB1和LHCB2在植物体内主要以三聚体的形式存在,由于二者是随机结合,所以LHCB2/LHCB1含量的比值会有所不同,同时也可以寡聚体的形式存在。例如在黄化植物恢复转绿的过程中,二者的三聚体结构就会转化为寡聚体形式存在。此外,当PS II捕光系统变大时,LHCB2/LHCB1含量的比值增加,如低光下,植物叶片的Lhcb2的表达量是高光强下的3~4倍[9],且Chl b/a比值变大。因此,有人推测LHCB2可能参与不同光强下的长期调控。
LHCB3含有223个氨基酸残基,分子量为25 kDa,与LHCB1氨基酸序列相似性在70%以上[10],不参与磷酸化,不易脱离PS II,目前对于其在体内存在的状态主要有以下3种观点:(1)与LHCB1和LHCB2一起形成三聚体;(2)独自形成三聚体;(3)以单体的形式存在。虽然各自都有一定的实验证据支持,但尚无定论。
LHCB4在绿藻LHCB家族中分子量最大且Vio含量最高,含257个氨基酸残基,具有异质性。Chl结合位点为混合位点,结合6个Chl a ,2个Chl b。尽管LHCB4与LHCB1的相似性仅为34.3%[11],但在跨膜螺旋区,结合色素的配体和掩埋离子对的残基是相对保守的。LHCB4与其它LHCB多肽的主要差异是LHCB4的N端有42个亲水氨基酸残基插入,并在此区含有磷酸化位点。
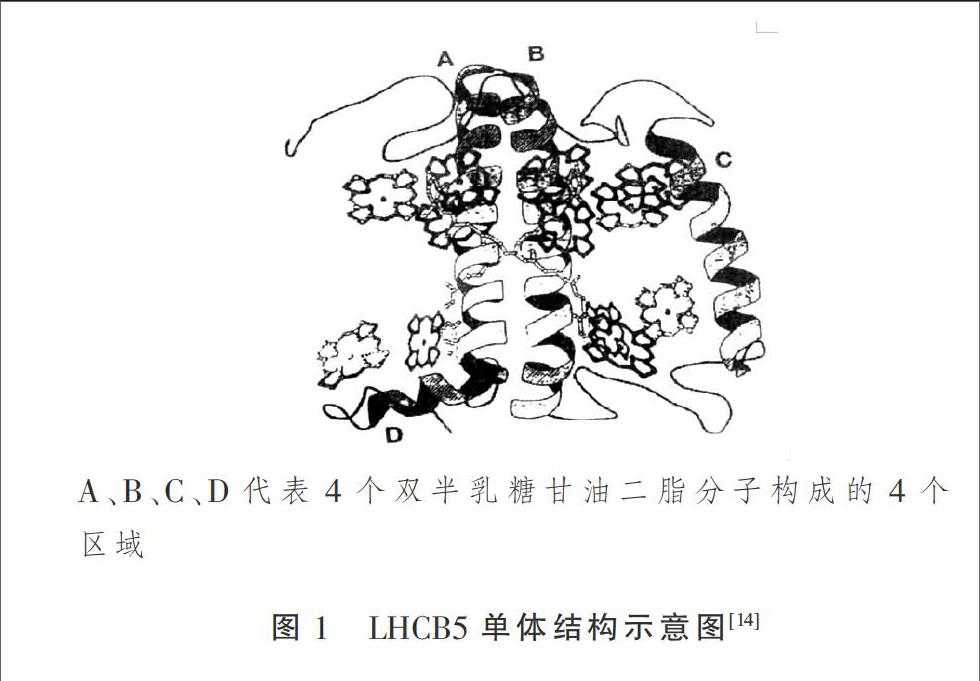
LHCB5含有247个氨基酸残基,结合6个Chl a,3个Chl b,与LHCB1的相似性约为48.7%[12],他们的螺旋A区和C端结构非常相似,主要差异在螺旋C区(图1),此部分的相似性很低。LHCB5结合有Cu2+,因此,推测其可能是叶黄素循环中的氧化酶之一。在LHCBl和LHCB2缺乏的植物中,LHCB5可以代替它们和LHCB3形成三聚体结构,并且还能形成C2S2M2型[13](C:反应中心;S:与C结合紧密的三聚体;M:与C结合程度中等的LHCII)LHC ll-PS II超复合体结构,但LHCB5缺少磷酸化的功能,所以该植物不能在强光下生长,说明LHCB5仅能在一定程度上代替LHCB1和LHCB2的功能。
LHCB6是LHCB中较小的蛋白,含210个氨基酸残基,结合6个Chl a和4个Chl b分子,与其他LHCB相比,LHCB6与LHCB1相似性最低,约为29.2%[15],其蛋白构象缺少暴露在囊腔的C端和螺旋D区,这使其结合的色素在提取中极易丢失,但Chl b可起到稳定其结构的作用。LHCB6缺乏时,植物PS Ⅱ捕光受到干扰,与PS Ⅱ的RC之间的连接减弱,使类囊体膜上的微观组织发生变化,光合效率降低,但类囊体膜中的色素和蛋白含量几乎不变。因此,LHCB 6 对于PSⅡD的结构和功能都非常重要[16]。
除此之外,LHCB7~LHCB9只在极个别物种中存在。多数藻类中含有与高等植物LHCB4~6功能相似的多肽,且在跨膜α-螺旋处具有高度保守性,但是分子量大小不同,也正是这些微小差别决定了它们在功能上的特异性,如莱茵衣藻、盐生杜氏藻等。
3 LHC蛋白的功能
3.1 光能的捕获及传递
研究表明,在PS I中,类胡萝卜素分子吸收光能后迅速将其传递给周围的7个Chl a分子,然后能量在Chl a与Chl b分子之间传递,直至达到稳定平衡。
在PSⅡ中,每个单体结合220~230[17]个捕光色素分子,多数以二聚体形式存在。LHCⅡ将获得的能量经过复杂的过程传递至RC并以稳定化学能的形式储存起来。由于能量是在Chl a和Chl b分子间传递,因此LHCⅡ所发出的荧光由二者共同发射。
3.2 激发能分配的调控
LHCB蛋白通过磷酸化和脱磷酸化参与PS I与PS II间的激发能分配,此分配过程由质体醌(Plastoquinone, PQ)库的氧化还原状态控制的激酶来调节。
当PQ库处于还原状态且与细胞色素b6/f(Cytb6f)的Qo位点结合时,磷酸激酶活化,催化LHCB蛋白磷酸化,使其从富含PS II的基粒膜区迁移到富含PS I的间质膜区或基粒的边缘膜区,使能量利于向PS I的分配;当PQ库处于氧化状态时,磷酸激酶被钝化,磷酸化的LHCB蛋白脱磷酸化,迁移的LHCB重新回到基粒膜区,使能量利于向PS II的分配[18]。在迁移过程中,LHCB可以以单体、二聚体、三聚体和寡聚体形式存在。在红藻中,尽管有一些蛋白可以磷酸化,但这些蛋白并不参与激发能分配的调节。
3.3 能量的耗散与光保护
研究发现,藻类主要通过降低能量捕获和消耗过多能量这两种机制来避免强光对自身的损伤,如强光下,一些Lhc基因表达量会不同幅度下降;而在非辐射耗散(Nonphotochemical dissipation, NPD)中则主要通过LHC蛋白参与的复杂机制来实现。
NPD通过质子化过程改变色素分子的位置及其附近的电荷密度诱导能量的传递以达到荧光淬灭的目的,LHCB4~6由于含Zea和Vio较多而参与其中,主要通过降低激发单线态的最低能量或刺激LHC II的聚集状态来提高能量的耗散 [19]。
4 结论与展望
目前,对于藻类捕光蛋白色素复合体的研究具有明显的不均衡现象,一些Chl蛋白复合体,如原绿藻LHC中的某些多肽,已经在空间结构、能量传递及分子生物学方面取得了许多重要的成果[20],但对大多数Chl a/ Chl b捕光蛋白复合体型藻类LHC的整体特点,包括多肽的组成、相互关系以及色素的结合情况等却并不清楚,相信随着研究手段的不断提高,在不久的将来这一领域定会获得突破性的进展。
参考文献:
[1] XIA B M. Checklist of marine algae of China[M]// Liu R Y. Checklist of marine biota of China seas.Beijing: Science Press,2008:35-40, 97-107, 252-284.
[2] JONATHAN A. Structural and functional diversification of the light-harvesting complexes in photosynthetic eukaryotes[J].Photosynth Res, 2010,106:57-71.
[3] WOLF G R, CUNNINGHAM F X, GRABOWSKI B, et al. Isolation and characterization of photosystems I and II from the red alga Porphyridium cruentum[J]. Biochim Biophys Acta, 1994, 1188: 357-366.
[4] KOZIOL A G, BORZA T, ISHIDA K, et al.Tracing the evolution of the light-harvesting antennae in chlorophyll a /b-containing organisms[J]. Plant Physiol, 2007,143: 1802-1816.
[5] DION G D, JULIE A P. Light-harvesting complex gene expression is controlled by both transcriptional and post-transcriptional mechanisms during photoacclimation in Chl amydomonas reinhardtii[J]. Plant Physiol, 2003, 118:193-205.
[6] QIN X, SUGA M, KUANG T, et al. Photosynthesis. Structural basis for energy transfer pathways in the plant PSI-LHCI supercomplex[J]. Science, 2015, 348(6238):989-995.
[7] LUCI?SKI R, JACKOWSKI G. The structure, functions and degradation of pigment-binding proteins of photosystem Ⅱ[J]. Acta Biochimica Polonica, 2006, 53(4):693-708.
[8] ELISABETTA C, CATHY Y. Coherently wired light-harvesting in photosynthetic marine algae at ambient temperature[J]. Nature,2010,463:644-647.

