抑制环氧合酶对苯肾上腺素所致大鼠主动脉收缩的影响
杨逸童,房龙梅,李亚君,王 燕,牛龙刚,刘 宇,张明升
抑制环氧合酶对苯肾上腺素所致大鼠主动脉收缩的影响
杨逸童,房龙梅,李亚君,王 燕,牛龙刚,刘 宇,张明升
目的 通过观察环氧合酶(COX)抑制剂和血栓素A2(TXA2)受体阻断药对苯肾上腺素(PE)所致大鼠胸主动脉收缩的影响,探讨前列腺素类物质及TXA2受体激动在PE所致收缩中的作用。方法 采用Powerlab 血管张力记录系统记录肌张力,通过比较用不同抑制剂前后血管对PE的收缩反应的差异,探讨PE收缩与前列腺素类物质的关系。结果 吲哚美辛(10-5mol/L)可显著抑制PE(10-8mol/L~10-6mol/L)的收缩作用,最大抑制收缩百分比为(46.26±2.54)%,且此作用无内皮依赖性;而对KCl(20 mmol/L~108 mmol/L)的收缩则无显著影响。COX-1抑制剂(SC-560,10-5mol/L)对PE的缩血管作用无确切抑制作用,而COX-2抑制剂(NS-398,10-5mol/L)则明显的抑制PE对主动脉的收缩,最大抑制收缩百分比为(61.83±5.57)%。TXA2阻断剂对PE缩血管作用均无显著影响。 结论 PE可通过COX,且主要是COX-2,收缩血管。
吲哚美辛;主动脉环;环氧合酶;血栓素A2;苯肾上腺素
前列环素(prostaglandin,PG)是存在于动物和人体中的一类不饱和脂肪酸组成的,具有多种生理作用的活性物质。花生四烯酸(arachidonic acid,AA)是这个大家族的共同前体。AA在生物体内主要在磷脂酶A2和磷脂酶C的作用下分解成游离的AA。游离的AA在环氧合酶(cyclo-oxygenase,COX)作用下,先形成不稳定的环内过氧化物(PGG2和PGH2),随后PGG2、PGH2又经不同的下游酶作用生成各种经典型PGs,如PGE2/PGD2和PGF2。除此之外,PGH2还能代谢成为活性更强、生物功能更复杂的两种类前列腺素,一种是血栓素A2(thromboxanlA2,TXA2),另一种是前列环素I2(prostacylin,PGI2)[1-2]。
吲哚美辛(Indomethacin,Indo)又名消炎痛,为人工合成的吲哚衍生物,是一种较强的非选择性COX抑制剂,属非甾体类抗炎药,具有抗炎、镇痛及抗血栓的作用。最初主要用于治疗风湿性、类风湿性关节炎、急性痛风等。随着对吲哚美辛药理作用研究的深入,逐渐被临床上用于泌尿系统、心血管系统、消化系统、神经系统等疾病的治疗。COX最主要的同工酶是:COX-1、COX-2[3-4]。本课题主要研究Indo是否参与苯肾上腺素(phenylephrine,PE)缩血管作用;如果参与,那么与COX-1、COX-2及其下游产物是否有关。
1 材料与方法
1.1 药品与试剂 吲哚美辛、COX-1抑制剂(SC-560)、COX-2抑制剂(NS-398)、TXA2抑制剂(SQ-29458、ICI-192605)均购自Sigma公司,PE为上海禾丰制药有限公司生产,其余试剂均为市售分析纯。
1.2 实验动物 健康雄性SD大鼠,体重220 g~280 g,由山西医科大学实验动物中心提供。
1.3 实验仪器 BL-420F生物信号采集分析系统及张力换能器(澳大利亚埃德国际贸易公司)、SartoriusBS124S精密天平(北京赛多利斯生产)、PHS-3C精密pH计(上海雷磁生产)、HSS-1B数字式超级恒温泵(成都仪器厂)。
1.4 生理性营养液 正常生理盐水营养液PSS成分为:NaCl 144 mmol/L,KCl 5.8 mmol/L,MgCl21.2 mmol/L,CaCl22.5 mmol/L,Glucose 11.1 mmol/L,HEPES 5 mmol/L。K-PSS成分为:NaCl 89.8 mmol/L,KCl 60 mmol/L,MgCl21.2 mmol/L,CaCl22.5 mmol/L,Glucose 11.1 mmol/L,HEPES 5 mmol/L。上述营养液均用2 mol/L NaOH将pH值调至7.40,预热至37 ℃。本实验所述浓度均为浴管内试剂的终浓度。
1.5 实验方法
1.5.1 大鼠离体主动脉环的制备与基本实验程序 将雄性大鼠脱臼处死,迅速取出主动脉,将其放入O2饱和的4 ℃PSS液中(pH=7.40)。固定好后剔除血管环周围组织,并将其剪成2 mm~3 mm的血管环,用两根不锈钢微型挂钩贯穿血管腔,一端固定,另一端与张力换能器相连。其静息张力调节为2.2 g,经PowerLab生物信号测定系统来记录血管环张力变化。实验期间浴管内的5 mL液体为持续通以100%O2、pH值为7.40、37 ℃的PSS。所有动脉环用60 mmol/L KCl多次刺激。当标本对刺激稳定时,即连续2次同样的刺激所引起的收缩幅度差别<5%时,开始正式实验。部分血管环去内皮:用与血管内径相适的棉棒穿过管腔,擦除内皮,用60 mmol/L KCl预收缩血管,收缩达坪值后,加入Ach(10-5mol/L),血管环张力变化幅度<5%时,可认为内皮去除完全。
1.5.2 吲哚美辛对PE缩血管作用的影响 主动脉环稳定2 h后,向浴管中累积加入PE,使浴管内终浓度分别达到10-8mol/L、3×10-8mol/L、10-7mol/L、3×10-7mol/L、10-6mol/L,构建PE浓度-收缩效应曲线。当达最大收缩效应时,用新鲜的PSS冲洗标本3次,30 min后重新构建PE浓度-收缩效应曲线。当连续两次同样的刺激所引起的收缩幅度差别<5%时,向浴管内加入Indo,使浴管内终浓度达到10-5mol/L。孵育30 min后,重建PE浓度-收缩效应曲线,观察Indo对PE缩血管作用的影响。
1.5.3 环氧合酶选择性抑制剂对PE缩血管作用的影响 向浴管内分别加入COX-1抑制剂SC-560、COX-2抑制剂NS-398,使浴管内终浓度均达到10-5mol/L,孵育30 min后,在此药物浓度基础上重建PE浓度-收缩效应曲线,观察环氧合酶选择性抑制剂对PE缩血管作用的影响。
1.5.4 TXA2阻断剂对PE缩血管作用的影响 主动脉环稳定2 h后,向浴管中加入PE,使浴管内终浓度达到10-6mol/L,收缩达坪值后用新鲜的PSS冲洗标本3次,30 min后再次加入同浓度的PE,当连续两次同样的刺激所引起的收缩幅度差别<5%时,向浴管内分别加入TXA2阻断剂SQ-29458和ICI-192605,使浴管内终浓度均达到10-5mol/L。孵育30 min后,在此药物浓度基础上再次加入终浓度为10-6mol/L的PE,观察SQ-29458和ICI-192605对PE缩血管作用的影响。
2 结 果
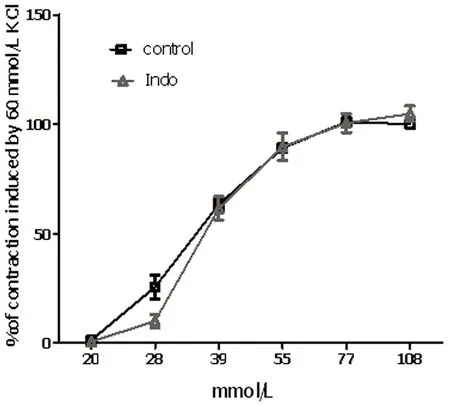
2.1 Indo对PE缩血管作用的影响 无论是内皮完整还是去内皮,Indo(10-5mol/L)均可显著抑制PE(10-8mol/L~10-6mol/L)的缩血管作用(P<0.05),其最大抑制率分别为(46.26±2.54)%和(46.07±11.93)%,两者之间差异无统计学意义。而Indo对KCl(20 mmol/L~108 mmol/L)的缩血管作用则无显著影响(P>0.05)。详见图1。
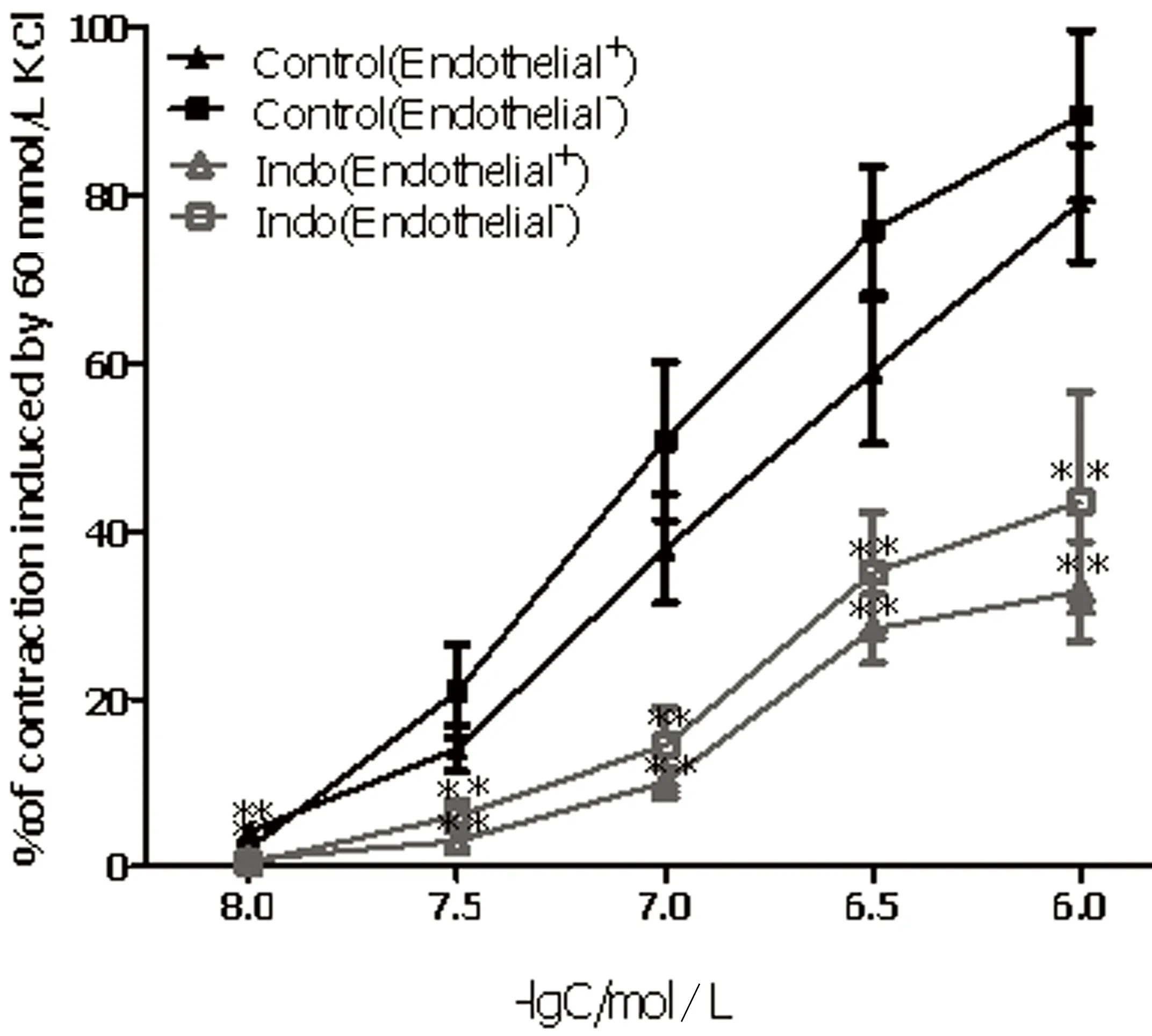
注:**P<0.05。
2.2 选择性COX抑制剂对PE缩血管作用的影响 COX-1抑制剂SC-560(10-5mol/L)对PE缩血管作用并无确切抑制收缩的作用,COX-2抑制剂NS-398(10-5mol/L)则可显著抑制PE的缩血管作用(P<0.05),其最大抑制率为(61.83±5.57)%。详见图2。
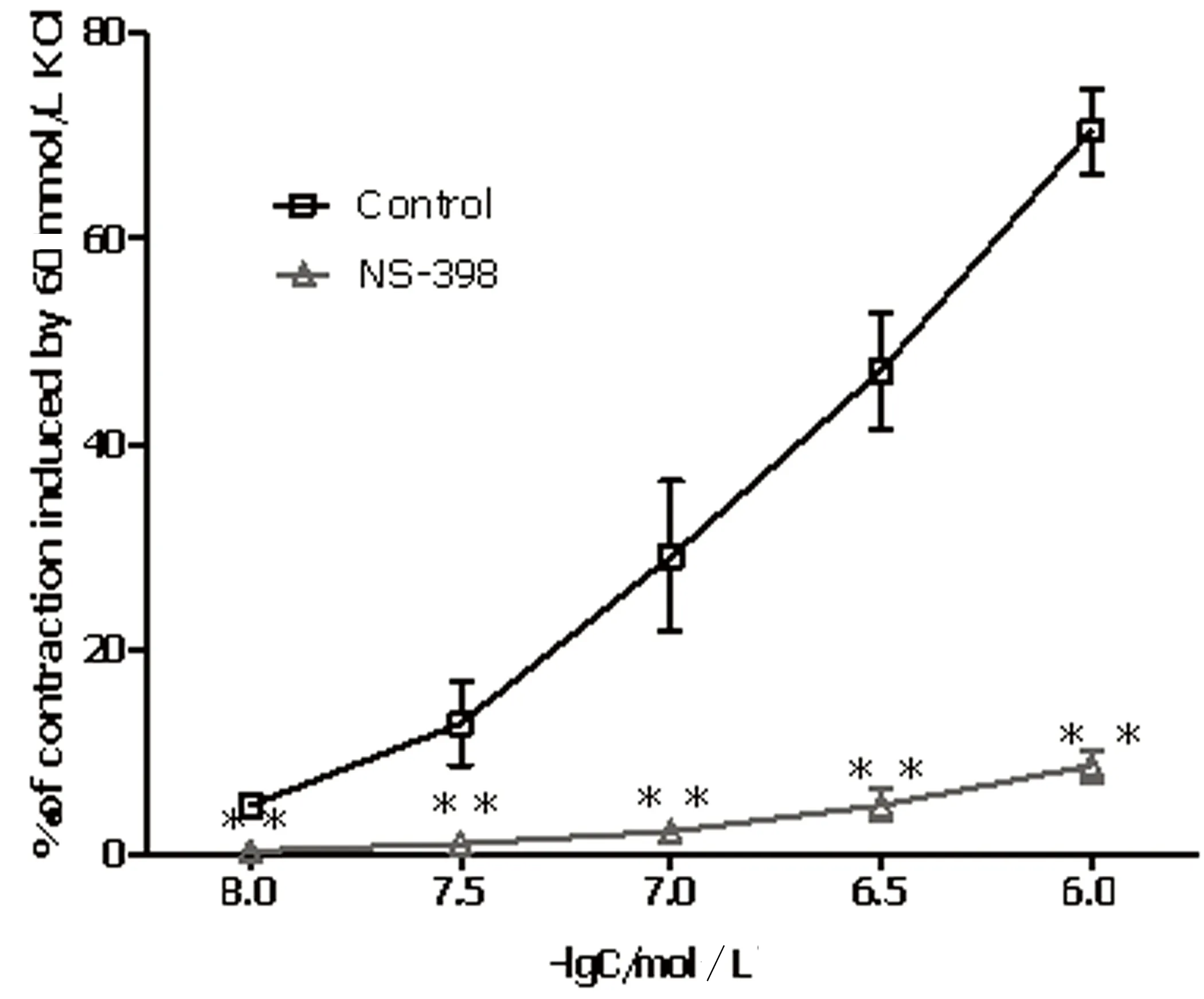
注:**P<0.05。
2.3 TXA2阻断剂SQ-29458、ICI-192605对PE缩血管作用的影响 TXA2阻断剂SQ-29458、ICI-192605对PE10-6mol/L所引起的缩血管作用并无显著的影响(P>0.05)。详见表1。
表1 SQ-29458、ICI-192605对PE缩血管作用的影响(±s)
3 讨 论
本实验旨在研究COX抑制剂对PE所致大鼠离体胸主动脉环收缩作用的影响。结果表明Indo可抑制PE的缩血管作用,且与血管内皮无关。此结果提示COX参与了PE的缩血管作用。COX有三种同工酶,最主要的是COX-1和COX-2。而Indo是非选择性COX抑制剂,可同时抑制COX-1和COX-2。那么,COX-1和COX-2是否均参与了PE的缩血管效应呢?本研究进一步利用选择性COX抑制剂来解释这个问题。结果表明,NS-398对PE引起的主动脉收缩有抑制作用,而SC-560几乎无抑制作用。这就提示COX-2参与了PE的缩血管作用。这与文献[5]中指出的NS-398抑制PE对大鼠主动脉的收缩作用相符,同时他们通过放线菌酮实验证实了NS-398发挥作用与内皮无关,提示COX-2参与PE的收缩作用时其部位可能位于平滑肌层和主动脉外层,免疫印迹结果也表明在去内皮的血管上也能检测出COX-2。
COX是前列环素合成的关键限速酶,可催化AA生成各种前列环素(如PLC、PLA2、PLD等[6-9])和TXA2。目前认为TXA2和PGI2是这些下游产物中活性最强的物质。本实验观察到TXA2的两种阻断剂SQ-29458和ICI-192605对PE缩血管作用无显著影响。PGI2对血管的效应与TXA2的作用相反,但具体对PE收缩大鼠离体主动脉血管环有何影响,仍需通过进一步实验证实。也应考虑AA的其他代谢产物对PE缩血管作用有无影响。
综上所述,本实验提示COX-2参与PE的缩血管作用。本实验为离体实验,环氧合酶抑制剂在在体动物上的作用及机制仍需更多实验研究。
[1] Das S,Chandrasekhar S,Yadav JS,et al. Recent developments in the synthesis of prostaglandins and analogues[J]. Chem Rev,2007,107(7):3286-3337.
[2] Pfister SL. Role of platelet microparticles in the production of thromboxane by rabbit pulmonary artery [J].Hypertension,2004,43(2):428-433.
[3] Dinchuk JE,Car BD,Focht RJ,et al.Renal abnormalities and an altered inflammatory response in mice lacking cyclooxygenaseⅡ[J]. Nature,1995,378 (6555):406.
[4] Oshima M,Dinchuk JE,Kargman SL,et al. Suppression of intestinal polyposis in Apc delta716 knockout mice by inhibition of cyclooxygenase 2(COX-2)[J]. Cell,1996,87(5):803.
[5] Castillo-Hernandez MC,Guevara-Balcazar G,Lopez-Sanchez P,et al.The influence of constitutive cox-2 in smooth muscle tissue on the contractile effect of phenylephrine in the rat abdominal aorta[J]. Front Biosci (Elite Ed), 2010,2:441-448.
[6] Burch RM,Luini A,Axelrod J. Phospholipase A2and phospholipase C are activated by distinct GTP-binding proteins in response to á1-adrenergic stimulation in FRTL5 thyroid cells[J]. Proc Natl Acad Sci,1986,83:7201-7205.
[7] Perez D,Hwa J,Gaivin R,et al. Constitutive activation states of a G protein-coupled-receptor[J]. Mol Pharmacol,1996,49:112-122.
[8] Balboa MA,Insel PA. Stimulation of phospholipase D via α1-adrenergic receptors in Madin-Darby canine cells is independent of PKCα and -activation[J]. Mol Pharmacol,1998,53:221-227.
[9] Exton JH. Signaling through phosphatidylcholine breakdown[J].J Biol Chem,1990,265:1-4.
(本文编辑郭怀印)
山西医科大学科技创新基金(No.01201104);山西医科大学青年基金(No.02200811);山西医科大学博士启动基金(No.03200707)
山西医科大学(太原 030001)
刘宇,E-mail:solayyt@sina.com
R331
A
10.3969/j.issn.1672-1349.2016.04.009
1672-1349(2016)04-0364-03
2015-09-12)

