瓜蒌提取物治疗链脲佐菌素诱导糖尿病小鼠心肌纤维化的实验研究
厉 娜,黄志刚,梁 春,岳温恒,吴宗贵
·基础医学论著/研究·
瓜蒌提取物治疗链脲佐菌素诱导糖尿病小鼠心肌纤维化的实验研究
厉 娜,黄志刚,梁 春,岳温恒,吴宗贵
目的 观察瓜蒌提取物对链脲佐菌素诱导糖尿病小鼠心肌纤维化的治疗作用。方法 采用链脲佐菌素诱导C57BL/6J小鼠糖尿病模型,瓜蒌提取物选取瓜蒌皮注射液作为研究药物,观察正常对照组、链脲佐菌素(STZ)组、STZ+低剂量瓜蒌组和STZ+高剂量瓜蒌组小鼠体重、随机血糖、心功能、左室心肌胶原容积分数、左室心肌肥大细胞数目、α-平滑肌肌动蛋白(α-SMA)和转化生长因子β1(TGF-β1)的表达变化。结果 STZ组小鼠体重下降、血糖升高、左室肥大细胞浸润数目增加、左室胶原容积分数增加,免疫组织化学染色显示α-SMA和TGF-β1表达增加。治疗组左室肥大细胞浸润数目降低、左室胶原容积分数减少,免疫组织化学染色显示α-SMA和TGF-β1表达减少,瓜蒌高剂量组优于低剂量组。结论 瓜蒌皮注射液可以改善STZ诱导糖尿病小鼠的心肌纤维化,可能机制为抑制肥大细胞在心肌组织中的浸润和激活。
糖尿病性心肌病;心肌纤维化;瓜蒌提取物;肥大细胞;α-平滑肌肌动蛋白;转化生长因子β1
2014年全球糖尿病病人已超过3.87亿,仅2014年糖尿病病人死亡人数就达到490万人[1]。而在糖尿病病人死亡人群中,心血管疾病死亡占65%左右[2]。糖尿病性心肌病(diabetic cardiomyopathy,DCM)是糖尿病病人致残和致死的主要原因之一,主要的病理改变是心肌组织纤维化。现代中医认为DCM主要的病机为痰浊、气滞、血瘀引起的心脉受损、血瘀络阻,瓜蒌为化痰类中药的重要成分。本研究采用链脲佐菌素(streptozotocin,STZ)诱导小鼠糖尿病模型,观察瓜蒌皮注射液对糖尿病心肌纤维化的治疗作用。
1 材料与方法
1.1 实验动物 健康8周龄C57BL/6J小鼠,Ⅱ级,雄性,体重(22±2)g,购自上海南方模式生物研究中心。
1.2 药物和试剂 瓜蒌皮注射液(上海第一生化制药厂,4 g/mL),STZ(美国SIGMA-ALDRICH),柠檬酸,柠檬酸二钠,甲苯胺蓝(美国AMRESCO公司)。
1.3 仪器 罗氏乐康全血糖仪、小动物高分辨率超声(Vevo770)。
1.4 实验方法
1.4.1 STZ诱导糖尿病小鼠模型的制备 实验动物禁食不禁水12 h,腹腔注射STZ (临用前用0.1 mol/L、pH 4.5的柠檬酸缓冲液配成1%STZ溶液,过滤除菌)50 mg/kg,每天1次,连续5 d;连续2 d测量血糖≥250 mg/dL认定为模型成功。
1.4.2 分组及给药 24只实验动物进行编号(断指法),抽签法随机分为4组,即正常对照组、STZ组、STZ+低剂量瓜蒌组、STZ+高剂量瓜蒌组,每组6只。第1天~第5天为STZ诱导期,第6天~第19天为观察期,其后10周为药物干预期。低、高剂量瓜蒌组小鼠在药物干预期分别给予腹腔注射瓜蒌皮注射液2 mL/(kg·d)或4 mL/(kg·d)。
1.5 检测指标
1.5.1 体重、血糖和心功能的测定 每2周测小鼠体重1次。采取断尾取血法测定小鼠随机血糖。小鼠异氟烷吸入麻醉,调节吸入气体的流量,控制心率在400次/min~500次/min,使用小动物专用高频超声探头选取心前区典型二维切面进行图像采集和数据分析。
1.5.2 组织病理学观察 天狼猩红染色计算左室胶原容积分数(collagen volume fraction,CVF)评价心肌纤维化程度,心肌免疫组织化学染色检测α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)、转化生长因子β1(transforming growth factor-β1,TGF-β1)蛋白的表达,甲苯胺蓝染色鉴别肥大细胞。
2 结 果
2.1 STZ腹腔注射诱导形成糖尿病小鼠模型 糖尿病组小鼠随机血糖从STZ注射结束后第2天开始升高,第12天达到峰值,并保持稳定,组间比较差异有统计学意义(P=0.03,t=2.567)。详见图1。
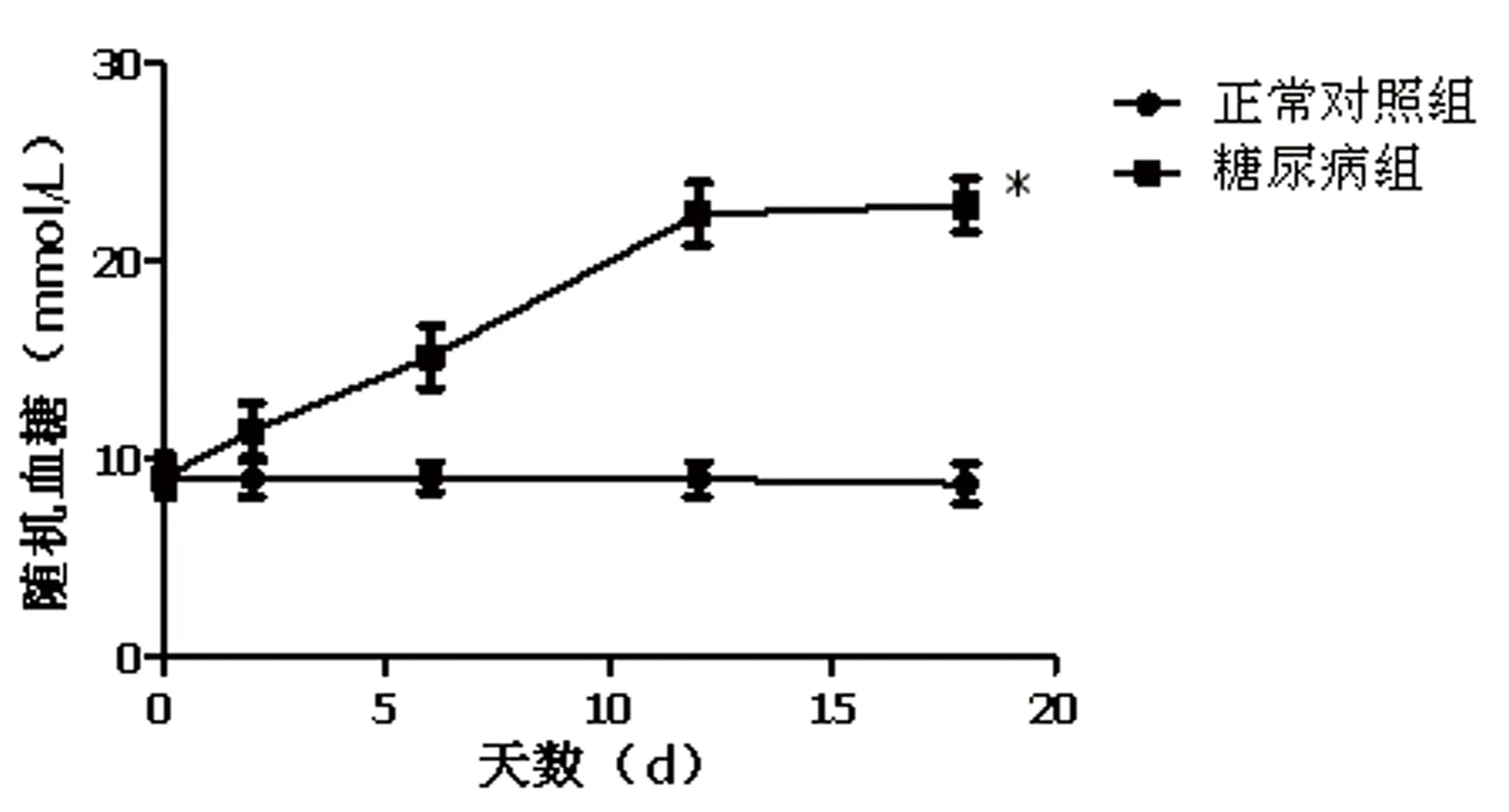
注:与正常对照组比较,*P<0.05。
2.2 瓜蒌皮注射液对小鼠体重和血糖的影响 正常对照组体重无明显改变,其他各组小鼠的体重进行性下降,差异有统计学意义(P<0.05),瓜蒌皮注射液对体重无影响。各模型组小鼠的血糖明显高于正常对照组(P<0.05)。两个剂量瓜蒌组血糖低于STZ组(P<0.05)。STZ+高剂量瓜蒌组血糖低于STZ+低剂量瓜蒌组,但差异无统计学意义(P>0.05)。说明瓜蒌皮注射液可轻度降低小鼠血糖。
2.3 瓜蒌皮注射液对STZ诱导糖尿病小鼠心功能的影响 心脏超声结果显示,正常对照组、STZ组、STZ+高剂量瓜蒌组小鼠左室结构和收缩功能各指标比较差异无统计学意义(P>0.05)。
2.4 瓜蒌皮注射液对STZ诱导糖尿病小鼠心肌纤维化的影响 正常对照组、STZ组、STZ+低剂量瓜蒌组和STZ+高剂量瓜蒌组左室CVF分别为(1.40±0.35)%、(9.06±0.81)%、(6.26±0.11)%、(4.82±0.91)%;α-SMA免疫组织化学染色IOD值分别为3027.43±938.13、17081.65±1360.72、9853.07±824.51、5 974.71±927.67,各组比较差异有统计学意义(P<0.001);TGF-β1蛋白表达趋势与α-SMA一致,IOD值分别为9927.72±1673.18、66495.50±2 386.65、51 217.57±3 769.32、19 982.48±1 426.54,其他各组与对照组比较差异有统计学意义(P<0.001)。说明瓜蒌皮注射液对糖尿病心肌纤维化有预防和治疗作用。详见图2~图4。

注: 与正常对照组比较,***P<0.001;与STZ组比较,*P<0.05,#P<0.001。
1组小鼠心肌纤维化程度(400×)
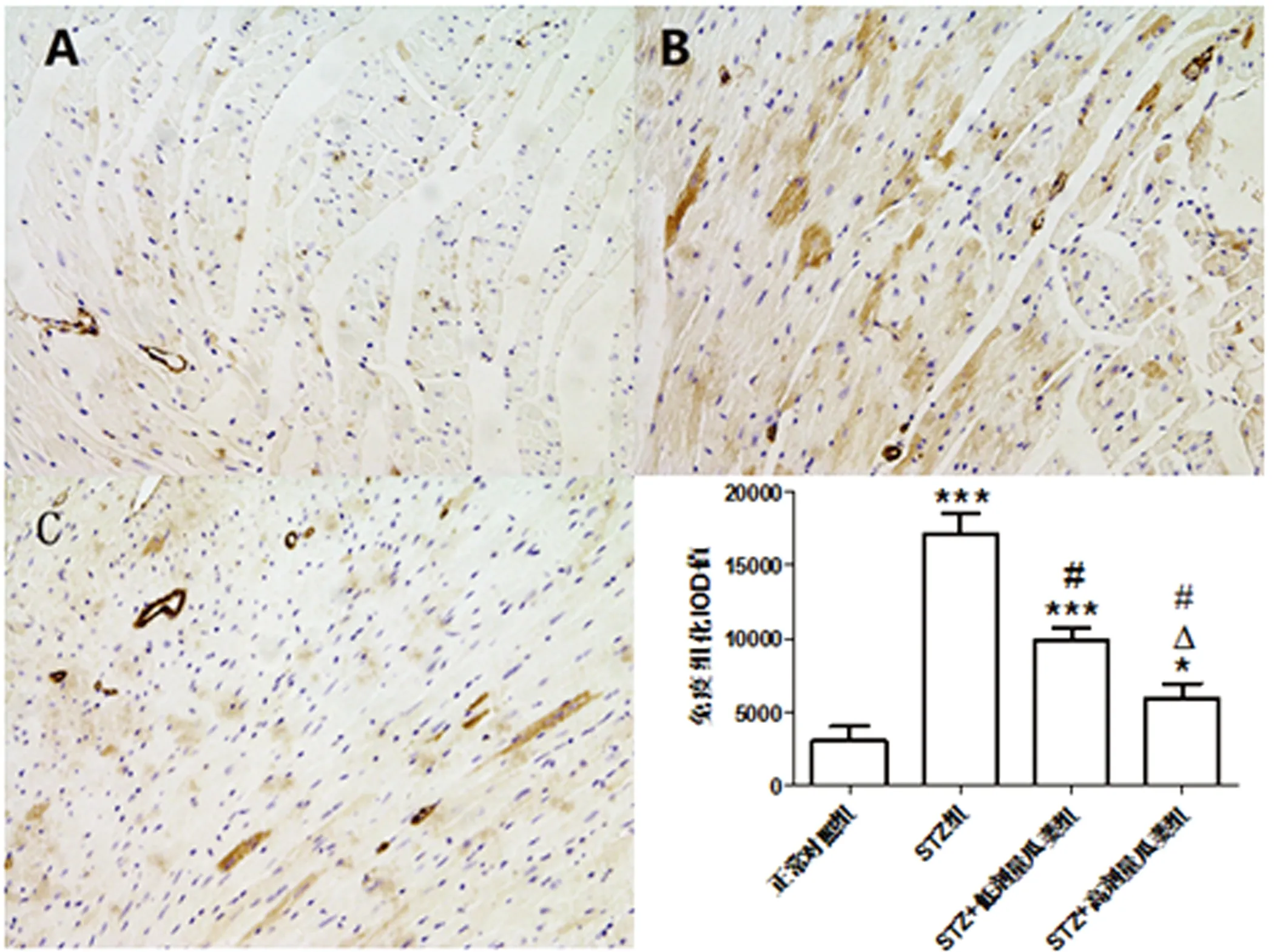
注:A代表正常对照组;B代表STZ组;C代表STZ+高剂量瓜蒌组。与正常对照组比较,* P<0.05,***P<0.001;与STZ组比较,#P<0.001;与STZ+低剂量瓜蒌组比较,△P<0.001。
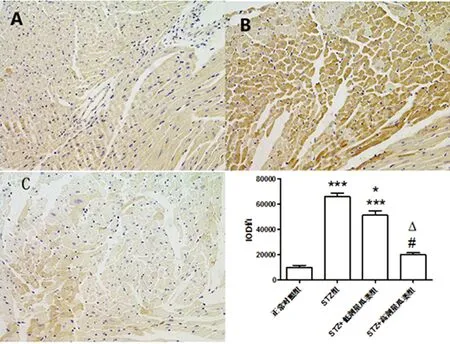
图3 免疫组织化学染色观察心室肌α-SMA的表达(400×)
注:A代表正常对照组;B代表STZ组;C代表高剂量瓜蒌组。与正常对照组比较, ***P<0.001;与STZ组比较,*P<0.001;与STZ+低剂量瓜蒌组比较,△P<0.001。
图4 免疫组织化学染色观察心室肌TGF-β1的表达(400×)
2.5 瓜蒌皮注射液对STZ诱导糖尿病小鼠心肌肥大细胞数目的影响 心肌组织中肥大细胞多分部在心外膜下和血管周围。正常对照组小鼠心肌中肥大细胞数目较少,细胞体积较小,颗粒含量少。其他各组肥大细胞数目明显增加,体积较大,颗粒含量多,但应用瓜蒌治疗后,肥大细胞数目较STZ组减少,差异有统计学意义(P<0.05)。详见图6。
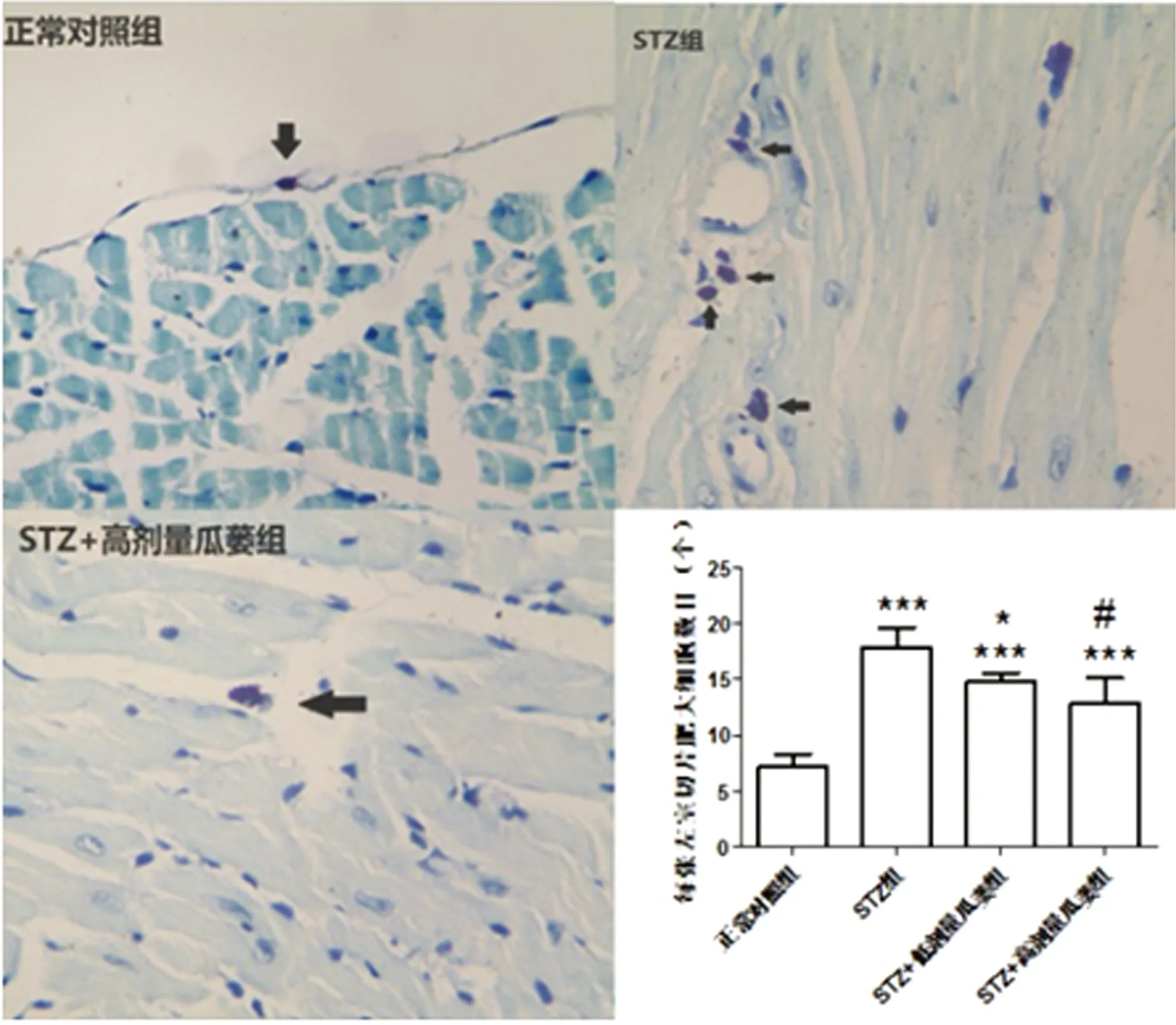
注:图中黑色箭头所指为心肌肥大细胞;与正常对照组比较,
***P<0.001;与STZ组比较,* P<0.05,#P<0.001。
图5 甲苯胺蓝染色显示心肌组织肥大细胞(400×)
3 讨 论
目前研究认为多次小剂量腹腔注射STZ诱导的糖尿病动物模型是1型糖尿病模型[3]。本研究中C57BL/6J小鼠腹腔注射STZ,血糖升高且保持稳定,可以成功诱导糖尿病小鼠模型。该结果与既往文献报道一致[4]。糖尿病小鼠成模12周心脏超声结果与正常对照组相比差异无统计学意义。而有研究结果显示左室射血分数(LVEF)及左室壁厚度降低[2-4]。出现这种差异的可能原因有:本研究观察的时间尚短;再者应进一步测量舒张功能相关的指标,如E’/A'、左心室内压最大下降速率(-dp/dtmax)等,因为糖尿病性心肌病的早期病理生理改变为左室舒张功能的减退。
心肌纤维化是发生DCM的重要病理机制[5]。心肌纤维化导致左室壁僵硬且顺应性降低,导致收缩和舒张功能障碍[6]。本研究结果显示,STZ诱导糖尿病小鼠在成模12周时心肌组织纤维化明显,具体表现在TGF-β等促进纤维化的指标明显升高,α-SMA蛋白表达增加,提示由成纤维细胞向肌成纤维细胞的分化增加,天狼猩红染色确定心肌组织胶原沉积。该结果与现有结果一致[4,7]。
DCM在传统医学中属于消渴、心悸和胸痹范畴。瓜蒌皮是祛痰之要药,具有宽胸、理气、散结、化痰之功效。史国玉等[8]分析瓜蒌皮药材的HPLC指纹图谱,确认的成分有香草酸、异槲皮苷、香草酸葡萄糖苷、芦丁和柯伊利素葡糖糖苷。现有研究显示其能抑制心肌成纤维细胞增殖及胶原合成,具有抗纤维化的作用[9]。本研究选用瓜蒌皮注射液为研究药物,结果显示其对糖尿病小鼠的体重无改变,可轻度降低血糖,降低心肌肥大细胞数目,使α-SMA和TNF-β1的蛋白表达下降,CVF降低。结果显示其可以抑制肥大细胞的激活、抑制糖尿病心肌纤维化。其他研究也证实以瓜蒌为主要成分的瓜蒌薤白半夏汤能降低肺组织TNF-β1的表达,减轻平阳霉素所致的大鼠肺纤维化[10]。
肥大细胞广泛参与急性心肌梗死、高血压、动静脉漏等病理情况下的心脏重构和心肌纤维化,并在其中起到关键作用[11]。既往的研究显示,应用肥大细胞膜稳定剂可以明显的改善糖尿病心肌纤维化[12]。在本研究中,糖尿病组小鼠心肌肥大细胞浸润数目明显增加,应用瓜蒌皮注射液后肥大细胞数目降低。瓜蒌皮注射液改善糖尿病心肌纤维化的可能机制为抑制肥大细胞在心肌组织中的浸润和激活。
[1] International Diabetes Federation. IDF Diabetes Atlas 2014 Update[Z]. Available from:URL:http://www.idf.org/diabetesatlas.
[2] Grundy SM,Benjamin IJ,Burke GL,et al. Diabetes and cardiovascular disease:a statement for healthcare professionals from the American Heart Association[J]. Circulation,1999,100(10):1134-1146.
[3] Like AA,Rossini AA.Streptozotocin-induced pancreatic insulitic:new model of diabetes mellitus[J].Science,1976,193(4251):415-417.
[4] Chenyong Q, Thomas CM,Seqqat R,et al. Angiotensin type 1a receptor-deficient mice develop diabetes-induced cardiac dysfunction, which is prevented by renin-angiotensin system inhibitors[J].Cardiovascular Diabetology,2013,12:169-182.
[5] Kain V, Kumar S, Sitasawad SL. Azelnidipine prevents cardiac dysfunction in streptozotocin-diabetic rats by reducing intracellular calcium accumulation,oxidative stress and apoptosis[J]. Cardiovascular Diabetology,2011,10:97.
[6] Asbun J,Villarreal FJ. The pathogenesis of myocardial fibrosis in the setting of diabetic cardiomyopathy[J]. J Am Coll Cardiol,2006,47(4):693-700.
[7] Chunjun L,Lin L, Hui L, et al. Cardiac fibrosis and dysfunction in experimental diabetic cardiomyopathy are ameliorated by alpha-lipoic acid[J]. Cardiovascular Diabetology,2012,11:73.
[8] 史国玉,刘伟,耿岩玲,等.瓜蒌皮药材的HPLC指纹图谱[J].中国实验方剂学杂志,2014,20(1):73-76.
[9] 沈雁,韦红.瓜萎薤白半夏汤对心肌纤维化中整合素β1的抑制作用[J].现代药物与临床,2010,25(4):277-281.
[10] 宋建平,李瑞琴,李伟,等.瓜蒌薤白汤对肺纤维化大鼠肺组织中转化生长因子β1表达的影响[J].北京中医药大学学报,2005,28(2):40-43.
[11] Levick SP,Meléndez GC,Plante E.Cardiac mast cells:the centrepiece in adverse myocardial remodeling[J].Cardiovascular Research,2011,89:12-19.
[12] Zhigang H,Qun J,Min F,et al.Myocardial remodeling in diabetic cardiomyopathy associated with cardiac mast cell activation[J].PLoS One,2013,8(3):e60827-e60835.
(本文编辑郭怀印)
Therapeutic Effect of Trichosanthes Fruit Extract on Myocardial Fibrosis in Streptozotocin Induced Diabetic Mice
Li Na,Huang Zhigang,Liang Chun,Yue Wenheng,Wu Zonggui
Changzheng Hospital,Second Military Medical University,Shanghai 200003,China Corresponding Author:Wu Zonggui
Objective To observe the therapeutic effect of extract of trichosanthes fruit extract(TFE) on myocardial fibrosis in streptozotocin(STZ) induced diabetic mice.Methods Diabetic model was induced by STZ in C57BL / 6J mice.Gualoupi injection was used as the study drug.The mice were randomly assigned to normal control group,STZ group,STZ + low dose TFE group,and STZ + high dose TFE group.Body weight,random blood glucose,cardiac function,left ventricular collagen volume fraction,mast cell number inmyocardium were observed.The expression of α-smooth muscle actin(α-SMA)and transforming growth factor beta 1(TGF-beta 1) in myocardium were tested by immunohistochemical staining.Results Mice in STZ group showed declined body weight,hyperglycemia,more mast cell infiltration in myocardium,increased left ventricular collagen volume fraction and elevated expression of α-SMA and TGF-beta 1.Mice in treating group had less mast cell infiltration,lower left ventricular collagen volume fraction and reduced expression of α-SMA and TGF-beta 1.Results in high dose TFE group was better than that in low dose TFE group.Conclusion Gualoupi injection can improve cardiac fibrosis in STZ induced diabetic mice.The possibly mechanism is inhibiting the infiltration and activation of mast cells in myocardial tissue.
diabetic cardiomyopathy;myocardial fibrosis;trichosanthes fruit extract;mast cells;α-smooth muscle actin;transforming growth factor beta 1
国家自然科学基金面上项目(No.81473445);国家自然科学基金青年基金(No.81303111)
第二军医大学附属长征医院(上海 200003)
吴宗贵,E-mail:zgwu@medmail.com
R587.1 R255.4
A
10.3969/j.issn.1672-1349.2016.04.006
1672-1349(2016)04-0355-03
2015-10-11)

