嗜热链球菌对生物活性肽QEPV吸收和利用的研究
b
(上海交通大学a.农业与生物学院;b.陆伯勋食品安全研究中心,上海200240)
嗜热链球菌对生物活性肽QEPV吸收和利用的研究
程志才a,陈静a,李婉如a,沈鹏a,戈婕妤a,张少辉ab
(上海交通大学a.农业与生物学院;b.陆伯勋食品安全研究中心,上海200240)
以嗜热链球菌和生物活性肽Gln-Glu-Pro-Val(QEPV)为研究对象,探索了乳酸菌对生物活性肽的吸收和利用。首先,用添加荧光标记QEPV的M17培养基培养嗜热链球菌,采用流式细胞术检测QEPV能否被嗜热链球菌吸收。其次,测定不同剂量生物活性肽QEPV对嗜热链球菌活菌数、发酵液pH值、菌体浓度的影响,以探索嗜热链球菌对生物活性肽的利用情况。流式细胞术检测结果表明,FAM-QEPV与FITC-QEPV能够穿过嗜热链球菌细胞膜,推测QEPV能够被嗜热链球菌吸收、利用。并且0.5 mg/mL的QEPV能有效促进嗜热链球菌的生长繁殖,提高嗜热链球菌的发酵能力。
生物活性肽;嗜热链球菌;吸收;利用
0 引言
经过发酵的牛奶蛋白能够释放出丰富的生物活性肽[1]。瑞士乳杆菌发酵牛乳产生一系列的生物活性肽[2-4]。这些生物活性肽在不能被肠胃消化酶消化分解的同时[5],具有良好的免疫调节[6]、抗炎[7]、抗氧化[8]、抗衰老[9]等功能。
发酵乳的生产一般采用多种乳酸菌混合发酵。任玲玲等研究发现将瑞士乳杆菌与嗜热链球菌按照不同比例混合其产酸能力均高于等量的单一嗜热链球菌的产酸能力[10]。Muriel Charlet等研究嗜热链球菌与乳杆菌在制作奶酪时的相互作用,发现嗜热链球菌和瑞士乳杆菌有明显的互惠关系[11]。瑞士乳杆菌发酵牛乳产生的生物活性肽可能是这种互惠关系的桥梁物质之一。
本课题结合流式细胞术研究嗜热链球菌对瑞士乳杆菌发酵牛乳产生的生物活性肽QEPV的吸收和利用情况。
1 实验
1.1材料与设备
材料:嗜热链球菌,培养环境:嗜热链球菌在M17培养基中培养,条件为38℃,摇床速度为140 r/min。乳源生物活性肽QEPV,FAM,FITC,FAM-QEPV以及FITC-QEPV(纯度>98%)。
试剂:M17培养基,PBS和MTT试剂,二甲基亚砜(DMSO),琼脂粉。
设备:Corning Transwell 96孔板,Mettler-Toledo电子分析天平,上海恒科GRX-9072A型干燥箱,上海卢湘仪GL-22M高速冷冻离心机,ZEALWAY压力蒸汽灭菌器,上海精宏THZ-320型恒温振荡器,上海三信B-1便携式pH值计,Tecan infinite M200 pro酶标仪,Thermo Forma 700 Series-80℃超低温冰箱,BD C6流式细胞仪。
1.2方法
1.2.1 乳酸菌的纯化与保存
取少量冷冻干燥的嗜热链球菌菌粉,接种到M17培养基中,培养24 h,按照10,102,103,104,105,106浓度梯度进行稀释,取合适浓度梯度平板涂布到M17琼脂培养基(M17液体培养基加入质量分数为1.25%琼脂),继续培养48 h,挑选单菌落富集培养,活化3次使用和保存。
1.2.2 菌体浓度与OD600值标准曲线建立
取活化的嗜热链球菌,按体积分数为5%添加量接种到M17培养基中。取对数生长期前期培养液,按2,4,6,8,10,20,40,100浓度梯度进行稀释,测定各稀释度下的OD600与菌落数(平板涂布法)[12]。建立OD600值与菌落数的关系标准曲线。
1.2.3 嗜热链球菌吸收荧光标记QEPV实验
分别配制添加质量浓度为2 mg/mL的FAMQEPV、质量浓度为2 mg/mL的FITC-QEPV的M17培养基,及添加等摩尔量的水、QEPV、FAM与FITC的M17培养基。将3次活化的嗜热链球菌用M17培养基继续培养至OD600为0.3左右,3 500 r/min离心10 min弃上清,立即将重悬菌体在避光条件下分别用上述培养基继续培养4 h。取培养液,在4℃、3 500 r/min条件下离心10 min,弃上清,继续用PBS洗涤菌体3次,去除菌体外荧光标记肽。将菌体重悬于等量PBS中,用流式细胞仪检测。流式细胞仪检测选取通道为FL1(滤光片:533/30),收集200 000个样本。
1.2.4 生物活性肽QEPV对嗜热链球菌生长影响实验
配制添加质量浓度为0,0.10,0.25,0.50和1.00 mg/mL生物活性肽QEPV的M17培养基,将3次活化的菌种按照体积分数5%添加接种到相应培养基中,对照为空白培养基添加等量蒸馏水,将培养基的初始OD600值调整到0.1左右。摇床培养36 h,前期每隔1 h测定一次OD600值,后期每隔2 h测定一次OD600;每隔2 h测定pH值;用MTT法每隔4 h测定活菌数。
本课题采用操作简单、被广泛应用于测定菌活性的MTT法测定瑞士乳杆菌活性[13-14]。取1 mL培养液,在4℃(3 500 r/min)条件下离心10 min,去上清液。用1 mL的PBS重悬菌体。取200 L重悬菌液,加入60 uL的1×MTT,在避光条件下继续培养嗜热链球菌1 h,在4℃(3 500 r/min)条件下离心10 min,弃上清液,加入200 L DMSO,取200 L测量OD570值。
1.3数据分析
利用Origin软件进行数据分析及图表制作,用SPASS进行显著性分析。所有数据用采用平均值±标准偏差的形式表示。
2 结果与讨论
本实验室的前期研究结果表明瑞士乳杆菌发酵牛奶、分解酪蛋白产生的生物活性肽QEPV具有抗衰老、调节免疫等多项功能[6-9]。瑞士乳杆菌和嗜热链球菌具有显著的互惠关系,生物活性肽QEPV可能是发挥互惠调节作用的中间物质。通过MTT测定不同离心速度下收集到的菌活性以选择合适的离心条件。在4℃(10 min)条件下,分别测定3 000,3 500,4 000和5 000 r/min收集到嗜热链球菌菌体的菌活性,得出最佳离心速度为3 500 r/min。
2.1菌体浓度与OD600值标准曲线的建立
平板涂布48 h后嗜热链球菌稀释倍数为105组三个平板上统计的菌落数161,159,134个;均值为151.33±12.28。计算出原始培养液的活菌数(CFU)[12]。测定菌液不同稀释浓度下的OD600值。将不同稀释度的嗜热链球菌活菌数(CFU)与对应的OD600值进行拟合,作活菌数与OD600间的标准曲线,结果如图1所示。

图1 嗜热链球菌活菌数(CFU)与OD600关系的拟合曲线
由图1可以看出,光密度随着菌体浓度的增大而增大,并呈良好线性关系,OD600与活菌数的关系为:y=7.62229×109x。该结果与胡志和等在研究酪蛋白水解产物对瑞士乳杆菌生长的影响时得出的结论相似[15]。
2.2嗜热链球菌对QEPV吸收性
流式细胞术是一种测量液相中合适体积悬浮细胞或微粒的物理和化学性质的现代分析技术。流式细胞术在乳酸菌中研究应用广泛[16]。本课题用质量浓度为2 mg/mL的FAM标记的QEPV(FAM-QEPV)与对数生长期中期的嗜热链球菌共培养4 h后除去菌体外的FAM-QEPV,然后用流式细胞仪检测。结果显示,共培养4 h后,FAM-QEPV组荧光强度显著高于QEPV组和对照组,说明FAM-QEPV能够穿过嗜热链球菌细胞膜,被嗜热链球菌吸收。

图2 流式细胞仪检测嗜热链球菌吸收FAM标记QEPV实验结果
为排除因洗涤不完全等因素造成的假阳性,在嗜热链球菌接种到添加FAM-QEPV培养基后立即洗涤菌体,结果如图3所示。FAM-QEPV与菌体共培养0 h的荧光强度与QEPV组和对照组没有产生显著性差异。说明0 h时FAM-QEPV并没有被菌体吸收,并且所选择的洗涤条件在没有破坏菌体的情况下完全除去了菌体外FAM-QEPV。而用FAM-QEPV培养菌体4 h后,荧光强度显著高于培养0 h的荧光强度,结果说明了FAM-QEPV能够被嗜热链球菌吸收,排除了因洗涤不完全造成的假阳性。
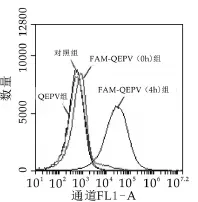
图3 流式细胞仪检测培养0 h和4 h后嗜热链球菌吸收FAM标记QEPV实验结果
为排除FAM荧光素影响了嗜热链球菌对QEPV的吸收性,采用FITC标记的QEPV(FITC-QEPV)重复上述实验。结果如图4所示:添加质量浓度为2 mg/mL的FITC-QEPV与菌体共培养4 h后,菌体内的荧光强度显著高于QEPV组和对照组。结果再次验证QEPV也能够穿过嗜热链球菌细胞膜,被嗜热链球菌吸收。

图4 流式细胞仪检测嗜热链球菌吸收FITC标记的QEPV实验结果
综上所述,FAM标记的QEPV和FITC标记的QEPV均能能够穿过嗜热链球菌细胞膜被嗜热链球菌吸收,推测单独的生物活性肽QEPV也能够被嗜热链球菌吸收。FAM和FITC在研究蛋白和多肽的吸收和转运等方面应用广泛。FAM常用于标记DNA[17],FITC常用于检测细胞凋亡[18]。两种荧光素相对分子质量较小,作为标记物较适合多肽或蛋白质的吸收和转运研究。Shun-lung Fang等通过流式细胞术检测FITC标记的ECP肽的穿膜性,得到一种新奇的穿膜肽[19]。Ankur Gautam等通过FITC标记研究IMT-P8多肽的穿膜效果[20]。M-Lindgren等通过荧光显微镜和流式细胞术检测羧基荧光素标记的多肽在HeLa细胞内的位置,得出了HeLa细胞对多种肽的吸收性[21]。本实验结果与这些结果相同,说明生物活性肽能够穿过细胞膜被乳酸菌吸收。
2.3生物活性肽QEPV对嗜热链球菌生长繁殖的影响
2.3.1 对嗜热链球菌活菌数的影响
将嗜热链球菌接种到添加不同质量浓度生物活性肽QEPV的培养基中,在38℃下培养36 h,定时测定嗜热链球菌活菌数,结果如图5所示。嗜热链球菌活菌数随着培养时间的延长先增大后减小,QEPV质量浓度为0.50 mg/mL组活菌数在培养初期的增长速度显著高于其他组,且质量浓度0.50 mg/mL组的嗜热链球菌首先进入衰退期,说明QEPV能够促进嗜热链球菌的增殖和生长。当QEPV质量浓度为1.00 mg/mL时,培养初期的活菌数增长速度和活菌数最大值低于0.50 mg/mL组,推测可能是QEPV浓度过高抑制了嗜热链球菌的增殖和生长。

图5 不同质量浓度的生物活性肽QEPV对嗜热链球菌活菌数的影响
2.3.2 生物活性肽QEPV对嗜热链球菌菌体浓度的影响
将嗜热链球菌接种到添加不同浓度生物活性肽QEPV的培养基中,在38℃下培养36 h,定时取200 μL测定OD600,结果如图6所示。随着QEPV浓度的增大,其促进增殖和生长作用增强,当QEPV质量浓度达到0.50 mg/mL时,菌体浓度增长最快,与其他各组比较具有显著性差异。当QEPV质量浓度为1.00 mg/mL时菌体质量浓度增长速度低于0.50 mg/mL。说明在一定质量浓度范围内,QEPV能够有效促进嗜热链球菌增殖和生长;当QEPV浓度过高时,可能会抑制菌体增殖。
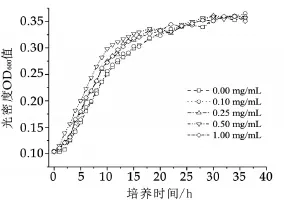
图6 添加不同质量浓度生物活性肽QEPV对嗜热链球菌菌体质量浓度的影响
2.3.3 生物活性肽QEPV对嗜热链球菌发酵能力的影响
嗜热链球菌发酵过程产生大量的乳酸,通过测定培养基的pH值能间接反映乳酸的质量浓度。实验中测定了嗜热链球菌培养液pH值随时间的变化,结果如图7所示。

图7 不同质量浓度生物活性肽QEPV对嗜热链球菌发酵能力(pH值)的影响
测定结果表明,随着培养时间延长,各组pH值均出现显著性降低。QEPV质量浓度为0.50 mg/mL组与其他组相比pH值降低速度最快,而且具有显著性差异。当QEPV的质量浓度上升到1.00 mg/mL时,在相同时间点pH值下降速度低于其他各组。这个结果再次说明在一定浓度范围内QEPV能够有效促进嗜热链球菌的生长繁殖和发酵能力,高质量浓度的QEPV反而抑制嗜热链球菌的生长繁殖和发酵能力。
发酵过程中pH值变化和菌体质量浓度变化结果均表明0.50 mg/mL的QEPV能够显著促进嗜热链球菌的增殖和生长,显著增强嗜热链球菌的发酵能力。但当QEPV的质量浓度增加到1.00 mg/mL时对嗜热链球菌的作用效果低于0.50 mg/mL QEPV组。推测可能是随着QEPV质量浓度的增加导致培养液的渗透压升高,反而对嗜热链球菌的增殖、生长和发酵产生了抑制作用。胡志和等研究了乳铁蛋白及乳铁素对嗜酸乳杆菌生长的影响,发现乳铁蛋白的最适添加浓度为2.50 mg/mL,乳铁素的最适添加质量浓度为0.15 mg/mL,当乳铁蛋白和乳铁素质量浓度过高时其促增殖作用减小[22]。上述结果也说明在标准乳酸菌培养基中额外添加具有生物活性的蛋白质和多肽应注意使用质量浓度,过多可能会对乳酸菌的生长繁殖和发酵能力产生抑制作用。
另外,图5和图6的结果都表明发酵20 h后,各组间的活菌数及菌体浓度差异不显著,即各组间嗜热链球菌总菌体数量无差异,说明添加的生物活性肽QEPV量没有显著改变各组培养基的营养结构。共培养初期,所有组培养液中含有满足嗜热链球菌生长发育所需的丰富营养物质,但在4 ~16 h,QEPV质量浓度为0.50 mg/mL组的活菌数、菌体浓度及发酵pH值均与对照组差异显著,说明QEPV并非作为普通的营养物质被嗜热链球菌利用。由于QEPV不具有影响其生物活性的空间构象,其在体内外独立发挥调节菌体生长发育等功能性作用的可能性小。结合嗜热链球菌对QEPV具有良好的吸收性,推测QEPV作为对嗜热链球菌有益的生物活性物质,优先被嗜热链球菌吸收、利用而发挥促生长等作用。
3 结束语
本课题采用流式细胞术采用FAM标记和FITC标记的生物活性肽QEPV与对数生长期的菌体共培养,研究嗜热链球菌对QEPV的吸收性。结果表明,无论是FAM标记,还是FITC标记的QEPV均能够被嗜热链球菌吸收进入菌体,说明嗜热链球菌对生物活性肽QEPV具有良好的吸收性。采用MTT法测定不同QEPV浓度对嗜热链球菌体浓度,活菌数和发酵液pH值的影响。结果表明,质量浓度为0.50 mg/mL的QEPV能够显著促进嗜热链球菌的生长、繁殖和发酵。而质量浓度1.00 mg/mL QEPV对嗜热链球菌生长、繁殖和发酵的促进作用降低,说明高质量浓度的QEPV对嗜热链球菌的生长、繁殖和发酵有一定的抑制作用。结合QEPV不具有空间构象并且QEPV能够被嗜热链球菌吸收进入菌体,推测QEPV作为对嗜热链球菌有益的生物活性物质,优先被嗜热链球菌吸收、利用而发挥促生长等作用。
[1]MOHANTY D,MOHAPATRA S,MISRA S,et al.Milk derived bioactive peptides and their impact on human health–A review[J]. Saudi Journal of Biological Sciences,2015,
[2]徐海红,林文珍,李锡安,等.生物活性多肽序列鉴定方法的研究[J].中国乳品工业,2015,43(7):4-9.
[3]钱蕙佶,高扬,占东升,等.瑞士乳杆菌胞内生物活性肽的分离鉴定[J].中国乳品工业,2016,44(3):4-8.
[4]卢姗姗,郭海滨,付丽娜,等.瑞士乳杆菌发酵乳中多肽的分离对小鼠体外淋巴细胞增殖的影响[J].食品科技,2011,36(2):61-4.
[5]马鎏镠,占东升,蒋佑明,等.乳源性多肽体外模拟胃肠消化实验及其对淋巴细胞增殖的影响[J].中国乳品工业,2013,41(5):4-7.
[6]JIEHUI Z,LIULIU M,HAIHONG X,et al.Immunomodulating ef⁃fects of casein-derived peptides QEPVL and QEPV on lymphocytes in vitro and in vivo[J].Food&function,2014,5(9):2061-9.
[7]周婕慧,金嬴凯,徐海红,等.生物活性肽的抗炎功能及其对氧化应激的调节作用[J].中国乳品工业,2014,42(3):4-6.
[8]金赢凯,占东升,梁世排,等.乳源性小肽的抗氧化功能研究[J].中国乳品工业,2015,43(5):4-7.
[9]高扬,唐祎,钱蕙佶,等.乳源性小肽QEPV的抗衰老功能研究[J].中国乳品工业,2015,43(9):4-7.
[10]任玲玲,李开雄,邓艳.瑞士乳杆菌和嗜热链球菌产酸特性的研究[J].中国食物与营养,2007,(11):34-5.
[11]CHARLET M,DUBOZ G,FAURIE F,et al.Multiple interactions between Streptococcus thermophilus,Lactobacillus helveticus and Lactobacillus delbrueckii strongly affect their growth kinetics during the making of hard cooked cheeses[J].International journal of food microbiology,2009,131(1):10-9.
[12]食品安全国家标准.食品微生物学检验乳酸菌检验[S].2010.
[13]杨培洁,李腾,陈晓红,等.MTT法测定瑞士乳杆菌MB 2-1活菌数[J].食品科学,2013,34(20):99-102.
[14]黄立坤,杜鹏,霍贵成.MTT法测定乳酸菌活菌数的研究[J].食品工业,2008,3(62-5.
[15]胡志和,区翠颜,朱利民,等.酪蛋白水解物对瑞士乳杆菌生长的影响[J].食品科学,2010,23):188-93.
[16]RAULT A,B AL C,GHORBAL S,et al.Multiparametric flow cy⁃tometry allows rapid assessment and comparison of lactic acid bacteria viability after freezing and during frozen storage[J].Cryobiology, 2007,55(1):35-43.
[17]KING G,MAKER G L,BERRYMAN D,et al.Role of neuregu⁃lin-1β in dexamethasone-enhanced surfactant synthesis in fetal type II cells[J].FEBS letters,2014,588(6):975-80.
[18]BO S.Anti-tumor Effect and Potential Mechanism of Arsenic Triox⁃ide on SMMC-7721 Cells of Human Liver Cancer in Vivo and Vi⁃ tro[J].Journal of International Translational Medicine,2014,2(2): 288-93.
[19]FANG S-L,FAN T-C,FU H-W,et al.A novel cell-penetrating peptide derived from human eosinophil cationic protein[J].PloS one,2013,8(3):e57318.
[20]GAUTAM A,NANDA J S,SAMUEL J S,et al.Topical Delivery of Protein and Peptide Using Novel Cell Penetrating Peptide IMT-P8 [J].Scientific Reports,2016,6(26278.
[21]LINDGREN M,POOGA M,LANGEL U.33 Methods to Study the Translocation of Cell-Penetrating Peptides[J].Half title,567.
[22]胡志和,王昌禄,李斌.乳铁蛋白及乳铁素对嗜酸乳杆菌生长影响的研究[J].食品科学,2007,15):413-7.
Absorption and utilization of bioactive peptide QEPV byStreptococcus thermophilus
CHENG Zhi-caia,CHEN Jinga,LI Wan-rua,SHEN Penga,GE Jie-yua,ZHANG Shao-huiab
(Shanghai Jiao Tong University a.School of Agriculture and Biology;b.Bor S.Luh Food Safety Research Center,Shanghai 200240,China)
This study was focused on the absorption and utilization of bioactive peptide Gln-Glu-Pro-Val(QEPV)byStreptococcus ther⁃mophilus.First,Streptococcus thermophiluswas cultured with FAM-QEPV or FITC-QEPV,then flow cytometry technology was applied for detection of FAM-QEPV or FITC-QEPV in vivo.The utilization of milk-derived peptide QEPV byStreptococcus thermophilusof in⁃vestigated by studying the effect of QEPV on the relative number of living cells,the pH of culture solution and the concentration of bacteri⁃um.The results show that QEPV could significantly promote the growth ofStreptococcus thermophilusat the concentration of 0.50 mg/ml. The results of flow cytometry show that FAM-QEPV and FITC-QEPV could be absorbed byStreptococcus thermophilus.We can prelimi⁃nary come to the conclusion that QEPV could be absorbed byStreptococcus thermophiles.
bioactive peptide;streptococcus thermophilus;absorption;utilization
Q93-33
A
1001-2230(2016)11-0004-04
2016-06-29
程志才(1990-),男,硕士研究生,主要研究方向为乳品科学。
张少辉

