加工条件对大黄鱼鱼肉抗氧化肽功能特性的影响
张宁宁 郑宝东 张 翀 李致瑜
(1. 福建农林大学食品科学学院,福建 福州 350002;2. 福州市金融工作办公室,福建 福州 350002)
加工条件对大黄鱼鱼肉抗氧化肽功能特性的影响
张宁宁1郑宝东1张 翀2李致瑜1
(1. 福建农林大学食品科学学院,福建 福州 350002;2. 福州市金融工作办公室,福建 福州 350002)
研究了不同加工条件下大黄鱼鱼肉抗氧化肽的溶解性、吸水性、持水性、吸油性、表观黏度、乳化能力、起泡性等功能特性。结果表明,大黄鱼鱼肉抗氧化肽的等电点处于pH 4.0左右,该pH值条件下,抗氧化肽的溶解性和乳化性表现为最低,而乳化稳定性、起泡性及泡沫稳定性最高。此外,大黄鱼抗氧化肽展现了良好的吸水性、吸油性和流动性,但持水性相对较差。大黄鱼鱼肉抗氧化肽可作为一种生产功能性食品的潜在添加剂。
大黄鱼;抗氧化肽;功能特性
大黄鱼(Pseudosciaenacrocea),属石首鱼科黄鱼属,又名黄花鱼、大王鱼等,是中国重要的特色海水鱼养殖品种之一[1-2]。大黄鱼鱼肉含有丰富的蛋白质和较高比例的必需氨基酸,营养价值高。但目前国内外对大黄鱼蛋白的深度开发与应用的研究报道较少。
通过酶水解蛋白质制备生物活性肽,是动植物蛋白质资源开发的重要途径。生物活性肽可通过细胞膜受体直接被小肠壁吸收,进入血液并参与体内代谢。相较于未水解蛋白,生物活性肽具有较高的安全指数和生物利用率[3]。因此,开发生物活性肽作为食品添加剂或功能性成分已受到越来越多的关注[4]。
本课题组前期研究[5]已证实,大黄鱼经中性蛋白酶可控水解后可获得具有抗氧化活性的肽,为进一步开发应用此抗氧化肽,本试验系统地研究了不同加工条件对大黄鱼鱼肉抗氧化肽功能特性的影响,包括对溶解性、吸水性、吸油性、表观黏度、乳化能力和起泡性等的影响,旨在为大黄鱼鱼肉蛋白肽的精深加工和应用提供理论依据和技术支持。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
大黄鱼:福建海鸥水产食品有限公司,经去头、去皮、去内脏,置于-20 ℃冷冻备用;
中性蛋白酶:6×104U/g,北京索莱宝生物科技有限公司;
鲁花5S压榨一级花生油:山东鲁花集团有限公司;
十二烷基磺酸钠(SDS)、盐酸、氢氧化钠:分析纯,国药集团上海化学试剂有限公司。
1.1.2 主要仪器设备
pH计:DELTA 320型,瑞士梅特勒-托利多有限公司;
离心机:H2050R型,湖南湘仪仪器有限公司;
凯氏定氮仪:SKD-800型,上海沛欧分析仪器有限公司;
恒温培养箱:DHP-9102型,上海一恒科学仪器有限公司;
黏度计:NDJ-7型,上海精密仪器有限公司;
紫外可见分光光度计:T6-1650E型,北京普析仪器有限公司。
1.2 方法
1.2.1 大黄鱼鱼肉抗氧化肽的制备工艺 参考文献[5]。
1.2.2 相对溶解度的测定 根据文献[6]的方法,修改如下:配制20 mL浓度为10 g/L的大黄鱼鱼肉抗氧化肽溶液,分别用0.5 mol/L HCl 或0.5 mol/L NaOH调节多肽溶液的pH值至3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0。室温条件下恒速搅拌30 min,4 000 r/min离心30 min,取上清,采用凯氏定氮法测定其蛋白质含量。相对溶解度的计算公式:
(1)
式中:
NSI——相对溶解度,%;
m1——上清液蛋白含量,g;
m2——样品总蛋白含量,g。
1.2.3 吸水性和持水性的测定
(1) 吸水性的测定:根据文献[7]的方法,修改如下:准确称取1.0 g大黄鱼鱼肉抗氧化肽,均匀地分散于直径为7 cm的干燥培养皿中,称量其与培养皿的总重量。将培养皿置于温度25 ℃,相对湿度60%的人工气候箱中,每2 h测量一次培养皿的总重量,直到培养皿重量不再增加为止。大黄鱼抗氧化肽吸水性的计算:
(2)
式中:
WA——吸水性,%;
W1——培养皿最终总重量,g;
W0——培养皿最初的总重量,g。
(2) 持水性的测定:取10 mL 浓度为10 g/L 的大黄鱼抗氧化肽溶液放入培养皿中,称其与培养皿的总重量,将培养皿置于温度为25 ℃,相对湿度60%培养箱中,2 h内每隔20 min称量一次培养皿的重量。抗氧化肽持水性的计算:
(3)
式中:
WHC——持水性,%;
W1——培养皿放置培养箱前总重量,g;
W0——培养皿放置培养箱后的总重量,g。
1.2.4 吸油性的测定 根据文献[8]的方法,修改如下:准确称取10 mL花生油放入20 mL带刻度的离心管中,加入0.6 g抗氧化肽,漩涡振荡5 min。将离心管分别放入20,30,40,50,60,70,80,90 ℃水浴中保温30 min后离心20 min,记录游离油的体积。抗氧化肽吸油性的计算:
(4)
式中:
OA——吸油性,mL/g;
V——游离油体积,mL;
m——样品重量,g。
1.2.5 表观黏度的测定 根据文献[9]的方法,修改如下:分别配制浓度为10,20,30,40,50,100 g/L 的大黄鱼抗氧化肽溶液,测其表观黏度。
1.2.6 乳化能力的测定 根据文献[10]的方法,修改如下:取浓度10 g/L的大黄鱼抗氧化肽溶液3 mL,混入1 mL花生油后匀浆,从形成的乳浊液底部吸取1 mL液体加入到5 mL浓度为0.1%的SDS溶液中,混匀,测500 nm波长下的吸光度值,记为A0。将上述混合液于室温下放置30 min后再次测定其吸光度,记为A30。大黄鱼抗氧化肽乳化性和乳化稳定性的计算:
(5)
(6)
式中:
EAI——乳化性,m2/g;
ESI——乳化稳定性,min;
Ф——乳化液中油相的比例,0.25;
A0——乳化完成后初始吸光度;
W——乳化前抗氧化肽的含量,g;
Δt——静置时间,30min。
1.2.7 起泡性和泡沫稳定性的测定 参照文献[11]。
1.3 数据分析
试验数据采用SPSS19.0进行分析,所有结果均以平均值±标准差表示。
2 结果与分析
2.1 大黄鱼鱼肉抗氧化肽的溶解度
溶解性是肽类的主要性质之一,可影响肽的流变性、表面活性等理化性质。pH值对大黄鱼鱼肉抗氧化肽溶解度的影响见图1。由图1可知,在pH3.0~10.0时,大黄鱼鱼肉抗氧化肽的相对溶解度均大于80%,说明其具有较好的水溶性。pH值低于4.0时,抗氧化肽溶解度随pH值的增加而降低;pH4.0时,溶解度最低;pH值在4.0~10.0时,溶解度随pH值的增加而增加。研究[12]表明,当蛋白质接近其等电点时,分子的净电荷趋近为零、极性降低、分子间静电作用减弱,而疏水作用力得到进一步加强,引起多肽聚合,相对溶解度降低,因此推测该抗氧化肽的等电点为pH4.0左右。
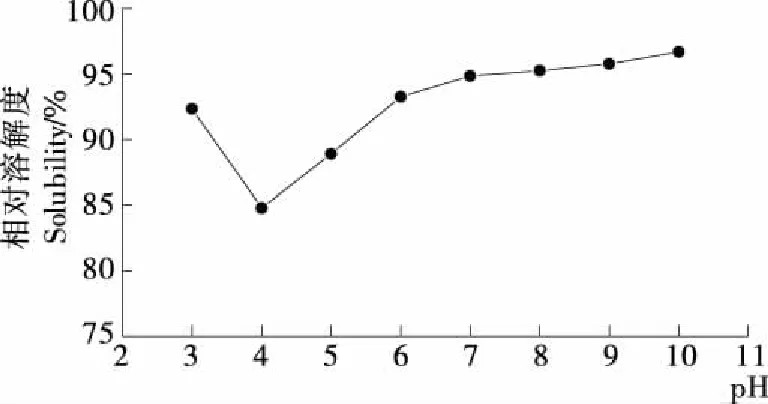
图1 不同pH条件下大黄鱼鱼肉抗氧化肽的相对溶解度
2.2 大黄鱼鱼肉抗氧化肽的吸水性和持水性
吸水性是蛋白质产品的重要功能性质。大黄鱼鱼肉抗氧化肽的吸水性见图2。由图2可知,0~4h时大黄鱼鱼肉抗氧化肽在空气中迅速吸水,吸水性12.41%;超过4h后,抗氧化肽的吸水速率显著减慢,并逐渐趋于稳定。其可能原因为,蛋白质水解后,分子中能吸收水分子的极性位点暴露出来,加强了吸水性[14];当时间超过4h后,抗氧化肽分子周围的疏水层和亲水层基本稳定,水合作用达到饱和[8],吸水性趋于稳定。

图2 大黄鱼鱼肉抗氧化肽的吸水性
有些蛋白质可通过产生有限溶胀,将水截留在分子内部,从而增强其持水性。由图3可知,大黄鱼鱼肉抗氧化肽的持水性随时间的延长而迅速下降,12h后仅为4.07%,持水效果不佳。这可能是酶解后肽分子量较小,无法通过形成一定的空间结构截留水分子,只能借助分子表面静电作用或通过氢键结合少部分水,因此酶解不利于蛋白质的持水性[15-16]。
2.3 大黄鱼鱼肉抗氧化肽的吸油性
由图4可知,当温度低于40 ℃时,抗氧化肽的吸油性逐渐升高;温度为40 ℃时,抗氧化肽的吸油性最大;温度超过70 ℃时,抗氧化肽的吸油性显著下降(P<0.05)。影响蛋白质产品吸油性的主要原因为蛋白质分子大小、温度及加工方法等[14]。本研究中,随着温度的升高多肽分子逐渐展开,疏水基团暴露,增强了油脂吸附作用。当温度持续升高并超过一定范围,多肽的结构被破坏,油与多肽发生解离,油滴之间相互聚集,导致多肽—油体系不稳定[17]。
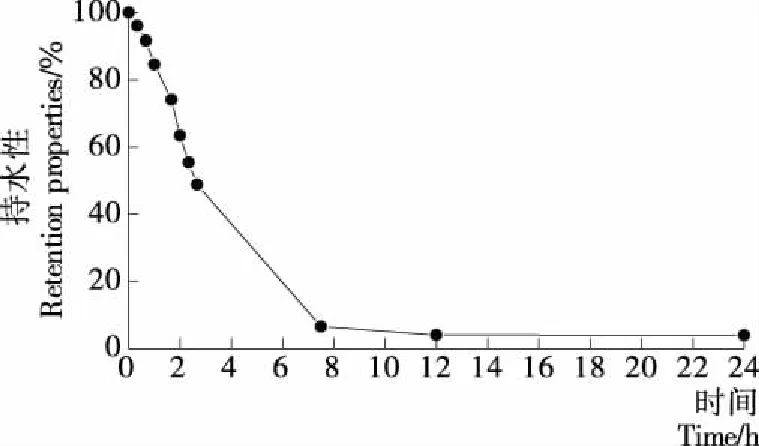
图3 大黄鱼鱼肉抗氧化肽的持水性
Figure3RetentionpropertiesofantioxidantpeptidesfromPseudosciaenacrocea
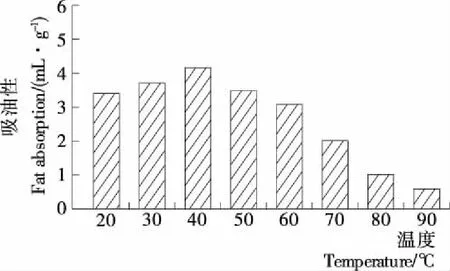
图4 不同温度条件下大黄鱼鱼肉抗氧化肽的吸油性
Figure 4 Effect of temperature on the fat absorption ability of antioxidant peptides
2.4 大黄鱼鱼肉抗氧化肽的表观黏度
大黄鱼鱼肉抗氧化肽的表观黏度见图5。由图5可知,肽溶液的表观黏度随浓度升高变化不大,当抗氧化肽浓度为100 g/L时,表观黏度仅为2.5 mPa·s,仍处于较低水平。
酶作用于蛋白质后,蛋白质多聚体解聚,导致表观体积减少,黏度下降[18]。大黄鱼抗氧化肽在高浓度时仍具有低黏度的特性,使其在高蛋白流体食品中具有一定的应用潜力。
2.5 大黄鱼鱼肉抗氧化肽的乳化能力
蛋白质是一种两性物质,随pH值的改变,其表面电荷情况、溶解性、乳化能力也随之发生变化[19]。由图6可知,在pH 3.0~10.0时,大黄鱼鱼肉抗氧化肽的乳化性呈先下降后上升的趋势,在pH 4.0 时乳化性最低。乳化性随pH值变化趋势与溶解性表现出较强的相似性,可能是蛋白质处于等电点时,吸附在油水界面的蛋白质减少,其乳化性降低[20];在等电点两侧,随着溶解性的增加,油水界面的蛋白质分子数量增加,乳化性增加。
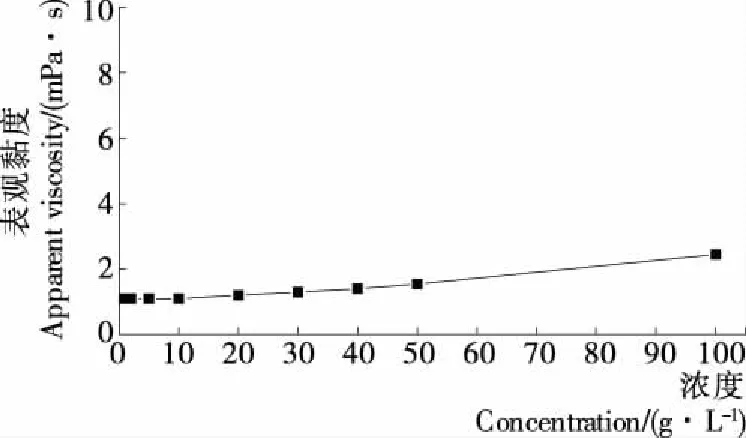
图5 不同浓度条件下大黄鱼鱼肉抗氧化肽的表观黏度
Figure 5 Effects of concentration on apparent viscosity of antioxidant peptides

图6 不同pH条件下大黄鱼鱼肉抗氧化肽的乳化性
由图7可知,与乳化性不同,大黄鱼鱼肉抗氧化肽的乳化稳定性随着pH值的上升呈先上升后下降的趋势,当pH 处于4.0时,乳化稳定性最强。这可能是在等电点时,抗氧化肽通过疏水相互作用,提高了其在油水界面上的覆盖度,加强了乳浊液的稳定性。

图7 不同pH条件下大黄鱼鱼肉抗氧化肽的乳化稳定性
2.6 大黄鱼鱼肉抗氧化肽的起泡性及泡沫稳定性
由图8、9可知,随着溶液pH的上升,抗氧化肽的起泡性及泡沫稳定性均呈先上升后降低的趋势,在等电点pH 4.0附近时,两者均达到最大值。蛋白质的起泡性与其迅速扩散并吸附至气液界面的能力有关,而泡沫稳定性与液膜的强度有关。接近或处于蛋白质的等电点时,蛋白质借助疏水相互作用聚集在一起,使蛋白膜厚度增加、强度增大,进而增加了气泡的稳定性[21-22]。

图8 不同pH条件下大黄鱼鱼肉抗氧化肽的起泡性

图9 不同pH条件下大黄鱼鱼肉抗氧化肽的泡沫稳定性
3 结论
本试验研究了大黄鱼鱼肉抗氧化肽的功能特性。结果表明,抗氧化肽的等电点在pH 4.0左右,接近等电点时,抗氧化肽的溶解性和乳化性表现为最低,而乳化稳定性、起泡性及泡沫稳定性最高。这主要与处于等电点时,多肽表面净电荷为零,相互排斥作用减弱,而疏水相互作用增强有关。
以大黄鱼鱼肉为原料制备的抗氧化肽,具有良好的水合性(溶解性、吸水性)、吸油性及流动性,一定的乳化性和起泡性。对大黄鱼来源的抗氧化肽进行功能特性的研究,为开发具有特定保健功能的食品提供了一定的理论指导依据。作为食源性生物活性肽,大黄鱼鱼肉抗氧化肽具有极大的开发潜力。
[1] 廖红梅, 高超, 韩承义, 等. 宁德市大黄鱼成鱼养殖成本收益分析[J]. 上海海洋大学学报, 2012, 21(1): 139-144.
[2] 刘家富, 刘招坤. 福建闽东大黄鱼Larimichthyscrocea(Richardson) 产业展望[J]. 现代渔业信息, 2008, 23(12): 3-5.
[3] KARATUG A, SACAN O, COSKUN Z M, et al. Regulation of gene expression and biochemical changes in small intestine of newborn diabetic rats by exogenous ghrelin[J]. Peptides, 2012, 33(1): 101-108.
[4] 刘晶, 苗颖, 赵征. 乳清蛋白肽抗氧化活性的研究进展[J]. 中国乳品工业, 2011, 39(4): 31-35.
[5] ZHANG Chong, ZHANG Ning-ning, LI Zhi-yu, et al. Stability of antioxidant peptides prepared from the large yellow croaker (Pseudosciaenacrocea)[J]. Current Topics in Nutraceutical Research, 2016(1): 37-48.
[6] KLOMPONG V, BENJAKUL S, KANTACHOTE D, et al. Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally (Selaroidesleptolepis) as influenced by the degree of hydrolysis and enzyme type[J]. Food Chemistry, 2007, 102(4): 1 317-1 327.
[7] 马勇, 张丽娜, 齐凤元, 等. 榛子蛋白质提取及功能特性研究[J]. 食品科学, 2008, 29(8): 318-322.
[8] 吴晓红, 刘经纬, 郑月明, 等. 红松种子水溶性蛋白吸水性、吸油性及溶解性的研究[J]. 食品工业科技, 2010(9): 140-143.
[9] 高海燕, 黄丹妮, 高莹莹, 等. 棉籽多肽功能性和稳定性的研究[J]. 食品与发酵工业, 2012, 38(8): 63-67.
[10] 陈日春, 郑宝东. 鲢鱼鱼鳞酶溶性胶原蛋白理化特性研究[J]. 中国食品学报, 2013, 13(12): 83-88.
[11] AGYARE K K, ADDO K, XIONG You-ling. Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH, temperature and salt[J]. Food Hydrocolloids, 2009, 23(1): 72-81.
[12] LIU Yong-le, LI Xiang-hong, CHEN Zhi-jun, et al. Characterization of structural and functional properties of fish protein hydrolysates from surimi processing by-products[J]. Food Chemistry, 2014, 151: 159-165.
[13] LIU Qian, KONG Bao-hua, XIONG You-ling, et al. Antioxidant activity and functional properties of porcine plasma protein hydrolysate as influenced by the degree of hydrolysis[J]. Food Chemistry, 2010, 118(2): 403-410.
[14] 李静, 冉旭. 大鲵皮胶原蛋白肽理化性质和功能特性研究[J]. 食品工业, 2016, 37(1): 217-222.
[15] BENELHADJ S, GHARSALLAOUI A, DEGRAEVE P, et al. Effect of pH on the functional properties of Arthrospira (Spirulina) platensis protein isolate[J]. Food Chemistry, 2016, 194: 1 056-1 063.
[16] 朱恩俊, 华从伶, 安莉. 大米多肽功能性质及制备方法的研究进展[J]. 食品与机械, 2010, 26(4): 142-145.
[17] 赵新淮, 侯瑶. 大豆蛋白限制性酶解对乳化性质和吸油性的影响[J]. 农业机械学报, 2009, 40(12): 159-163.
[18] KIM S G, YOO W, YOO B. Relationship between apparent viscosity and line-spread test measurement of thickened fruit juices prepared with a xanthan gum-based thickener[J]. Preventive Nutrition and Food Science, 2014, 19(3): 242-245.
[19] CATTANEO F, SAYAGO J E, ALBERTO M R, et al. Anti-inflammatory and antioxidant activities, functional properties and mutagenicity studies of protein and protein hydrolysate obtained fromProsopisalbaseed flour[J]. Food Chemistry, 2014, 161: 391-399.
[20] CHEN Chen, CHI Yu-jie, ZHAO Ming-yang, et al. Influence of degree of hydrolysis on functional properties, antioxidant and ACE inhibitory activities of egg white protein hydrolysate[J]. Food Science and Biotechnology, 2012, 21(1): 27-34.
[21] BURGOS-DIAZ C, PIORNOS J A, WANDERSLEBEN T, et al. Emulsifying and foaming properties of different protein fractions obtained from a novel Lupin Variety AluProt-CGNA®(Lupinusluteus)[J]. Journal of Food Science, 2016, 81(7): C1 699-1 706.
[22] WANG Zheng-shan, ZHANG Sha, VARDHANABHUTI B. Foaming properties of whey protein isolate and lambda-carrageenan mixed systems[J]. Journal of Food Science, 2015, 80(8): N1 893-1 902.
Effect of processing conditions on the functional properties of antioxidant peptides fromPseudosciaenacrocea
ZHANG Ning-ning1ZHENGBao-dong1ZHANGChong2LIZhi-yu1
(1.CollegeofFoodScience,FujianAgricultureandForestryUniversity,Fuzhou,Fujian350002,China; 2.FuzhouMunicipalFinanceOffice,Fuzhou,Fujian350002,China)
The functional properties of antioxidant peptides fromPseudosciaenacroceaunder different processing conditions were studied, including the solubility, water absorption, retention properties, fat absorption, apparent viscosity, foaming and emulsifying properties. The results showed that the isoelectric point of the antioxidant peptides was pH 4.0, and at this point, the peptides possessed the lowest solubility and emulsifying activity, while the highest emulsion stability and foaming ability and stability. Moreover, it was also found that the antioxidant peptides showed higher water and fat absorptions, fluidity and lower retention properties. Therefore, the antioxidant peptides fromP.croceacould be used as potential additives for functional food.
Pseudosciaenacrocea; antioxidant peptides; functional properties
10.13652/j.issn.1003-5788.2016.12.033
福建省海洋高新产业发展专项项目(编号:2013007)
张宁宁,女,福建农林大学讲师,博士。
郑宝东(1967-),男,福建农林大学教授,博士。 E-mail:zbdfst@163.com
2016-10-10

