酸诱导鱼糜凝胶的酸化条件研究及凝胶特性分析
吴雪微 姜启兴 许艳顺 于沛沛 夏文水
(江南大学食品学院,江苏 无锡 214122)
酸诱导鱼糜凝胶的酸化条件研究及凝胶特性分析
吴雪微 姜启兴 许艳顺 于沛沛 夏文水
(江南大学食品学院,江苏 无锡 214122)
以葡萄糖酸内酯(GDL)为酸化剂,研究温度和时间等凝胶化条件对酸诱导鱼糜凝胶理化性质的影响。结果表明:随着凝胶化温度从30 ℃升高到50 ℃,酸化速率升高,凝胶pH达到稳定所需要的时间缩短,GDL诱导鱼糜凝胶的凝胶强度逐渐下降,失水率逐渐上升。化学作用力结果表明GDL诱导鱼糜凝胶网络结构主要是通过疏水相互作用维持,且与凝胶强度趋势相一致。总巯基含量随着温度的升高逐渐升高,说明二硫键含量逐渐降低。SDS-PAGE结果显示GDL诱导鱼糜凝胶MHC条带强度受温度影响较小。当凝胶化条件为30 ℃、3.5 h时,可通过电镜扫描观察到一个致密均匀的网络结构。说明合适的凝胶化温度和时间可以显著提高鱼糜凝胶的质构特性,促使鱼糜形成一个致密均匀的网络结构。
鱼糜;葡萄糖酸内酯;凝胶化条件;凝胶特性
鱼糜制品具有高蛋白、低脂肪的特点,并且食用方便,从20世纪60年代以来,已成为一种极具发展前景的水产加工食品,其年产量由2004年的32.98万t增长到2014年的151.79万t,增长360.24%,是近年增长最快的水产食品之一[1-2]。传统的鱼糜凝胶制品通常是经过热诱导形成的,即先在较低的温度下(40 ℃左右)进行凝胶化,然后再加热到较高的温度(90 ℃左右),使其形成凝胶制品。但是,这种工艺得到的鱼糜制品只能在低温下冷藏销售,而如果凝胶化后采用更高的温度,如121 ℃杀菌,则对鱼糜凝胶的质构破坏比较厉害,特别是对于淡水鱼糜而言,凝胶强度本身就比海鱼鱼糜的差。因此,如何提高鱼糜制品的凝胶强度就成为近年来的研究热点。在鱼糜中添加改性淀粉[3]、多糖[4-5]等成分改善杀菌后鱼糜制品的凝胶强度是常用的方法。但近年来许多研究学者[6-8]发现,鱼肉蛋白在酸性条件下经过酸诱导也可以形成较好的蛋白凝胶。并且鱼糜凝胶制品经过酸化后质构变好,pH降低,产品具有较好的贮藏稳定性[9]。当鱼糜凝胶制品pH降到4.6以下时,就可以采用较为温和的巴氏杀菌方式杀灭食品中的微生物,达到常温保藏的目的。
葡萄糖酸内酯(GDL)是食品中常用的凝固剂,在水中可水解释放葡萄糖酸,降低体系pH值,从而减弱蛋白分子之间的静电斥力,加强蛋白分子之间的相互作用,使蛋白质凝聚形成凝胶。近年来,GDL作为酸化剂或凝固剂已被广泛应用于大豆制品[10]、乳制品[11-12]及水产制品[13-15]中。国内外已有很多研究[7,9]报道通过添加GDL可显著提高鱼糜制品的凝胶强度。但大部分的研究都集中于GDL添加量对鱼糜凝胶强度的影响,凝胶化条件(温度和时间)对酸诱导鱼糜理化性质的影响研究报道还很少,而且都集中于低温下的酸诱导[7-8],凝胶化时间过长,不利于工业化生产。因此,本研究采用相对较高的凝胶化温度,可以显著缩短凝胶化时间以适合工业化生产。
本研究拟选用养殖量大且价值低的鲢鱼为原料,采用葡萄糖酸内酯诱导鱼糜形成凝胶,重点考察凝胶化条件(温度和时间)对GDL诱导鱼糜凝胶特性和凝胶机理的影响,旨在为提高淡水鱼糜品质和开发新型鱼糜制品提供理论指导。
1 材料与方法
1.1 材料与试剂
冷冻鲢鱼糜:湖北省洪湖市井力水产食品有限公司;
食盐:无锡市华润万家超市;
葡萄糖酸内酯(GDL):含量≥99%,食品级,江西新黄海医药食品化工有限公司;
肠衣:山东庆云宜捷环保包装制品有限公司;
其它试剂:分析纯,国药集团化学试剂有限公司。
1.2 主要仪器设备
物性分析仪:TA.XT Plus型,英国Stable Micro Systems公司;
料理机:JYL-D020型,九阳股份有限公司;
pH计:FE28型,梅特勒-托利多仪器上海有限公司;
紫外-可见分光光度计;UV-1000型,上海天美科学仪器有限公司;
离心机:TGL-15B型,上海安亭科学仪器厂;
恒温水浴锅:DK-8AXX型,上海森信实验仪器有限公司。
1.3 试验方法设计
1.3.1 凝胶化条件的确定 将冷冻鱼糜在4 ℃冰箱解冻12 h,首先空斩5 min,然后加入添加量为鱼糜质量2.0%的食盐斩拌5 min,再加入添加量为配方总质量2.0%的GDL,混合均匀后挤入直径为25 mm的聚偏二氯乙烯肠衣中,然后置于30,35,40,45,50 ℃的恒温水浴锅中,测定鱼糜pH随时间的变化,取凝胶pH稳定的时间作为凝胶化时间。
1.3.2 鱼糜凝胶的制备 将冷冻鱼糜按照1.3.1进行预处理,然后分成6组,分别按照以下条件进行处理:① 加2.0%的GDL,30 ℃凝胶化3.5 h,100 ℃加热15 min;② 加2.0%的GDL,35 ℃凝胶化3.0 h,100 ℃加热15 min;③ 加2.0%的GDL,40 ℃凝胶化2.0 h,100 ℃加热15 min;④ 加2.0%的GDL,45 ℃凝胶化1.5 h,100 ℃加热15 min;⑤ 加2.0%的GDL,50 ℃凝胶化1.0 h,100 ℃加热15 min;⑥ 对照组:不加GDL,40 ℃凝胶化30 min,100 ℃加热15 min。加热结束后用冷水冷却30 min,备用。
1.4 测定方法
1.4.1 pH的测定 按GB 5009.237—2016执行。
1.4.2 凝胶强度的测定 采用TA.XT Plus物性分析仪进行测定,将剥去肠衣的鱼糜凝胶样品切成20 mm厚规格,每组样品测定至少平行6次。测试条件:选取P/5s球形探头,测试速度1 mm/s,压缩比50%。
1.4.3 失水率的测定 称取5 g左右鱼糜凝胶样品(m1),用2层滤纸包裹,置于50 mL离心管中,3 000 r/min离心15 min,离心后取出称其质量(m2)。每组样品测定至少平行3次。失水率按式(1)计算:
(1)
式中:
X——失水率,%;
m1——表示离心前鱼糜的质量,g;
m2——表示离心后鱼糜的质量,g。
1.4.4 化学作用力的测定 参照文献[16]。
1.4.5 总巯基含量的测定 参照文献[17]36。
1.4.6 SDS-聚丙烯酰胺凝胶电泳 根据文献[17]20,36,修改如下:采用10%的分离胶和5%的浓缩胶进行电泳,开始时电泳电压为90 V,待样品进入分离胶后改为110 V,电泳完成后,染色3 h,脱色1 h。
1.4.7 扫描电镜 将鱼糜凝胶样品切成3 mm×3 mm×1 mm的小块,在4 ℃下浸泡于2.5%的戊二醛溶液中24 h使其固定,再用0.2 mol/L的磷酸盐缓冲液(pH 7.2)漂洗3次,每次15 min,然后用去离子水冲洗1 h,接着依次用50%,70%,90%的乙醇梯度脱水处理,每次处理15 min,再用100%的乙醇脱水3次,每次10 min,最后,真空常温干燥24 h,经真空离子溅射镀金,用扫描电镜观察微观结构。
2 结果与讨论
2.1 凝胶化温度对凝胶体系pH的影响
GDL在含水体系中水解产生葡萄糖酸,降低体系pH,温度越高其水解速度越快,pH变化也越快,不同温度下GDL诱导鱼糜凝胶体系的pH变化情况见图1。
由图1可知,不同温度下,鱼糜凝胶的pH值均逐渐下降,并趋于稳定,而且温度越高,pH值下降得越快。30 ℃时需要3.5 h才能趋于稳定,而50 ℃时只需1.0 h就可以达到稳定,其余温度则在两者之间,35 ℃需要3.0 h达到稳定,40 ℃需要2.0 h达到稳定,45 ℃需要1.5 h达到稳定。因此,选择凝胶化条件分别为30 ℃、3.5 h,35 ℃、3.0 h,40 ℃、2.0 h,45 ℃、1.5 h,50 ℃、1.0 h。
2.2 凝胶化条件对鱼糜凝胶物理性质的影响
凝胶形成的速度会影响凝胶的特性,葡萄糖酸内酯诱导的酸凝胶,其凝胶速度直接取决于葡萄糖酸内酯水解产酸的快慢,而温度越高,葡萄糖酸内酯水解产酸越快,对不同凝胶化温度下形成凝胶的特性进行分析,结果见图2。
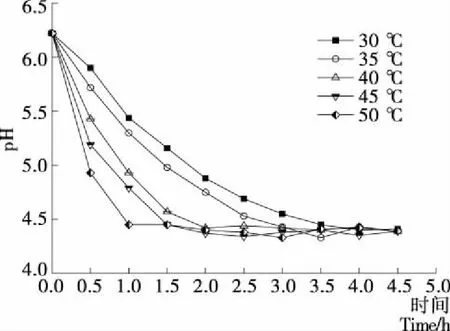
图1 凝胶化温度对GDL诱导鱼糜凝胶体系pH的影响
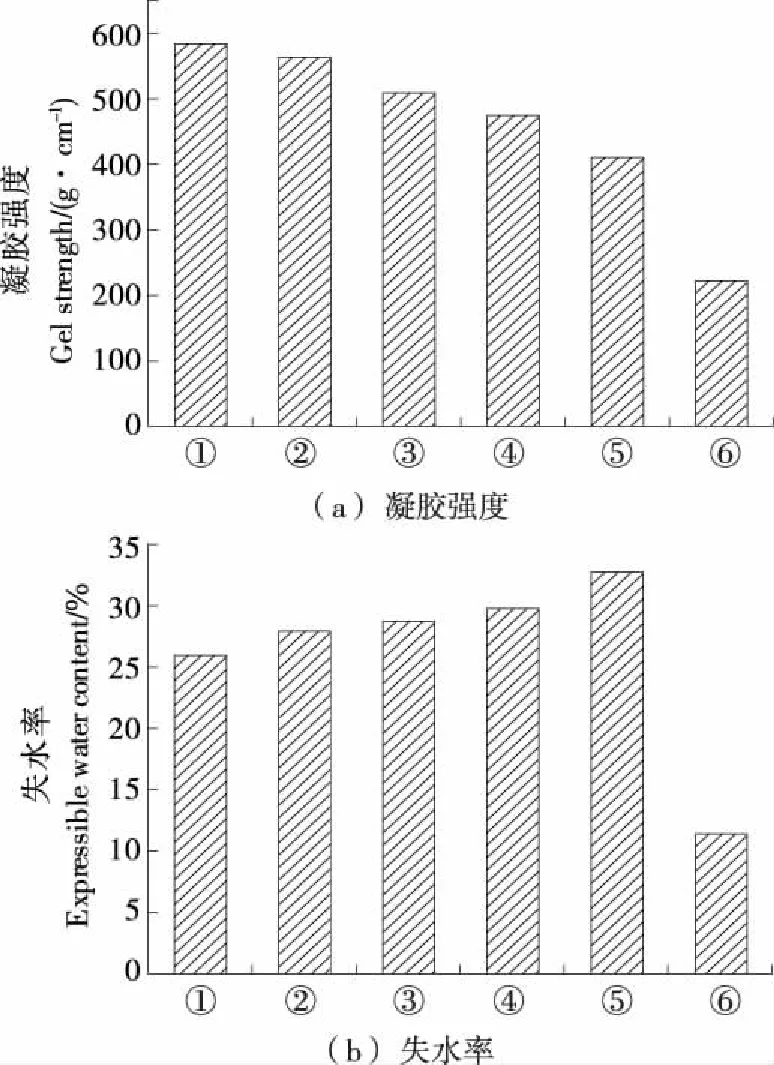
图2 凝胶化条件对GDL-诱导鱼糜凝胶强度和失水率的影响
Figure 2 Effect of setting condition on gel strength and expressible water content of GDL-induced surimi gel
由图2可知,随着凝胶化温度从30 ℃升高到50 ℃,酸化速率升高,酸化时间缩短,GDL诱导鱼糜凝胶的凝胶强度呈下降趋势。这可能是凝胶化温度较低时,pH降低较慢,因此蛋白质变性和聚集的速率也较慢,从而蛋白质之间有足够的时间进行有序的相互作用,可形成高强度的凝胶[7];而40~50 ℃凝胶强度较低可能是GDL酸化与热凝胶共同作用,从而导致凝胶速度过快,强度下降;另外,在50 ℃左右,鱼糜内源组织蛋白酶活性较高,破坏了鱼糜凝胶结构,也可能导致凝胶强度降低。这与闵维[18]29-30研究的不同酸化速率条件下形成的大豆蛋白凝胶结果相一致。相比于对照热诱导凝胶,GDL诱导鱼糜的凝胶强度较高。这可能是GDL降低了鱼糜凝胶pH,使鱼糜蛋白分子之间静电斥力减弱,从而蛋白分子之间相互作用增大,因此,形成的鱼糜凝胶强度较高。
另一方面,随着凝胶化温度的升高,GDL诱导鱼糜凝胶失水率呈现上升的趋势。这可能与30 ℃时形成更致密均一的凝胶网络结构有关,较好的凝胶网络结构能够把水束缚在里面,所以失水率相对较低。相比于对照热诱导凝胶,GDL诱导鱼糜凝胶的失水率要高一些。这可能是因为GDL降低了pH,蛋白分子之间相互作用增大,蛋白质同水的作用减小,因此失水率要高一些[19]。Weng Wu-yin等[20]对比研究热诱导鱼糜和酸诱导鱼糜时,也发现酸诱导鱼糜凝胶的失水率相对较高。
2.3 凝胶化条件对鱼糜凝胶化学作用力的影响
维持鱼糜凝胶网络结构的作用力主要包含离子键、氢键、疏水相互作用和二硫键。对不同凝胶化条件下凝胶体系的作用力进行分析,以进一步探讨GDL诱导鱼糜凝胶特性变化的机理,结果见图3。

A. 冷冻鱼糜原料 B. 加GDL的经30 ℃/3.5 h凝胶化后的鱼糜 C. 加GDL的经30 ℃/3.5 h凝胶化,100 ℃/15 min加热后的鱼糜凝胶
图3 凝胶化条件对GDL-诱导鱼糜凝胶离子键、氢键和疏水相互作用的影响
Figure 3 Effect of processing stage and setting condition on the ionic bond, hydrogen bond and hydrophobic interactions of GDL-induced surimi gel
由图3可知,在处理阶段,从冷冻鱼糜原料到加热杀菌后的鱼糜,离子键和氢键呈下降趋势,尤其是离子键,降低97.2%,说明离子键和氢键不是维持GDL诱导鱼糜凝胶结构的主要化学作用力,而疏水相互作用却呈上升趋势,说明疏水相互作用是维持GDL诱导鱼糜凝胶结构的主要化学作用力。随着凝胶化温度的升高,离子键和氢键变化不大,而疏水相互作用呈现下降的趋势,这与凝胶强度的趋势是一致的。这可能是因为缓慢降低pH,有助于降低蛋白质变性和聚集的速率,蛋白分子之间有足够的时间相互作用,因此,形成较多的疏水相互作用。相比于对照热诱导凝胶,GDL诱导鱼糜凝胶中疏水相互作用所占比例更大,说明在GDL诱导鱼糜凝胶过程中,疏水相互作用形成更多,可能是GDL降低pH,减弱了蛋白分子之间的静电斥力,因此,疏水相互作用形成更多。
2.4 凝胶化条件对总巯基含量的影响
二硫键也是反映凝胶结合的重要化学作用力,对可间接反映二硫键变化的总巯基含量进行了分析,结果见图4。
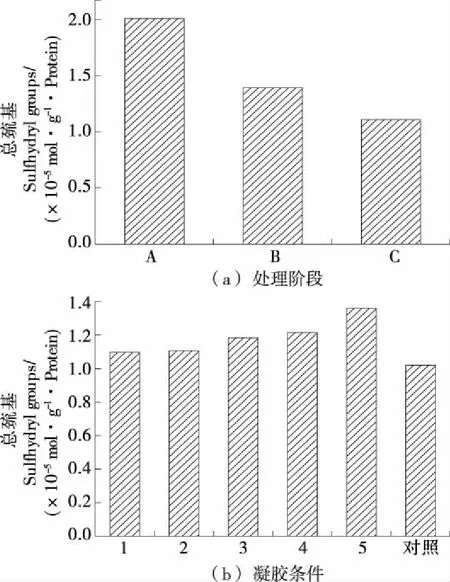
A. 冷冻鱼糜原料 B. 加GDL的经30 ℃/3.5 h凝胶化后的鱼糜 C. 加GDL的经30 ℃/3.5 h凝胶化,100 ℃/15 min加热后的鱼糜凝胶
图4 凝胶化条件对GDL诱导鱼糜凝胶总巯基含量的影响
Figure 4 Effect of processing stage and setting condition on the total sulfhydryl group content of GDL-induced surimi gel
由图4可知,在处理阶段,从冷冻鱼糜原料到加热杀菌后的鱼糜,总巯基含量是逐渐下降的,由此可间接表明二硫键交联程度的提高,说明二硫键是GDL诱导鱼糜凝胶形成的主要化学作用力。随着凝胶化温度的升高,GDL诱导鱼糜凝胶的总巯基含量逐渐上升,说明二硫键含量逐渐下降,这与凝胶强度的趋势相一致。这可能是凝胶化温度较低时,酸化速率较低,因此蛋白质变性和聚集速率也较慢,蛋白分子之间有足够的时间相互交联,从而保证了巯基的交联[18]30。相比于对照热诱导凝胶,GDL诱导鱼糜凝胶中总巯基含量相对较小,说明在GDL诱导鱼糜凝胶过程中,二硫键形成更多,可能是GDL降低了鱼糜凝胶pH,从而使蛋白分子之间静电斥力减弱,增强了蛋白分子表面游离巯基的互相接触,促进了二硫键的形成。
2.5 SDS-聚丙烯酰胺凝胶电泳
通过SDS-聚丙烯酰胺凝胶电泳分析了几种处理方式下凝胶蛋白组成的变化情况,结果见图5。
由图5可知,相比于冷冻鱼糜原料,加热或酸化后的鱼糜凝胶肌球蛋白重链(MHC)条带的强度明显减弱,表明肌球蛋白发生了明显的变化,在250 kDa以上区段出现明显的条带,表明可能有部分肌球蛋白发生了聚集,可能是加热或酸化诱导了MHC的交联,形成了高分子量的蛋白聚集体,它是构成鱼糜弹性凝胶体的重要部分。此外,对于GDL凝胶化处理(30~50 ℃)的鱼糜凝胶,MHC条带的强度明显弱于对照组热诱导凝胶,而在50~75 kDa的低分子量区段,出现了比较清晰的条带,在25 kDa附近也出现了比较明显的条带痕迹,表明有小分子物质产生,这说明可能是部分肌球蛋白发生了降解,这可能是由于在30~50 ℃的GDL凝胶化加热过程中内源蛋白酶的作用导致的,当然GDL水解产生的酸对蛋白质降解可能也有一定的贡献;而50 ℃条件下MHC条带的强度比30~45 ℃的要弱一些,可能是该温度下内源蛋白酶活性更高,而GDL产生的酸也更快地作用。因此,综上可见对于GDL凝胶化处理的样品,MHC条带强度的减弱可能是蛋白聚集和降解共同作用的结果。

Raw. 冷冻鱼糜原料 MHC. 肌球蛋白重链 Actin. 肌动蛋白
相比于GDL诱导凝胶,对照热诱导凝胶MHC条带的强度要明显高一些,说明添加GDL可以在很大程度上提高MHC的交联,其交联程度要高于对照热诱导。另外,在所有样品中原料肉的肌动蛋白条带要明显粗于其他样品,表明经过加热后肌动蛋白发生了一定的变化,而酸诱导凝胶(30~50 ℃)与对照热诱导凝胶之间肌动蛋白的条带未发现明显差异,表明在酸诱导过程中肌动蛋白的稳定性较好。Weng Wu-yin等[20]对比研究鱼糜原料、热诱导鱼糜与酸诱导鱼糜凝胶时,也得到了类似的结论。
2.6 扫描电镜
用扫描电子显微镜(SEM)对不同凝胶化条件下鱼糜凝胶的微观结构进行了观察,结果见图6。
由图6可知,在凝胶化条件为30 ℃、3.5 h时,GDL诱导鱼糜凝胶的网络结构较为致密均匀,而且孔隙度较小,从而凝胶强度较大,而在凝胶化条件为50 ℃、1.0 h时,形成的鱼糜凝胶孔隙度较大,凝胶结构较弱,因此,凝胶强度较小。这可能是因为凝胶化温度较高时,酸化速率也较高,导致凝胶酸化过快,从而形成较大的聚集体,因此凝胶的微观结构也变得较为粗糙[18]30。A.L.F.Cavallieri等[21]在研究不同酸化速率对WPI凝胶网络结构的影响时也得到了类似的结果。另一方面,相比于GDL诱导凝胶,对照热诱导凝胶的微观结构也较为粗糙,这可能是因为GDL降低了鱼糜凝胶pH,减弱了鱼糜蛋白分子之间的静电斥力,加强了蛋白分子之间的相互作用,因此,形成的鱼糜凝胶网络结构较为致密均匀。

图6 不同凝胶化条件下的GDL诱导鱼糜凝胶以及对照热诱导凝胶的扫描电镜图
Figure 6 Scanning electron micrograph of GDL-induced surimi gel at different setting conditions. Con, heat-induced surimi gel
3 结论
综上可见,相对于传统热凝胶而言,添加GDL可以显著提高鱼糜制品的凝胶强度,且凝胶化温度和时间对GDL诱导鱼糜凝胶的质构特性也有显著的影响。随着凝胶化温度的升高,凝胶强度呈下降的趋势,因此,要想获得较好质构品质的鱼糜凝胶,需采用低温长时的凝胶化条件。但是,实际应用过程中温度过低会导致凝胶化工序耗时太长,如4 ℃条件下一般都要凝胶化24 h[9,22],不利于工业化生产。从提高凝胶强度的角度出发,GDL凝胶化温度建议选择30~35 ℃左右,凝胶化时间3.0~3.5 h比较合适。本研究为开发新型酸诱导鱼糜制品提供了良好的理论指导。但限于时间仅对化学作用力等理化指标进行了研究,后续可通过研究蛋白质构象的变化等来进一步深入分析鱼糜凝胶特性变化的机理。
[1] 袁晓初, 赵文武. 中国渔业统计年鉴: 2015[Z]. 北京: 中国农业出版社, 2015: Ⅰ-Ⅳ.
[2] 傅玉祥, 柳正. 中国渔业统计年鉴: 2005[Z]. 北京: 中国农业出版社, 2005: Ⅰ-Ⅳ.
[3] KONG Wen-jun, ZHANG Tao, FENG Dan-dan, et al. Effects of modified starches on the gel properties of Alaska Pollock surimi subjected to different temperature treatments [J]. Food Hydrocolloids, 2015, 56(1): 20-28.
[4] 陈斌. 热杀菌及添加物对罗非鱼鱼糜肠质构的影响[D]. 广州: 华南理工大学, 2011: 42-48.
[5] 张莉莉. 高温(100~120 ℃)处理对鱼糜及其复合凝胶热稳定性的影响[D]. 青岛: 中国海洋大学, 2013: 75-78.
[6] TECHARATANAKRAI B, NISHIDA M, IGARASHI Y, et al. Effect of setting conditions on mechanical properties of acid-induced Kamaboko gel from squid Todarodes pacificus mantle muscle meat[J]. Food Science and Technology, 2011, 77(3): 439-446.
[7] XU Yan-shun, JIANG Qi-xing, XIA Wen-shui. Effect of glucono-δ-lactone acidification and heat treatment on the physicochemical properties of silver carp mince [J]. LWT-Food Science and Technology, 2011, 44(9): 1 952-1 957.
[8] RIEBROY S, BENJAKUL S, VISESSANGUAN W, et al. Acid-induced gelation of natural actomyosin from Atlantic cod (Gadus morhua) and burbot (Lota lota) [J]. Food Hydrocolloids, 2009, 23(1): 26-39.
[9] 杨方, 许艳顺, 黄政豪, 等.内酯鱼肉豆腐的凝胶特性及感官品质研究[J]. 食品与机械, 2011, 27(1): 87-90.
[10] KOHYAMA K, SANO Y, DOI E. Rheological characteristics and gelation mechanism of tofu (soybean curd) [J]. Journal of Agricultural and Food Chemistry, 1995, 43(7): 1 808-1 812.
[11] KIM B Y, KINSELLA J E. Rheological changes during slow acid induced gelation of milk byD-glucono-δ-lactone[J]. Journal of Food Science, 1989, 54(4): 894-898.
[12] PHADUNGATH C. The mechanism and properties of acid-coagulated milk gels[J]. Songklanakarin J Sci Technol, 2005, 27(2): 433-448.
[13] RIEBROY S, BENJAKUL S, VISESSANGUAN W, et al. Comparative study on acid-induced gelation of myosin from Atlantic cod (Gardus morhua) and burbot (Lota lota) [J]. Food chemistry, 2008, 109(1): 42-53.
[14] XU Yan-shun, XIA Wen-shui, JIANG Qi-xing, et al. Acid-induced aggregation of actomyosin from silver carp (Hypophthalmichthys molitrix) [J]. Food Hydrocolloids, 2012, 27(2): 309-315.[15] TOTOSAUS A, MONTEJANO J G, SALAZAR J A, et al. A review of physical and chemical protein-gel induction[J]. International Journal of Food Science & Technology, 2002, 37(6): 589-601.
[16] PÉREZ-MATEOS M, LOURENÇO H, MONTERO P, et al. Rheological and biochemical characteristics of high-pressure-and heat-induced gels from blue whiting (Micromesistius poutassou) muscle proteins [J]. Journal of Agricultural and Food Chemistry, 1997, 45(1): 44-49.
[17] 许艳顺. 发酵鲢鱼鱼糜凝胶形成及其机理研究[D]. 无锡: 江南大学, 2010.
[18] 闵维. 大豆蛋白-多糖复合凝胶流变学及微结构研究[D]. 广州: 华南理工大学, 2010.
[19] 李红. 食品化学[M]. 北京: 中国纺织出版社, 2015: 88-89.
[20] WENG Wu-yin, ZHENG Wen-xiang. Silver carp (Hypophthalmichthys molitrix) surimi acid-induced gel extract characteristics: a comparison with heat-induced gel [J]. International Journal of Food Properties, 2015, 18(4): 821-832.
[21] CAVALLIERI A L F, DA CUNHA R L. The effects of acidification rate, pH and ageing time on the acidic cold set gelation of whey proteins[J]. Food Hydrocolloids, 2008, 22(3): 439-448.
[22] 许艳顺, 葛黎红, 姜启兴, 等. 盐添加量和热处理对内酯鱼糜凝胶品质的影响[J]. 食品工业科技, 2013, 34(11): 69-76.
Study on acidizing conditions of acid-induced surimi gel and analysis of gel properties
WU Xue-weiJIANGQi-xingXUYan-shunYUPei-peiXIAWen-shui
(SchoolofFoodScienceandTechnology,JiangnanUniversity,Wuxi,Jiangsu214122,China)
This research investigated the influence of setting temperature and time on the gel properties of glucono-δ-lactone (GDL)-induced surimi gel. The results showed that the acidification rate increased with the temperature increasing from 30 ℃ to 50 ℃. Consequently, the time for the gel pH to stabilize decreased which induce to the decline of gel strength and the increase of the expressible water content of GDL-induced surimi gel. It is indicated that protein subunits solubilized in various solvents revealed that the formation of GDL-induced surimi gel mainly through hydrophobic interactions and it increased with temperature. The content of total SH increased with temperature indicating the reduction of disulphide bond content. The results of SDS-PAGE revealed that the temperature has little impact on the MHC band intensity. The microstructure is compact and fine through the SEM under the condition of 30 ℃, 3.5 h.
surimi; glucono-δ-lactone; setting conditions; gel properties
10.13652/j.issn.1003-5788.2016.12.004
国家大宗淡水鱼产业技术体系项目(编号:CARS-46);“江苏省食品安全与质量控制协同创新中心”项目
吴雪微,女,江南大学在读硕士研究生。
姜启兴(1977—),男,江南大学副教授,博士。 E-mail: qixing@163.com
2016-10-13

